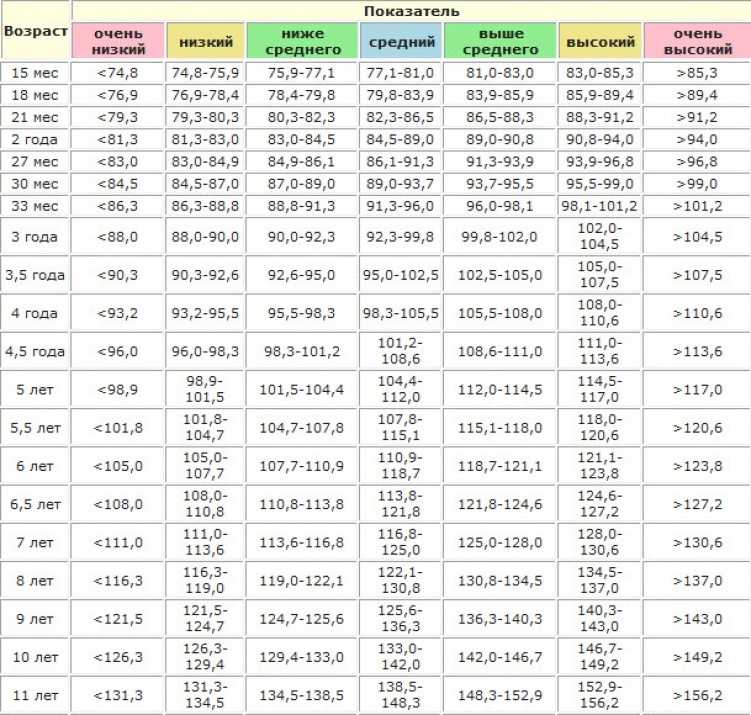
Таблица веса до года: рост – вес ребенка до года
Краткая история периодической таблицы
Соблюдение
Деболина М. Гухарей
7 февраля 2021 г.
Периодическая таблица элементов часто встречается в классах, коридорах университетских городков и библиотеках, но это больше, чем табличная организация чистых веществ. Ученые могут использовать эту таблицу для анализа реакционной способности элементов, прогнозирования химических реакций, понимания тенденций периодических свойств различных элементов и для предположений о свойствах тех элементов, которые еще предстоит открыть.
В современной периодической таблице элементы расположены по их атомным номерам и периодическим свойствам. Несколько ученых работали почти столетие, чтобы собрать элементы в этот формат.
Wikimedia
Среди ученых, которые работали над созданием таблицы элементов, были (слева направо) Антуан Лавуазье, Иоганн Вольфанг Доберейнер, Джон Ньюлендс и Генри Мозли.
В 1789 году французский химик Антуан Лавуазье попытался разделить элементы на металлы и неметаллы.
Прорыв произошел с публикацией пересмотренного списка элементов и их атомных масс на первой международной конференции по химии в Карлсруэ, Германия, в 1860 году. Они пришли к выводу, что водороду будет присвоен атомный вес 1 и атомный вес другие элементы определялись бы сравнением с водородом. Например, углерод в 12 раз тяжелее водорода и будет иметь атомный вес 12.
Дмитрий Менделеев
Лотар Мейер
Британский химик Джон Ньюлендс первым расположил элементы в периодической таблице в порядке возрастания атомных масс. Он обнаружил, что каждые восемь элементов обладают сходными свойствами, и назвал это законом октав.
В 1869 году русский химик Дмитрий Менделеев создал структуру, которая стала современной периодической таблицей, оставив пробелы для элементов, которые еще предстоит открыть. Располагая элементы в соответствии с их атомным весом, если он обнаруживал, что они не вписываются в группу, он переставлял их. Менделеев предсказал свойства некоторых неоткрытых элементов и дал им такие названия, как «экаалюминий» для элемента со свойствами, подобными алюминию. Позже экаалюминий был открыт как галлий. Некоторые расхождения остались; положение некоторых элементов, таких как йод и теллур, не могло быть объяснено.
Немецкий химик Лотар Мейер создал версию периодической таблицы, аналогичную Менделеевской, в 1870 году. Он оставил пробелы для неоткрытых элементов, но никогда не предсказывал их свойства. В 1882 году Лондонское королевское общество наградило Менделеева и Мейера медалью Дэви. Позднее открытие элементов, предсказанных Менделеевым, в том числе галлия (1875 г.
Wikimedia
Периодическая таблица Менделеева 1869 года на русском языке с заголовком, который переводится как «Эксперимент над системой элементов … на основе их атомного веса и химического сходства». .
Понятия о субатомных частицах не существовало в 19 -м -м веке. В 1913 году английский физик Генри Мозли использовал рентгеновские лучи для измерения длин волн элементов и соотнес эти измерения с их атомными номерами. Затем он переставил элементы в периодической таблице на основе атомных номеров. Это помогло объяснить несоответствия в более ранних версиях, в которых использовались атомные массы.
В периодической таблице горизонтальные ряды называются периодами, причем металлы находятся в крайнем левом углу, а неметаллы — в правом. Вертикальные столбцы, называемые группами, состоят из элементов со схожими химическими свойствами.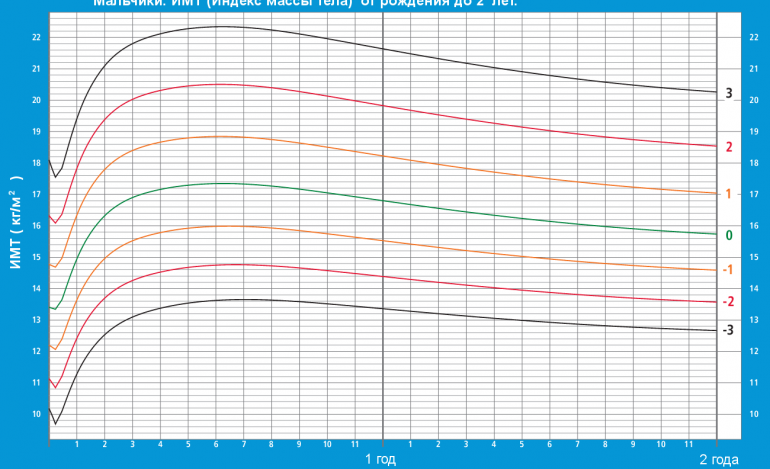 Периодическая таблица предоставляет информацию об атомной структуре элементов и химическом сходстве или различии между ними. Ученые используют таблицу для изучения химических веществ и проведения экспериментов. Он используется для разработки химических веществ, используемых в фармацевтической и косметической промышленности, и аккумуляторов, используемых в технологических устройствах.
Периодическая таблица предоставляет информацию об атомной структуре элементов и химическом сходстве или различии между ними. Ученые используют таблицу для изучения химических веществ и проведения экспериментов. Он используется для разработки химических веществ, используемых в фармацевтической и косметической промышленности, и аккумуляторов, используемых в технологических устройствах.
ЮНЕСКО объявила 2019 год Международным годом Периодической таблицы элементов в ознаменование 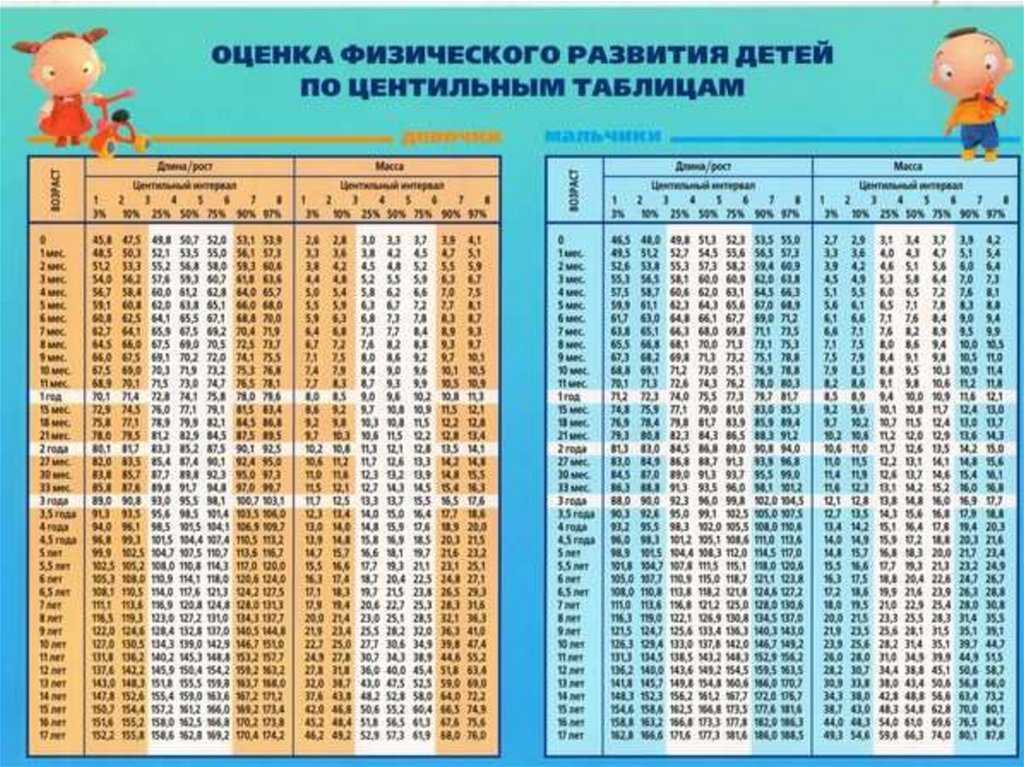 Эти инициативы продемонстрировали, как элементы являются неотъемлемой частью нашей повседневной жизни в лекарствах, пестицидах и литиевых батареях.
Эти инициативы продемонстрировали, как элементы являются неотъемлемой частью нашей повседневной жизни в лекарствах, пестицидах и литиевых батареях.
На своем веб-сайте, посвященном празднованию, ЮНЕСКО написала: «Периодическая таблица химических элементов — это больше, чем просто справочник или каталог всех известных атомов во Вселенной; по сути, это окно во вселенную, помогающее расширить наше понимание окружающего мира».
Наслаждайтесь чтением ASBMB сегодня?
Станьте участником, чтобы ежемесячно получать печатное издание и еженедельно цифровое издание.
Узнать больше
Деболина М. Гухарай
Деболина М. Гухарай получила докторскую степень. по химии из Университета Содружества Вирджинии. Она очень увлечена и увлечена научным общением.
Расскажите свою историю
Ежегодное собрание
Энгелькинг стремится сбалансировать исследования и медицину
19 января 2023 г.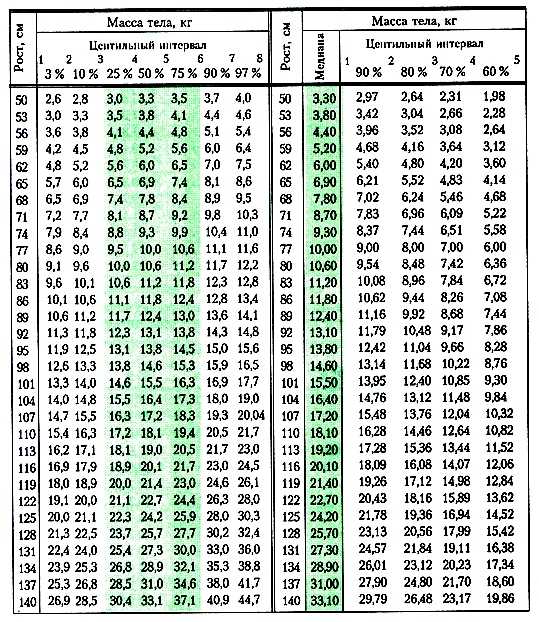
Люк Энгелькинг, младший помощник редактора Journal of Lipid Research, расскажет о своей работе во время сессии JLR Spotlight на Discover BMB 2023.
Подробнее
Ежегодное собрание
Шрайбер случайно наткнулся на безопасную гавань в науке
18 января 2023 г.
Рената Шрайбер, младший помощник редактора Journal of Lipid Research, расскажет о своей работе во время сессии JLR Spotlight на Discover BMB 2023.
Подробнее
Ежегодное собрание
Airola ищет секреты ферментов, модифицирующих липиды
18 января 2023 г.
Майкл Айрола, младший помощник редактора Journal of Lipid Research, расскажет о своей работе во время сессии JLR Spotlight на Discover BMB.
Подробнее
Новости журнала
Из журналов: MCP
13 января 2023 г.
Почему два лекарства от рака лучше, чем одно? Роль гликома в злокачественных новообразованиях. Куда движется иммунопептидомика. Прочтите о статьях на эти темы, недавно опубликованных в журнале Molecular & Cellular Proteomics.
Подробнее
Новости журнала
Из журналов: JLR
10 января 2023 г.
Молекула для переработки ЛПНП. Обзор роли сортилина в заболевании. Новые мыши помогают отслеживать экспрессию PLD. Прочтите о статьях по этим темам, недавно опубликованных в Journal of Lipid Research.
Подробнее
Новости
Первые полные структуры респираторных белков растений
8 января 2023 г.
Биологи Калифорнийского университета в Дэвисе определили структуру белков, жизненно важных для производства энергии в бобах мунг. Понимание этих белков дает представление об основах биологии растений, реакции на стресс и потенциальном улучшении урожая.
Подробнее
Атомный вес | Определение, единицы измерения и таблица
- Ключевые люди:
- Йонс Якоб Берцелиус Джон Далтон Станислао Канниццаро Амедео Авогадро Огюст Лоран
- Похожие темы:
- атом химическая шкала атомного веса физическая шкала атомного веса Гипотеза Праута
Просмотреть весь связанный контент →
Резюме
Прочтите краткий обзор этой темы
атомный вес , также называемый относительная атомная масса , отношение средней массы атомов химического элемента к некоторому эталону. С 1961 стандартной единицей атомной массы была одна двенадцатая массы атома изотопа углерода-12. Изотоп — это один из двух или более видов атомов одного и того же химического элемента, которые имеют разные атомные массовые числа (протоны + нейтроны). Атомный вес гелия составляет 4,002602, это среднее значение, отражающее типичное соотношение естественного содержания его изотопов.
Понятие атомного веса является фундаментальным для химии, поскольку большинство химических реакций протекают в соответствии с простым числовым соотношением между атомами. Поскольку почти всегда невозможно подсчитать непосредственно вовлеченные атомы, химики измеряют реагенты и продукты путем взвешивания и делают выводы с помощью расчетов с использованием атомных весов. Стремлением определить атомный вес элементов занимали крупнейшие химики 19 и начала 20 веков. Их тщательная экспериментальная работа стала ключом к химической науке и технике.
Надежные значения атомного веса служат важной цели совсем по-другому, когда химические товары покупаются и продаются на основе содержания одного или нескольких определенных компонентов. Примерами являются руды дорогих металлов, таких как хром или тантал, и промышленная химическая кальцинированная сода.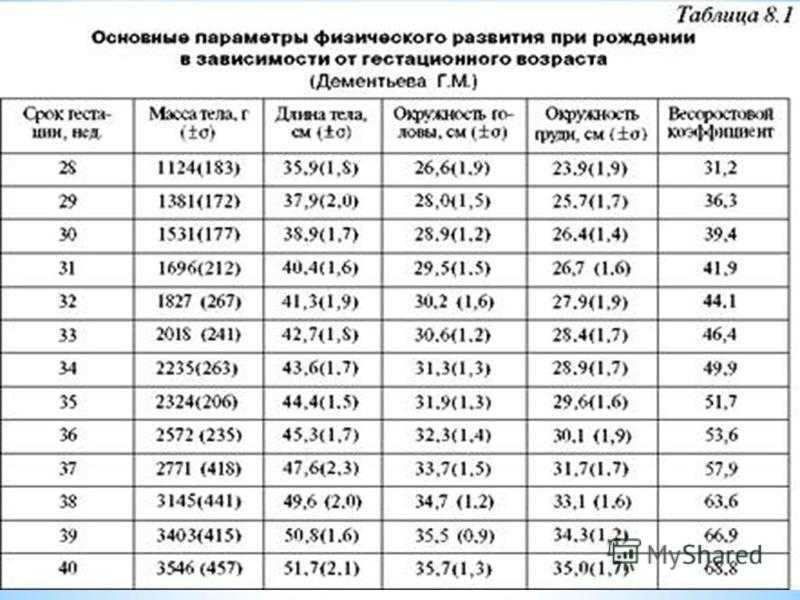
Первоначальным стандартом атомной массы, установленным в 19 веке, был водород со значением 1. Примерно с 1900 по 1961 год в качестве эталона использовался кислород с присвоенным значением 16. Единицей атомной массы была таким образом определяется как 1 / 16 масса атома кислорода. В 1929 году было обнаружено, что природный кислород содержит небольшое количество двух изотопов, немного более тяжелых, чем самый распространенный, и что число 16 представляет собой средневзвешенное значение трех изотопных форм кислорода, встречающихся в природе. Эта ситуация считалась нежелательной по нескольким причинам, и, поскольку можно определить относительные массы атомов отдельных изотопов, вскоре была установлена вторая шкала с 16 как значением основного изотопа кислорода, а не значением натуральная смесь. Эта вторая шкала, предпочитаемая физиками, стала известна как физическая шкала, а более ранняя шкала продолжала использоваться в качестве химической шкалы, которую предпочитали химики, которые обычно работали с природными смесями изотопов, а не с чистыми изотопами.
Эта вторая шкала, предпочитаемая физиками, стала известна как физическая шкала, а более ранняя шкала продолжала использоваться в качестве химической шкалы, которую предпочитали химики, которые обычно работали с природными смесями изотопов, а не с чистыми изотопами.
Хотя две шкалы различались незначительно, соотношение между ними не могло быть точно установлено из-за незначительных различий в изотопном составе природного кислорода из разных источников. Было также сочтено нежелательным иметь две разные, но тесно связанные шкалы для одних и тех же величин. По обеим этим причинам химики и физики установили новую шкалу в 1961 году. Эта шкала, основанная на углероде-12, требовала лишь минимальных изменений в значениях, которые использовались для химических атомных весов.
Поскольку образцы встречающихся в природе элементов содержат смеси изотопов с разным атомным весом, Международный союз теоретической и прикладной химии (IUPAC) начал публиковать значения атомного веса с неопределенностью. Первым элементом, атомный вес которого получил неопределенность, была сера в 1951 году. К 2007 году 18 элементов имели связанные неопределенности, а в 2009 году ИЮПАК начал публиковать диапазоны атомного веса некоторых элементов. Например, атомный вес углерода равен [12,0096, 12.0116].
Первым элементом, атомный вес которого получил неопределенность, была сера в 1951 году. К 2007 году 18 элементов имели связанные неопределенности, а в 2009 году ИЮПАК начал публиковать диапазоны атомного веса некоторых элементов. Например, атомный вес углерода равен [12,0096, 12.0116].
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
В таблице приведен список химических элементов и их атомный вес.
 0096, 12.0116]
0096, 12.0116] 304, 24.307]
304, 24.307]