Состав числа 10 из единиц подготовительная группа: Конспект занятия по ФЭМП в подготовительной группе. Состав числа 10 | План-конспект занятия по математике (подготовительная группа):
Конспект занятия по ФЭМП в подготовительной группе. Состав числа 10 | План-конспект занятия по математике (подготовительная группа):
Конспект занятия по ФЭМП в подготовительной группе. Состав числа 10
Занятие по формированию элементарных математических представлений в подготовительной группе с ОНР на тему «Помоги Машеньке вернуться домой»
Цель: познакомить детей с составом числа 10 из единиц.
Задачи:
I. Образовательная:
– Продолжать учить составлять число 10 из единиц.
– Познакомить с записью числа 10.
– Закрепить навыки счета в прямом и обратном порядке в пределах 10.
– Закреплять умение соотносить числа в пределах 10 с количеством предметов.
– Закрепить умения детей выкладывать из счетных палочек цифру 10.
– Закрепить умения детей выкладывать числовой ряд в пределах 10.
– Закрепить умения детей называть предыдущее и последующее число и их соседей.
II. Развивающая:
– Развитие психических процессов: память, внимание, логическое мышление.
– Развитие мелкой моторики.
– Развитие связной речи.
III. Воспитательная:
– Совершенствовать морально-волевые качества воспитанников посредством развития усидчивости, умения выслушать собеседника, выносить собственное суждение.
Материал: иллюстрация Машеньки, цифры от 1 -10, схема, условные обозначения: цифры от 1-4, карточки с группой предметов (от 1-10), раскраски, карандаши, пеналы, счетный материал, тетради, прописи, магнитная доска, круги одного размера от 1-10, числовой ряд от 1-10, счетные палочки, мяч
Ход
1. Вводная часть
Организация детей в кругу.
– Ребята, посмотрите, я сегодня утром в группе нашла такую схему, на ней изображены цифры, а сзади схемы текст, давайте прочитаем и узнаем, зачем эти цифры нарисованы, слушайте внимательно: «Здравствуйте, дети! Помогите мне, пожалуйста, я ходила в лес погулять, а обратно возвращалась поздно вечером, было уже темно и я заблудилась, и теперь не могу найти дорогу домой. Эта схема поможет вам найти мне дорогу домой. С уважением, Машенька!»
С уважением, Машенька!»
– Ребята, кому нужна наша помощь? Поможем?
– На схеме нарисованы цифры от 1 до 4.
– В группе у нас эти цифры тоже спрятались, их нужно найти и выполнить задания. Если все задания выполним правильно, то Машенька сможет найти дорогу домой.
2. Основная часть
– Первая цифра какая? (один)
– Ищем в группе цифру один. Дети ищут по группе. Воспитатель с конверта читает первое задание.
– Первое задание называется «Назови цифру» (выполняется на ковре в кругу). Я буду вам говорить цифру, а вам нужно назвать её соседей, цифру, которая стоит перед ней и после неё.
Воспитатель кидает мяч детям по очереди и называет цифру, а дети называют её соседей.
– Молодцы, а теперь я называю цифру, а вы мне ту, которая стоит за этой цифрой.
– Это задание вы выполнили верно. Идем дальше. Какая по счету следующая цифра? (два)
– Ищем в группе цифру 2. Дети ищут по группе.
– От цифры 1 до цифры 2 нам нужно на нашей схеме провести линию, чтобы Машенька нашла дорогу. Ребенок рисует линию карандашом.
Ребенок рисует линию карандашом.
Воспитатель с конверта читает второе задание.
– Второе задание называется «Составь цифру 10» Выполняется за столами.
– Ребята, садитесь за столы.
– Тася, выйди ко мне и посчитай, сколько кругов на доске. Ребенок считает.
– Как составлено число 10? (1 розовый круг, 1 красный круг, 1 желтый круг и т.д.)
– Маша, выйди ко мне и разложи на доске числовой ряд от 1 до 10, а остальные из пенала достаньте цифры и разложите перед собой.
– Покажи нам, как обозначается число 10. Ребенок указывает на цифру 10.
– Антон, выйди и посчитай цифры, а теперь в обратном порядке.
– Ребята, Антон правильно посчитал?
– Молодец, садись.
– Теперь возьмите 6 счетных палочек и выложите их них цифру 10.
Проверяю у каждого ребенка на правильность выполнения задания.
– Молодцы, все верно выложили. Положите счетные палочки на место.
– После цифры 2 какая следующая? (три)
– Ищем в группе цифру три. Дети ищут по группе.
– От цифры 2 до цифры 3 проведите линию.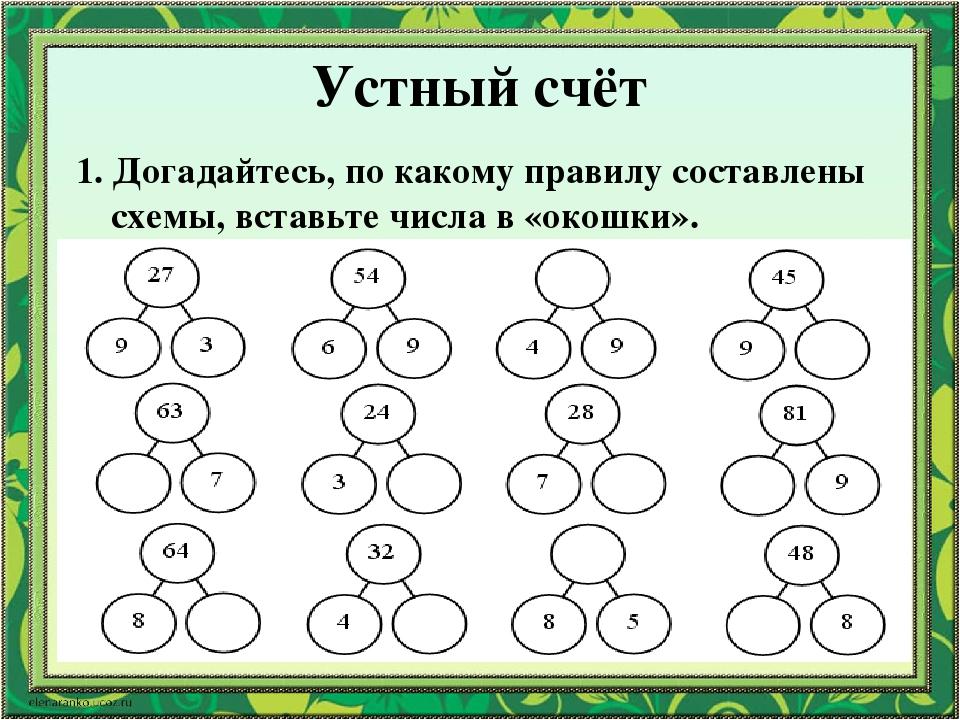
– Следующее задание называется «Соотнеси»
– Каждому из вас я раздам карточки. У кого-то цифра изображена, а у кого группа предметов и нужно найти пару, количество предметов должно совпадать с цифрой. Дети ищут себе пару и встают друг с другом.
– Молодцы, теперь давайте поменяемся карточками. Воспитатель меняет карточки детям.
– С этим заданием мы справились. После цифры 3 какая следующая? (четыре)
– Ищите цифру четыре в группе. Дети ищут цифру.
– Это наша последняя цифра в нашей схеме. Давайте проведем линию от цифры 3 к цифре 4. Ребенок проводит линию.
– Четвертое задание называется «Запиши цифру 10»
– Садитесь за столы. Открывайте тетради. Показываю детям нужное задание, которое необходимо выполнить.
– Карандашом обведите по точкам цифру 10.
Проверяю у каждого ребенка на правильность выполнения задания.
– Молодцы, закройте тетради и отодвиньте на край стола.
3. Заключительная часть:
– Осталось последнее задание. Я буду задавать вам вопросы, если вы ответите правильно, то будете получать часть пазла, как все детали соберем, тогда сможем помочь Машеньке вернуться домой.
Вопросы:
1. Назови геометрическую фигуру с тремя углами. (треугольник)
2. Сколько сторон у квадрата? (4)
3. Назови соседей числа 8 (7 и 9)
4. Сколько ножек у стола? (4)
5. Какой день недели идет после четверга? (пятница)
6. На какую геометрическую фигуру похоже яйцо? (овал)
7. Сколько времен года? Назови их (4. Осень, зима, весна, лето)
8. Посчитайте по порядку от 0 до 10.
9. Какой день недели идет после воскресенья? (понедельник)
10. Назови части суток (утро, день, вечер, ночь)
– Молодцы, на все вопросы ответили верно, мы получили все детали. Давайте посмотрим, что у нас получилось.
– Да, ребята, это Машенька. Она нашла дорогу домой и говорит вам огромное спасибо за помощь и дарит вам небольшие подарки.
– Давайте попрощаемся с Машенькой.
– До свидания, Машенька!
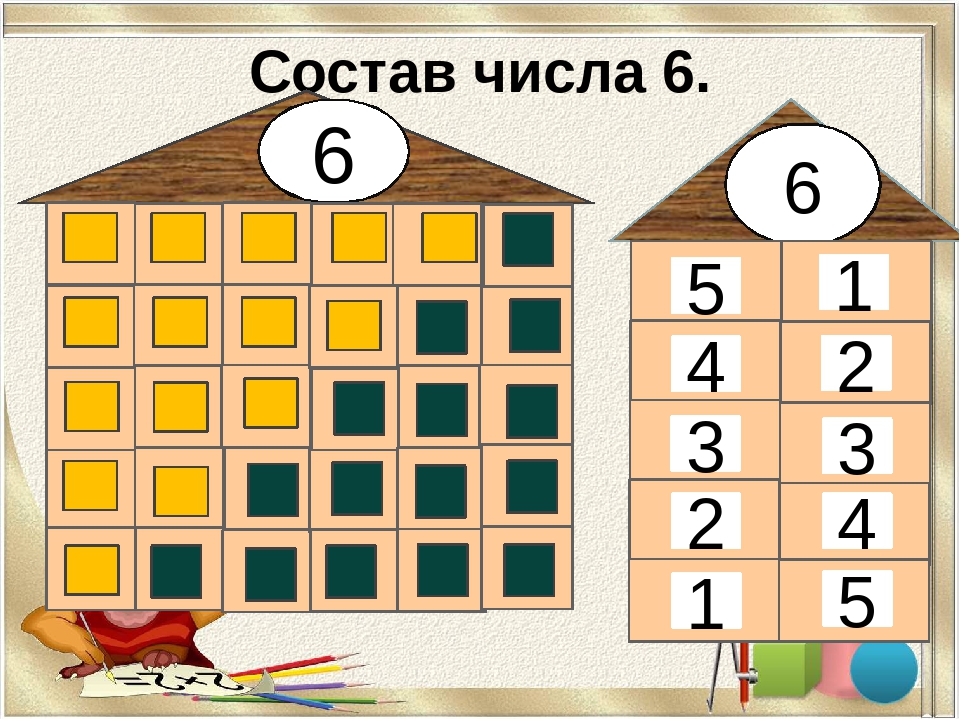
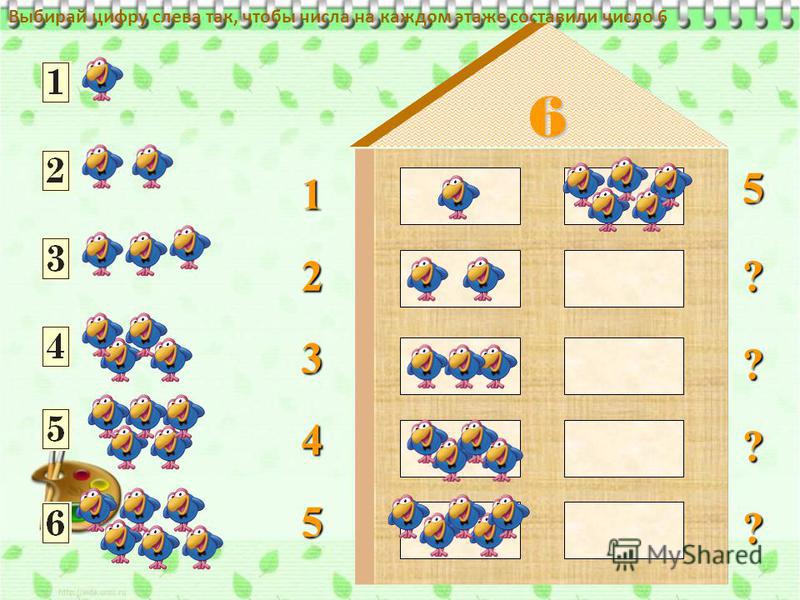
Тема: «Количественный состав числа 6 из единиц» Цель: закрепить знания детей о количественном составе числа из единиц. Задачи: Образовательные:
Развивающие:
Воспитательные:
Ход занятия Организационный момент В.В.: Ребята, посмотрите все на меня, своими умными глазками. У нас сегодня необычный день, к нам пришли гости. Давайте повернемся к гостям и поздороваемся. А еще к нам на занятие пришла Светлана Сергеевна. Вспомните, где работает С.С.? Дети: С.С. работает в школе. В.В.: Кем работает С.С. в школе? Дети: Учителем начальных классов. В.В.: Так вот, сегодня С. С. пришла посмотреть, что знают и умеют ребята подготовительной группы. Ребята, вы хотите хорошо учиться в школе? Дети: Да В. Основная часть С.С.: Ребята, у меня для вас есть загадка. А вы умеете отгадывать загадки? Дети: Да С.С.: Братцев этих ровно семь Вам они известны всем Каждую неделю кругом Ходят братцы друг за другом Попрощается последний Появляется передний (Дни недели) Какой сегодня день недели? Какой будет завтра? Какой был вчера? Сколько всего дней недели? Вспомните, в каких сказках и пословицах встречается число 7? Дети: «Волк и семеро козлят», «Цветик-семицветик», «Белоснежка и семь гномов», «Семеро одного не ждут», «Семь раз отмерь, один раз отрежь» «Игра семь гномов» В.В.: А теперь давайте красиво сядем на ковер и посмотрим, из какой сказки эти персонажи? Дети: «Белоснежка и семь гномов» С.С.: Ребята, а кто написал эту сказку? Дети: Братья Гримм В.В.: Посмотрите, гномов столько же, сколько…. Дети: Дней недели В.В.: Дело в том, что наши гномы забыли свои имена, но у них есть цифры на колпаках. А мы с вами уже знаем, что каждому дню недели соответствует определенное число. Давайте поможем гномам вспомнить свои имена? Аня, назови, пожалуйста, этот день недели (7) Дети: Воскресенье. В.В.: Почему ты так считаешь, объясни? И так с каждой цифрой. С.С.: Выложи по порядку и назови рабочие дни (1 ребенок выкладывает рабочие дни) Чем люди занимаются в эти дни? Дети: Ходят в школу, в детский сад, на работу. Выложи и назови выходные дни (1 ребенок) Чем люди занимаются в эти дни? Дети: Отдыхают, едут на дачу, идут в парк и т.д. Итог: Молодцы ребята! Вы хорошо знаете дни недели. В.В.: Ребята, давайте подойдем к доске и вспомним, кто на прошлом занятии приходил к нам в гости? Дети: Дикие животные В. (Дети считают слева на право) Дети: 5 В каком направлении мы считали? Дети: с лева на право А если мы посчитаем справа налево? Дети: тоже будет 5 В.В.: Какой из этого можно сделать вывод? Дети: Количественный счет не зависит от направления В.В.: Обозначьте число 5 цифрой А теперь давайте пересчитаем, по сколько разных животных изображено на доске. Дети: 1 волк, 1 заяц, 1еж и т.д. В.В.: Значит, из скольких единиц состоит число 5? Дети: Число 5 состоит из 5 единиц В.В.: Это 1,1,1,1 и еще 1 С.С.: А сегодня к нам в гости пришла лиса. Посчитайте, сколько всего стало животных? Дети: всего 6 животных С.С.: Обозначьте число 6 цифрой Ребята, посмотрите на доску и скажите, как вы думаете, о чем сегодня мы будет разговаривать на занятии. Дети: О составе числа 6 из единиц В.В.: Ребята у нас было 5 животных, пришла 1 лиса. Дети: Стало 6 животных В.В.: Какой можно сделать вывод? Дети: 5+1=6 Дети: Число 6 состоит из 6 единиц. 6 – это 1,1,1,1,1 и еще 1 В.В.: Молодцы ребята, а теперь давайте немножко поиграем Физкультурная минутка «Звериная зарядка» Д/и «Составь число 6 из группы предметов» С.С.: Ребята, посмотрите, у каждого из вас наклеены геометрические фигуры. Для чего они вам нужны? Дети: Мы будем работать в парах С.С.: Как правильно нужно работать в паре? Дети: Уметь договариваться, быть дружными, разговаривать не громко В.В.: Найдите свою пару и внимательно послушайте задание На столах лежат геометрические фигуры. Вам нужно составить группу из 6 разных геометрических фигур. Обозначить каждую фигуру цифрой 1. Рассказать, как у вас составлено число 6. Дети: Число 6 составлено из: одного желтого круга,одного красного квадрата, одного зеленого овала и т. Рефлексия С.С.: Какое задание или игра понравились больше всего? Что было трудным? Какие числа были главными сегодня? Чему вы научились? Итог. В.В.: Молодцы, ребята. Наше занятие подошло к концу. Давайте попрощаемся с гостями и скажем им до свидания! |
Подготовительная курсовая работа | Магистр наук в области PA Studies
Наши рекомендации по подготовительным курсам не являются обязательным условием для поступления, и мы рассмотрим все заявки независимо от предшествующей курсовой работы. Тем не менее, конкурентоспособные абитуриенты готовы добиться академического успеха в нашей программе. Мы настоятельно рекомендуем абитуриентам пройти все подготовительные курсы до подачи заявки на участие в программе и в течение последних десяти (10) лет. Обратите внимание, что курсовая работа в процессе или старше десяти (10) лет не будет рассматриваться в процессе проверки. Курсовая работа должна быть выполнена только на уровне высшего образования; Кредит AP или курсовая работа, выполненная в старшей школе, не соответствуют нашим рекомендациям по курсовой работе и не будут учитываться в процессе проверки. Программа не предоставляет Advanced Placement . Курсовая работа может быть завершена на уровне бакалавриата или пост-бакалавриата или через аспирантуру в любом региональном аккредитованном высшем учебном заведении. Хотя мы предпочитаем, чтобы рекомендуемая подготовительная курсовая работа выполнялась лично, в нашем обзоре мы будем рассматривать курсовую работу, выполненную онлайн.
Программа не предоставляет Advanced Placement . Курсовая работа может быть завершена на уровне бакалавриата или пост-бакалавриата или через аспирантуру в любом региональном аккредитованном высшем учебном заведении. Хотя мы предпочитаем, чтобы рекомендуемая подготовительная курсовая работа выполнялась лично, в нашем обзоре мы будем рассматривать курсовую работу, выполненную онлайн.
Поскольку подготовительная курсовая работа настоятельно рекомендуется, но не является обязательной, мы не делаем исключений и не освобождаем от требований для подготовительной курсовой работы. Если курс не соответствует описанным здесь критериям (например, является специализированным курсом по психологии или статистике или был пройден более десяти лет назад), мы отметим этот курс, но он не будет соответствовать нашим рекомендациям по подготовке к курсовой работе.
Пожалуйста, обратитесь к нашему допуску FAQ для получения дополнительной информации.
Мы настоятельно рекомендуем абитуриентам пройти следующие курсы перед подачей заявления:
Это можно заполнить отдельно, как минимум один семестр/четверть (3-5 единиц или кредитов) анатомии и как минимум один семестр/четверть (3-5 единиц или кредитов) физиологии (включая животных, человека или физические упражнения). Физиология) или в виде двух семестров/четвертей (6-10 единиц или кредитов) комбинированного курса анатомии и физиологии. Мы настоятельно рекомендуем, чтобы эти курсы включали лабораторный компонент.
Физиология) или в виде двух семестров/четвертей (6-10 единиц или кредитов) комбинированного курса анатомии и физиологии. Мы настоятельно рекомендуем, чтобы эти курсы включали лабораторный компонент.
Это должно включать как минимум один семестр/четверть (3-5 единиц или кредитов) общей химии, органической химии или биохимии.
Это должно включать как минимум один семестр/квартал (3-5 единиц или кредитов) общей статистики или биостатистики. Обратите внимание, что специализированные курсы по статистике, такие как «Статистика для психологии», не удовлетворяют этой рекомендации.
Это должно включать как минимум один семестр/четверть (3-5 единиц или кредитов) по общей психологии. Обратите внимание, что специализированные курсы психологии, такие как психология развития или психология старения, не удовлетворяют этой рекомендации.
В дополнение к вышеперечисленным курсам мы рекомендуем абитуриентам перед подачей заявления пройти три (3) дополнительных курса по биологическим наукам для старших классов (3–5 единиц или кредитов каждый). Общие примеры курсов биологии для старших классов включают, помимо прочего: биохимию, клеточную биологию, эмбриологию, эндокринологию, генетику, гистологию, иммунологию, микробиологию, молекулярную биологию, неврологию, фармакологию и вирусологию.
Общие примеры курсов биологии для старших классов включают, помимо прочего: биохимию, клеточную биологию, эмбриологию, эндокринологию, генетику, гистологию, иммунологию, микробиологию, молекулярную биологию, неврологию, фармакологию и вирусологию.
Обратите внимание, что некоторые учебные заведения предлагают курсы более низкого уровня в этих областях. Большинство курсов старших классов предлагаются только для продвинутых студентов в четырехгодичных учебных заведениях, и их количество составляет 300 или более. Однако есть исключения (например, система Калифорнийского университета классифицирует курсы под номерами 100-19).9 как высший отдел). Чтобы убедиться, что ваша курсовая работа соответствует нашим рекомендациям по курсу для старших классов, убедитесь, что ваш курс классифицируется вашим учебным заведением как старший. Если курс явно не классифицирован вашим учебным заведением как высший дивизион, он не будет соответствовать нашим рекомендациям по курсу.
Мы предлагаем абитуриентам, особенно тем, у кого нет большого предшествующего опыта в области здравоохранения, рассмотреть возможность прохождения курса медицинской терминологии до поступления. Не рекомендуется какой-либо конкретный тип курса или единицы/кредиты.
Не рекомендуется какой-либо конкретный тип курса или единицы/кредиты.
EudraLex – Том 10
Том 10 публикации “Правила регулирования лекарственных средств в Европейском Союзе” содержит руководящие документы, применимые к клиническим исследованиям.
Ряд документов в Томе 10 пересматривается и обновляется, чтобы привести их в соответствие с изменениями, требуемыми Регламентом о клинических испытаниях (ЕС) № 536/2014. Кроме того, были подготовлены новые документы, охватывающие новые аспекты, введенные тем же Регламентом.
Чтобы провести различие между документами, применимыми к клиническим испытаниям, санкционированным в соответствии с Директивой 2001/20/ЕС (т. е. действующими применимыми документами), и документами, относящимися к клиническим испытаниям, санкционированными в соответствии с Регламентом (ЕС) № 536/2014, эти документы будут перечислены на двух отдельных страницах веб-сайта Eudralex Volume 10.
До тех пор, пока Положение о клинических испытаниях не станет применимым, спонсоры должны следовать документам, относящимся к Директиве о клинических испытаниях.
В течение переходного периода, который продлится 3 года, начиная с момента вступления Регламента в действие, оба комплекта документов будут применяться соответствующим образом, и на них следует ссылаться соответственно в соответствии с законодательством, в соответствии с которым проводится Клиническое исследование.
По окончании переходного периода все клинические испытания должны проводиться в соответствии с Регламентом и только в соответствии с набором документов, применимым к Регламенту.
Хотя это не является обязательным, заинтересованным сторонам рекомендуется уже принять во внимание ряд аспектов, изложенных в новых или обновленных документах, опубликованных на странице, посвященной Положению о клинических испытаниях, и применить их к тем клиническим испытаниям, которые разрешены в соответствии с Директивой. , насколько это возможно и в соответствии с правовой базой Директивы.
Комплект документов, применимых к клиническим испытаниям, разрешенным в соответствии с Регламентом ЕС № 536/2014
Рекомендательный документ по децентрализованным элементам в клинических исследованиях |
Этот рекомендательный документ (декабрь 2022 г. |
Рекомендации спонсорам по управлению влиянием войны в Украине на клинические испытания |
| Координационная группа по клиническим исследованиям (рабочая группа экспертов HMA по классификации, оценке и надзору за клиническими исследованиями из национальных агентств) опубликовала набор рекомендаций по переводу участников исследований из центров в Украине в центры в ЕС/ЕЭЗ в рамках одного и того же многонационального клинического исследования. |
Руководство по проведению клинических исследований во время пандемии COVID-19 |
| Руководство (ОБНОВЛЕННАЯ ВЕРСИЯ v5 – 10 февраля 2022 г.) Слайды вебинара о Руководстве по управлению клиническими исследованиями во время пандемии COVID-19 Вебинар о Руководстве по управлению клиническими исследованиями во время пандемии COVID -19 пандемия |
Глава I – Заявка и документы заявки
- Шаблоны документов для раздела ФОРМА КТИС
- Образец заявления о соответствии Регламенту (ЕС) 2016/679: PDF/Word
- Шаблоны документов приложения Часть II
- Вознаграждение участникам испытаний – Шаблон: PDF/Word
- Руководство по гармонизации: PDF
- Биографическая справка исследователя, шаблон: PDF/Word шаблон согласия и процедуры набора пациентов: PDF/Word
- Соблюдение применимых правил для биологических образцов: PDF/Word
Глава II.
 Отчеты по безопасности
Отчеты по безопасности- Руководство ICH E2F. Примечание к руководству по обновленным отчетам о безопасности при разработке (сентябрь 2010 г.) в Главе V
Глава III – Качество
- Руководство по обязанностям спонсора в отношении обработки и транспортировки исследуемых лекарственных средств для человека в соответствии с Надлежащей клинической практикой и Надлежащей производственной практикой
- Шаблон декларации уполномоченного лица об эквивалентности GMP ЕС для исследуемых лекарственных средств, произведенных в третьих странах: PDF-версия – версия Word (май 2013 г.)
- Подробное руководство Комиссии от 8 декабря 2017 г. по надлежащей производственной практике для исследуемых лекарственных средств в соответствии второй абзац статьи 63(1) Регламента (ЕС) № 536/2014
- Шаблон для выпуска серии ИЛП (применяется с даты вступления в силу Регламента (ЕС) № 536/2014 о клинических испытаниях)
- Основной формат разрешения производителя Союза (июнь 2013 г.
 )
) - Руководство по требованиям к документации по химическому и фармацевтическому качеству исследуемых лекарственных средств в клинических испытаниях (редакция 2 – январь 2022 г.) исследуемые лекарственные средства в клинических исследованиях (редакция 2 – январь 2022 г.)
- Вспомогательные лекарственные средства в клинических исследованиях (ред. 2, июнь 2017 г.)
Глава IV – Инспекции
- Руководство по проведению инспекций надлежащей клинической практики (август 2017 г.)
- Приложение I – к руководству по проведению инспекций надлежащей клинической практики – исследовательский центр (сентябрь 2017 г.)
- Приложение II – к руководству по проведению проверок надлежащей клинической практики – клинические лаборатории (август 2017 г.)
- Приложение III – к руководству по проведению инспекций надлежащей клинической практики – компьютерные системы (март 2018 г.)
- Приложение IV – к руководству по проведению проверок надлежащей клинической практики – спонсор и CRO (август 2017 г.
 )
) - Приложение VI – к руководству по проведению инспекций надлежащей клинической практики – ведение учета и архивирование документов (июнь 2017 г.)
- Приложение VII – к руководству по проведению проверок надлежащей клинической практики – биоаналитическая часть, фармакокинетический и статистический анализ исследований биоэквивалентности (июнь 2017 г.)
- Руководство по подготовке инспекций надлежащей клинической практики (август 2017 г.)
- Руководство по подготовке отчетов об инспекциях GCP и передаче результатов инспекций (февраль 2022 г.)
- Руководство по координации инспекций GCP, запрашиваемых в контексте заявок на получение регистрационного удостоверения для взаимного признания и децентрализованных процедур и сотрудничества между государствами-членами (март 2018 г.)
- Приложение V – к руководству по проведению проверок надлежащей клинической практики – Подразделение фазы I
Глава V – Дополнительные документы
- Краткое руководство для спонсоров – Регламент 536/2014 на практике
- Руководство по сообщениям о серьезных нарушениях
- Приложение III b – Информация, которая должна быть представлена вместе с уведомлением о серьезном нарушении
- Ускорение клинических исследований в ЕС (ACT EU) – Реализация инициативы ЕС по преобразованию клинических испытаний
- Документ с вопросами и ответами – Регламент (ЕС) 536/2014
Обратите внимание, что некоторые вопросы и ответы и раздел этого документа все еще обсуждаются в группе экспертов по клиническим испытаниям и поэтому не еще включено. Обновленные версии документа будут публиковаться постепенно.
Обновленные версии документа будут публиковаться постепенно. - Вопросы и ответы по комплексным клиническим испытаниям (май 2022 г.)
Этот документ был разработан в тесном сотрудничестве между Европейским агентством по лекарственным средствам, Координационной группой по клиническим испытаниям и Экспертной группой по клиническим испытаниям. Он был одобрен этими группами и Руководящей группой ACT ЕС. - Вопросы и ответы о взаимосвязи между Регламентом (ЕС) 536/2014 о клинических испытаниях лекарственных средств для человека (CTR) и Регламентом (ЕС) 2017/746
Этот документ был разработан и одобрен Координационной группой по медицинскому оборудованию (MDCG). ) и Группа экспертов по клиническим испытаниям (CTEG). - Вопросы и ответы о взаимосвязи между Положением о клинических испытаниях и Общим положением о защите данных (апрель 2019 г.)
Этот документ применим в соответствии с Положением о клинических испытаниях, за исключением вопроса 11, который объясняет текущую ситуацию в соответствии с Директивой о клинических испытаниях.
- Руководство по стратегиям выявления и снижения рисков для первых испытаний на людях и ранних клинических испытаний исследуемых лекарственных средств — EMEA/CHMP/SWP/28367/07 Rev. 1 (июль 2017 г.)
- Руководство по надлежащей клинической практике — ICH E6(R2) — EMA/CHMP/ICH/135/1995 (2016)
- Подходы, пропорциональные риску, в клинических испытаниях (апрель 2017 г.) – февраль 2018 г.)
- Краткое руководство по добросовестной практике
- Этические аспекты клинических исследований лекарственных средств, проводимых с участием несовершеннолетних
- Подробное руководство по надлежащей клинической практике, относящееся к лекарственным средствам передовой терапии – ( Обновление в настоящее время продолжается )
- Руководство по содержанию, управлению и архивированию мастер-файла клинического исследования
- Список национальных контактных лиц
Глава VI – Законодательство
Регламент (ЕС) № 536/2014 Европейского парламента и Совета от 16 апреля 2014 г.
 по клиническим испытаниям лекарственных средств для человека, а также об отмене Директивы 2001/20/EC
по клиническим испытаниям лекарственных средств для человека, а также об отмене Директивы 2001/20/ECРегламента Комиссии (ЕС) 2017/556 от 24 марта 2017 г. о подробных процедурах проверки надлежащей клинической практики. процедуры в соответствии с Регламентом (ЕС) № 536/2014 Европейского парламента и Совета
Делегированный регламент Комиссии (ЕС) 2017/1569 (для лингвистических версий нажмите здесь) от 23 мая 2017 г., дополняющий Регламент (ЕС) 536/2014 Европейского парламента и Совета путем указания принципов и руководящих указаний по надлежащей производственной практике для исследовательских лекарственные средства для использования человеком и порядок проведения инспекций (применяется с даты вступления в силу Регламента (ЕС) № 536/2014 о клинических испытаниях)
Исполнительный Регламент Комиссии (ЕС) 2022/20 от 7 января 2022 г., устанавливающий правила о применении Регламента (ЕС) № 536/2014 Европейского парламента и Совета в отношении установления правил и процедур сотрудничества государств-членов в оценке безопасности клинических испытаний (Текст, имеющий отношение к ЕЭЗ)
Комплект документов, применимых к клиническим испытаниям, разрешенным в соответствии с Директивой 2001/20/EC
Совместное техническое уведомление EC/EMA/HMA для спонсоров относительно постоянного соблюдения законодательства ЕС в отношении клинических испытаний после выхода Соединенного Королевства из ЕС
Общая информация (июль 2006 г.
 )
)Глава I. Заявка и форма заявки
- Подробное руководство для запроса разрешения на клиническое исследование лекарственного средства для человека в компетентные органы, уведомление о существенных изменениях и декларация окончания судебного разбирательства.
- Пересмотренное приложение 1: версия в формате PDF — версия в формате Word (редакция 4 от ноября 2009 г.; обновлено 22 ноября 2019 г.). В версии 8.0 EudraCT используется редакция 4 формы заявки на клинические испытания от ноября 2009 г. (обновлена 22 ноября 2019 г.). Для получения дополнительной информации посетите веб-сайт EudraCT.
- Форма уведомления о существенном изменении: версия в формате PDF — версия в формате Word (версия 3 от июня 2010 г.)
- Форма заявления об окончании пробного периода: версия в формате PDF — версия в формате Word (редакция 19(июнь 2019 г.)
- Подробное руководство по форме заявки и документации, представляемой в заявке на получение заключения Комитета по этике в отношении клинического исследования лекарственных средств для человека (редакция 1 от февраля 2006 г.
 )
) - Подробное руководство по Европейская база данных клинических испытаний (база данных EUDRACT) (редакция от апреля 2004 г.)
Глава II. Отчеты о безопасности
- Подробное руководство по сбору, проверке и представлению отчетов о нежелательных явлениях/реакциях, возникающих в результате клинических испытаний лекарственных средств для человека (“СТ-3”)
- Руководство ICH E2F — Примечание к руководству по обновленным отчетам о безопасности разработки (сентябрь 2010 г.)
Глава III — Качество исследуемого лекарственного средства страны: версия в формате PDF – версия в формате Word (май 2013 г.)
- Надлежащая практика производства исследуемых лекарственных средств
- Надлежащая производственная практика производства исследуемых лекарственных средств (февраль 2010 г.)
- Подробное руководство Комиссии от 8 декабря 2017 г. по надлежащей производственной практике для исследуемых лекарственных средств в соответствии со вторым абзацем статьи 63(1) Регламента (ЕС) № 536/2014 (применяется с даты вступления в силу Регламент (ЕС) № 536/2014 о клинических испытаниях)
- Шаблон для выпуска серии ИЛП (применяется с даты вступления в силу Регламента (ЕС) № 536/2014 о клинических испытаниях)
- Union Basic Format for Разрешение производителя (октябрь 2014 г.
- Руководство по требованиям к документации по химико-фармацевтическому качеству исследуемых лекарственных средств в клинических исследованиях
- Руководство по требованиям к документации по качеству биологических исследуемых лекарственных средств в клинических исследованиях (сентябрь 2018 г.)
- Руководство по исследуемым лекарственным средствам ) и «неисследуемые лекарственные средства» (НИМП) (ред. 1, март 2011 г.)
Глава IV – Инспекции
- Руководство по подготовке инспекций GCP (июнь 2008 г.)
- Рекомендация по процедурам инспекции для проверки соблюдения надлежащей клинической практики (июль 2006 г.)
- Руководство по проведению инспекций GCP (июнь 2008 г.)
- Приложение I к Руководство по проведению инспекций GCP – Исследовательский центр (июнь 2008 г.)
- Приложение II к Руководству по проведению инспекций GCP – Клинические лаборатории (июнь 2008 г.)
- Приложение III к Руководству по проведению инспекций GCP – Компьютерные системы (июнь 2008)
- Приложение IV к Руководству по проведению инспекций GCP – Спонсор и CRO (июнь 2008 г.
 )
) - Приложение V к Руководству по проведению инспекций GCP – Единицы этапа I (ноябрь 2008 г.) Инспекции GCP – Ведение учета и архивирование документов (март 2010 г.)
- Приложение VII к Руководству по проведению инспекций GCP – Биоаналитическая часть, фармакокинетический и статистический анализ исследований биоэквивалентности (ноябрь 2008 г.)
- Руководство по координации инспекций GCP и сотрудничеству между инспекторами GCP, референтными и заинтересованными государствами-членами и CMD(h) в контексте оценки соответствия заявок на получение торговой лицензии GCP для взаимного признания и децентрализованных процедур (июнь 2009 г. )
- Руководство по обмену отчетами об инспекциях GCP в соответствии со статьей 15(2) Директивы 2001/20/ЕС (редакция 1 – май 2009 г.)
- Руководство по обмену информацией об инспекциях и результатах GCP (июнь 2008 г.)
- Процедура стандартизации записей инспекций GCP в EudraCT (ноябрь 2008 г.)
- Руководство по подготовке отчетов об инспекциях надлежащей клинической практики (июнь 2008 г.
 )
) - Рекомендации по квалификации инспекторов, проверяющих соответствие клинических исследований положениям надлежащей клинической практики Практика (июль 2006 г.)
Глава V. Дополнительная информация
- Руководство по стратегиям выявления и снижения рисков для первых и ранних клинических испытаний исследуемых лекарственных средств на людях — EMEA/CHMP/SWP/28367/07 Rev. 1 (июль 2017 г.)
- Руководство по надлежащей клинической практике — ICH E6(R2) — EMA/CHMP/ICH/135/1995 (2016)
- Руководство по надлежащей клинической практике, относящееся к лекарственным средствам передовой терапии (2019)
- Руководство по содержанию, управлению и архивирование мастер-файла клинического исследования
- Документ «Вопросы и ответы» — Версия 11.0 (май 2013 г.)
- Этические аспекты клинических исследований лекарственных средств, проводимых среди детей:
- Оригинальная версия (2008 г.)
- Руководство 2008/C168/02 по полям данных из Европейской базы данных клинических исследований (EudraCT), которые могут быть включены в Европейскую базу данных по лекарственным средствам
- Список полей, содержащихся в базе данных клинических исследований “EudraCT”, подлежащих публиковаться в соответствии со статьей 57(2) Регламента (ЕС) № 726/2004 и руководством по его применению 2008/C168/02 (июнь 2019 г.
- Руководства 2009/C28/01 в отношении информации, касающейся педиатрических клинических исследований, внесен в базу данных ЕС по клиническим испытаниям (EudraCT) и в информацию, которая будет обнародована Европейским агентством по лекарственным средствам (EMA) в соответствии со статьей 41 Регламента (ЕС) № 19.01/2006
- Список областей, которые должны быть обнародованы из EudraCT для педиатрических клинических испытаний в соответствии со статьей 41 Регламента (ЕС) № 1901/2006 и руководством по его применению 2009/C28/01 (июнь 2019 г.)
- Руководство по публикации и публикация информации о результатах клинических испытаний в связи с выполнением Статьи 57(2) Регламента (ЕС) № 726/2004 и Статьи 41(2) Регламента (ЕС) № 1901/2006
- Техническое руководство по формат полей данных информации о результатах клинических исследований, представляемых в соответствии со статьей 57(2) Регламента (ЕС) № 726/2004 и статьей 41(2) Регламента (ЕС) № 19.01/2006 (январь 2013 г.


 В.: Тогда внимательно слушайте и правильно отвечайте на вопросы. Все готовы?
В.: Тогда внимательно слушайте и правильно отвечайте на вопросы. Все готовы? ?
? В.: Сколько всего животных приходило? Давайте посчитаем.
В.: Сколько всего животных приходило? Давайте посчитаем. Сколько животных стало?
Сколько животных стало?
 ) был создан в рамках приоритетного действия 8 «Методологические руководства» инициативы глав медицинских учреждений ЕС ACT Агентства, Европейская комиссия и Европейское агентство по лекарственным средствам.
) был создан в рамках приоритетного действия 8 «Методологические руководства» инициативы глав медицинских учреждений ЕС ACT Агентства, Европейская комиссия и Европейское агентство по лекарственным средствам.