Противовирусные для грудничков до года: ОРВИ: искусство профилактики для самых маленьких
препараты для новорожденных и грудных детей
Новорожденные и грудные малыши перед вирусами практически беззащитны. Иммунитет «обучается» с возрастом, с каждой новой болезнью естественная защита организма человека учится идентифицировать и уничтожать болезнетворных «захватчиков». У только что появившихся на свет крох собственный иммунитет еще мало что знает и умеет, он не встречался с вирусами, если, конечно, мама не перенесла вирусную инфекцию во время беременности.
В первый месяц после появления на свет ребенка частично оберегает остаточный мамин иммунитет.
Родители часто интересуются, можно ли применять противовирусные средства для детей до года. Давайте вместе попробуем это выяснить.
Также предлагаем посмотреть видео-выпуско доктора Комаровского о детских противовирусных средствах.
Лекарства от вирусов
Фармацевтический рынок на сегодняшний день предлагает огромное количество наименований препаратов антивирусного действия, но далеко не все они разрешены к применению для новорожденных и грудных детей. Выбор велик, но это иллюзия. На самом деле, выбор для родителей малыша ограничен несколькими лекарственными наименованиями.
Выбор велик, но это иллюзия. На самом деле, выбор для родителей малыша ограничен несколькими лекарственными наименованиями.По способу воздействия все лекарства этой группы условно делятся на несколько видов:
- Интерфероны. Препараты, содержащие приготовленный искусственным способом в лаборатории белок-интерферон, который при болезни вырабатывается в организме человека самостоятельно в качестве необходимого вещества для правильной и быстрой работы антител.
- Иммуностимуляторы. Эти лекарства действуют на иммунную систему ребенку, заставляя ее быстрее дать адекватный ответ на проникновение вируса.
- Препараты прямого антивирусного действия. Такие средства содержат вещества, которые препятствуют репликации вируса и его дальнейшему распространению.

- Гомеопатические препараты. В их составе нет активных действующих веществ, зато есть большое количество разведенных до ничтожно малых величин доз различных препаратов, включая молекулы, сходные по структуре с самим вирусом.
У каждого лекарства есть свои плюсы и минусы. О плюсах родителям ежедневно рассказывает реклама, ведь препараты этой группы широко разрекламированы в средствах массовой информации. Я же хочу рассказать родителям о минусах, об этом производители не сообщат.
- Интерфероны способны вызывать множество побочных действий.
- Иммуностимуляторы и иммуномодуляторы при частом употреблении вызывают иммунодефицит, когда собственная природная защитная система ребенка начинает давать сбой, «ленится».
 Получается, что малыша исправно лечат дорогими хорошими средствами, а он болеет все чаще и чаще.
Получается, что малыша исправно лечат дорогими хорошими средствами, а он болеет все чаще и чаще. - Лекарства, которые действуют напрямую на вирусы, в равной мере действуют на все остальные системы и органы. Как вы понимаете, это воздействие не является мягким.
Вообще, с доказательной базой у противовирусных препаратов немало проблем. Лабораторно удалось подтвердить лишь действенность некоторых средств, в основном относящихся к лекарствам с прямым антивирусным действием. 99% остальных лекарств существуют и своим существованием вызывают массу вопросов. Многие врачи склонны полагать, что они совершенно бесполезны. Производители считают иначе, потому что им известные торговые марки приносят каждый простудный сезон триллионы прибыли.
Многие врачи склонны полагать, что они совершенно бесполезны. Производители считают иначе, потому что им известные торговые марки приносят каждый простудный сезон триллионы прибыли.
Надо ли давать?
Противовирусные средства, по сложившейся в педиатрии практике, назначают для двух целей. Это профилактика гриппа и ОРВИ и, непосредственно, лечение вирусных инфекций, к которым помимо гриппа относятся ветрянка, корь, скарлатина, герпес, энтеровирусная инфекция вместе с ротавирусом, и многие другие.Специалисты настоятельно не рекомендуют часто и бесконтрольно принимать средства против вирусов. Особенно это предупреждение актуально для новорожденных и грудных малышей.
Помните о том, что их иммунитету еще предстоит основное становление, ему нужно узнать вирусы «в лицо», чтобы потом при заражении быстро распознавать и уничтожать их.
Судите сами, производители препаратов заявляют о том, что их лекарство «эффективно снимает симптомы гриппа и ОРВИ за 5 дней». В обмане их не уличишь, но и правоту таких утверждений доказать, увы, невозможно.
Ведь иммунитет соматически здорового человека и самостоятельно, без таблеток, справляется с вирусами примерно за этот же промежуток времени.
В некоторых случаях антивирусные лекарства ребенку все-таки рекомендованы. В первую очередь это касается детей с врожденным иммунодефицитом (ВИЧ), недоношенных детей, чей иммунитет очень слаб.
В любом случае решение о приеме противовирусного препарата должен принимать врач.
Итак, что же может быть назначено ребенку от 0 до 12 месяцев?
Список препаратов 0+
Анаферон детский
 Поскольку наши крохи до года рассасывать пилюли не могут, им «Анаферон» рекомендуется разводить в небольшом количестве охлажденной кипяченой воды. Доза для деток от 1 месяца до года — не более одной таблетки в сутки для профилактики гриппа.
Поскольку наши крохи до года рассасывать пилюли не могут, им «Анаферон» рекомендуется разводить в небольшом количестве охлажденной кипяченой воды. Доза для деток от 1 месяца до года — не более одной таблетки в сутки для профилактики гриппа.Если малыш уже заболел, то в первые пару часов после появления симптомов ОРВИ дают по таблетке каждые полчаса, а затем по таблетке трижды в день. Будьте аккуратны, в составе пилюль — сахар. Если малыш склонен к диатезу, сообщите об этом факте врачу, возможно, он подберет для вашего чада другой препарат.
Афлубин
Гомеопатический препарат, который выпускается в таблетках «под язык» и в виде капель. Логично, что для ребенка в возрасте до года мы выберем капли, поскольку подъязычной пилюлей кроха может подавиться. Дозировка — по 1 капле в день.
Если все-таки вы купили препарат в таблетированной форме, разведите на 1 прием одну четвертую часть таблетки. «Афлубин» рекомендуется для профилактики гриппа, если в семье есть кто-то заболевший, а также для лечения уже начавшейся инфекции.
«Афлубин» рекомендуется для профилактики гриппа, если в семье есть кто-то заболевший, а также для лечения уже начавшейся инфекции.
Виферон
Это препарат, который относится с группе содержащих интерферон. Выпускается он в виде ректальных свечей, это довольно удобная форма для новорожденных и грудничков. Дозировка в первый год жизни не должна превышать трех суппозиториев в сутки. Чаще всего врачи рекомендуют по 1 свече вводить ребенку в прямую кишку трижды в день.
Это уже не гомеопатическое средство, а потому перечень побочных явлений у лекарства довольно внушителен: развитие тяжелой системной аллергии, появление местного аллергического зуда, вероятность аутоиммунных заболеваний и т.д.
Интерферон
Как следует из названия, это лекарство, которое содержит интерферон. Вариантов форм выпуска у него великое множество, но для деток до года препарат применяется исключительно в виде назальных капель. Способов употребления два — закапывать по 1 капельке в ноздри 5-6 раз в сутки или вводить в носик небольшие ватные жгутики, смоченные в растворе «Интерферона».
Среди указанных возможных негативных последствий от приема препарата — лихорадка, сонливость, тошнота, расстройство стула малыша, тяжелая аллергия, кожный зуд и т.д.
Иммунофлазид
Это сироп, в составе которого содержатся только натуральные растительные компоненты. Малышам до года дают по 0,5 мл два раза в сутки во время болезни. Принимать такой сироп можно 10-14 дней.
Будьте осторожны, если кроха склонен к пищевой аллергии, ведь сироп довольно сладкий. Для малышей есть смысл разводить его небольшим количеством воды.
Оксолиновая мазь
Это легендарное лекарство, которые использовали еще наши бабушки, актуально и сегодня. В основном его применяют для профилактики гриппа и ОРВИ. Малышам достаточно трижды в сутки смазывать носовые ходы в периоды массовой заболеваемости.
В основном его применяют для профилактики гриппа и ОРВИ. Малышам достаточно трижды в сутки смазывать носовые ходы в периоды массовой заболеваемости.
Если есть необходимость отправиться с ребенком в поликлинику на прием или в магазин, обязательно проделайте процедуру перед выходом из дома и сразу после возвращения.
Общие рекомендации
- Не стоит одновременно давать крохе жаропонижающее и противовирусное. Эти препараты по принципу действия противоречат друг другу.
- Не стоит давать ребенку антивирусные лекарства чаще двух раз в год, это может стать причиной возникновения проблем с иммунитетом.
Доктор Комаровский рассказал, как уберечь годовалого ребенка от ОРВИ
2020-02-26T08:03
2020-02-25T18:38
https://cdn2. img.crimea.ria.ru/images//society/20200226/1117987059/Doktor-Komarovskiy-rasskazal-kak-uberech-godovalogo-rebenka-ot-ORVI.html
img.crimea.ria.ru/images//society/20200226/1117987059/Doktor-Komarovskiy-rasskazal-kak-uberech-godovalogo-rebenka-ot-ORVI.html
https://cdn2.img.crimea.ria.ru/images/110892/35/1108923519.jpg
РИА Новости Крым
https://crimea.ria.ru/i/ria_logo-blue.png
РИА Новости Крым
СИМФЕРОПОЛЬ, 26 фев – РИА Новости Крым. Самым надежным способом защиты годовалых младенцев от риска подхватить грипп и ОРВИ является антивирусная прививка родителей и членов семьи, заявил кандидат медицинских наук, врач-педиатр Евгений Комаровский. Об этом он написал в Instagram.
По его словам, грипп и ОРВИ представляют серьезную опасность для младенцев, поэтому родителям нужно заранее побеспокоиться о мерах профилактики – собственных прививках и ограничении ребенка от излишних контактов.
“Самый надежный способ защиты от гриппа – привить взрослых, тех, кто может этот вирус в дом принести. Речь идет о родителях, о няне, о старшем брате и так далее”, – написал доктор. – Другие варианты защиты от вирусов представляют собой прогулки вне мест скопления людей, да и вообще ограничение контактов с людьми”.
Также Комаровский порекомендовал регулярно проветривать дом, поддерживая в нем режим чистого влажного воздуха. А при вынужденной необходимости предпочесть всевозможным пилюлям обыкновенные солевые капли в нос.
Помогут ли противовирусные препараты от гриппа и ОРВИ >>
“Опасным заблуждением многих родителей является убежденность в том, что существуют некие волшебные таблетки, способные защитить ребенка от гриппа и ОРВИ. К огромному сожалению, средств с доказанной профилактической эффективностью не существует”, – заключил педиатр.
Ранее доктор Комаровский заявил, что китайский коронавирус в девять раз слабее кори, а опасность его распространения преувеличена.
Простуда у ребёнка: как лечить ее правильно
Многие родители готовы к тому, что малыши будут подхватывать распространенные, в том числе сезонные инфекции, что характерно именно для детского возраста. Некоторые родители заранее изучают методы лечения ОРВИ и простуд, читают об этом у опытных мамочек в блогах и дневниках, советуются со знакомыми врачами, смотрят медицинские программы. Но даже, несмотря на то, что организм ребенка с рождения обладает мощной иммунной системой, защита эта несовершенна. Поэтому как бы мама не была информирована, когда ребенок заболевает, у нее возникает масса вопросов, на которые требуются квалифицированные ответы.Что такое ОРЗ и ОРВИ
Чаще всего дети сталкиваются с острыми респираторными заболеваниями, именуемыми сокращенно ОРЗ или простудами. Особенно это проявляется при посещении детских коллективов, где они контактируют с другими малышами, и фактически обмениваются различными возбудителями.
 Мамам «детсадовских» ребятишек очень хорошо знакома фраза: «2 дня ходим, потом 2 недели – на больничном».
Мамам «детсадовских» ребятишек очень хорошо знакома фраза: «2 дня ходим, потом 2 недели – на больничном». Простуда бывает как вирусной, так и бактериальной, даже грибковой и другой природы, в 70-80% случаях носит именно вирусный характер. Установить на педиатрическом осмотре происхождение простуды с точностью невозможно, как и «на глазок» отличить одну инфекцию от другой. Однако есть определенные признаки, указывающие на действие вирусов, вредных бактерий и прочих возбудителей. Например, слизистые носовые выделения свидетельствуют в пользу острой респираторной вирусной инфекции, которая обычно начинается с легкого недомогания, снижения аппетита, капризности, нарушения сна у ребенка. Это продромальный период, он длится от нескольких часов до 1-2 дней. А такая вирусная инфекция как грипп начинается остро, сразу с очень высокой температуры, интоксикации, продромального периода почти нет, сухой кашель появляется в поздние сроки болезни. Часто ОРВИ проходит с катаральными симптомами: заложенность носа, изменение оттенка голоса, «круги», «синева» под глазами, насморк, отделяемое из носа, кашель, боли в горле и при глотании.

Что делать?
В первую очередь нужно запомнить, что родителям не стоит паниковать, если у ребенка поднялась температура и возникли прочие неприятные симптомы простуды. Любое настроение матери передается малышу. Простуда при грамотном подходе просто ОБЯЗАНА пройти за 5-7 дней без осложнений. И важно знать, что лечение простуды является комплексным, куда входят основные препараты – противовирусные, антибактериальные и пр., а также средства симптоматической терапии. Не стоит надеяться только на одно какое-то лекарство, как на панацею, волшебную пилюлю из рекламы или совета работника аптеки.
Как лечить?
Противовирусные препараты. Сейчас встречается много недостоверной информации в отношении противовирусных препаратов. Им приписывают мифические побочные эффекты и действия. Если такое исходит от врача, то он должен предоставить подтверждающие его точку зрения данные в официальных источниках, которыми являются государственные медицинские учреждения, крупные научные журналы.
Антибиотики. Что касается антибиотиков, то в настоящее время их применение ограничено очень четкими показаниями, противопоказаниями, возрастом больного и т.д. Кроме того, антибиотики, особенно при бесконтрольном, частом применении, способствуют образованию новых, трудно поддающихся лечению штаммов вредных бактерий. Обычно на фоне лечения антибиотиками принято назначать биопрепараты – живые микробы, составляющие кишечной микрофлоры человека. Но существует мнение, что антибиотик губительно действует и на эти бактерии и такая терапия не приносит желаемого результата.
Вспомогательные средства. В лечении простуды любого происхождения используются средства симптоматической терапии, действие которых направлено против симптомов болезни. Они называются вспомогательными, так как именно помогают облегчить течение простуды. Они не избавляют от причины ОРВИ, а против вирусов работают собственные антитела ребенка.
Чем лечить насморк? При насморке проводят туалет носа с солевыми растворами. Процедура простая, но требует определенных навыков и осторожности. Для этого следует усадить ребенка к себе спиной, предварительно очистить ему нос. У малышей это можно сделать при помощи ватных палочек (у детей до полугода только обычными ватными турундочками), а в старшем возрасте дети уже могут сами высмаркиваться. После этого нужно приподнять подбородок, удерживая лицо ребенка своей ладонью в приподнятом состоянии. С помощью пипетки закапать в оба носовые хода солевой раствор, опустить голову ребенка вперед. Из носа может вылиться часть лекарства, но результат такой процедуры все равно будет достигнут. Если особых рекомендаций педиатра заболевшего ребенка нет, можно пользоваться пипеткой и обычным физиологическим раствором. Но предпочтительнее стерильным раствором на основе морской воды. Заблуждение думать, что промывание носа ребенка вызовет привыкание или сопли сами вытекут. Часть, конечно, может вытечь наружу, но если не очищать нос, высок риск распространения инфекции в ниже лежащие дыхательные пути, развития таких осложнений, как воспаление трахеи, бронхов, легких.
Процедура простая, но требует определенных навыков и осторожности. Для этого следует усадить ребенка к себе спиной, предварительно очистить ему нос. У малышей это можно сделать при помощи ватных палочек (у детей до полугода только обычными ватными турундочками), а в старшем возрасте дети уже могут сами высмаркиваться. После этого нужно приподнять подбородок, удерживая лицо ребенка своей ладонью в приподнятом состоянии. С помощью пипетки закапать в оба носовые хода солевой раствор, опустить голову ребенка вперед. Из носа может вылиться часть лекарства, но результат такой процедуры все равно будет достигнут. Если особых рекомендаций педиатра заболевшего ребенка нет, можно пользоваться пипеткой и обычным физиологическим раствором. Но предпочтительнее стерильным раствором на основе морской воды. Заблуждение думать, что промывание носа ребенка вызовет привыкание или сопли сами вытекут. Часть, конечно, может вытечь наружу, но если не очищать нос, высок риск распространения инфекции в ниже лежащие дыхательные пути, развития таких осложнений, как воспаление трахеи, бронхов, легких.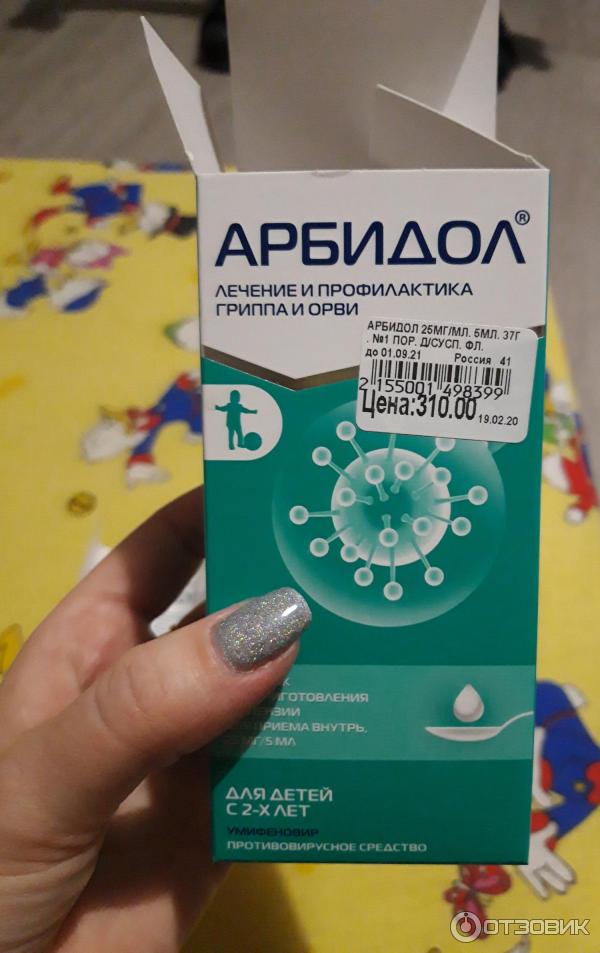
Если насморк обильный, водянистый, мучительный, сопровождается заложенностью носа, применяют сосудосуживающие препараты (на основе оксиметазолина, ксилометазолина) в виде капель перед сном, перед прогулкой с ребенком. Это помогает малышу хорошо отдохнуть во сне, не просыпаясь, а на прогулке нормально дышать носом, не захватывая ртом холодный воздух. Не следует проводить закапывания в нос ребенку в лежачем состоянии, поскольку высока вероятность изменения давления при такой манипуляции и есть риск возникновения отита. Все закапывания необходимо проводить сидя. Использование специальных препаратов в виде софта (спрей с ограниченным давлением струи) следует проводить с большой осторожностью, поскольку тоже есть риск под давлением способствовать распространению инфекции.
Жаропонижающие средства. Зачастую возникают вопросы по поводу применения жаропонижающих средств, для детей – это препараты на основе парацетамола или ибупрофена, для малышей – в сиропе, свечах. Следует отметить, что если нет особых рекомендаций на этот счет, снижать необходимо температуру выше 38,3 – 38,5°С. Если ребенок чувствует себя неплохо, играет, сохранен аппетит, и, вообще, температуру переносит хорошо, жаропонижающее препараты можно не применять. Если родители видят, что состояние ребенка плохое, он отказывается от еды и питья, становится вялым, возникает рвота, головная боль, температура повышается дальше, можно начать давать жаропонижающие и при невысокой температуре.
Следует отметить, что если нет особых рекомендаций на этот счет, снижать необходимо температуру выше 38,3 – 38,5°С. Если ребенок чувствует себя неплохо, играет, сохранен аппетит, и, вообще, температуру переносит хорошо, жаропонижающее препараты можно не применять. Если родители видят, что состояние ребенка плохое, он отказывается от еды и питья, становится вялым, возникает рвота, головная боль, температура повышается дальше, можно начать давать жаропонижающие и при невысокой температуре.
Как лечить кашель? Вопросы про кашель являются самыми частыми и порой самыми сложными на педиатрическом приеме по поводу ОРВИ. Лучше всего, если врач динамически наблюдает кашляющего ребенка. При этом специалист может отличить изменения оттенка голоса, лающий компонент, сухой или влажный кашель, хрипы, локализацию хрипов. Если педиатр рекомендует сделать рентгеновский снимок, не следует отказываться от такого обследования, это поможет поставить правильный диагноз и назначить адекватное лечение. В настоящее время при лечении кашля широко применяются ингаляционные препараты – через специальный прибор – ингалятор. Такая тактика снижает системное воздействие лекарства на организм ребенка, где препарат достигает точки своего приложения – крупных и средних бронхов, и даже альвеол. Ингаляторы можно использовать с самого рождения ребенка, но необходимо обратить внимание на тип прибора, рекомендованные для него лекарственные вещества, их дозировки и кратность применения.
В настоящее время при лечении кашля широко применяются ингаляционные препараты – через специальный прибор – ингалятор. Такая тактика снижает системное воздействие лекарства на организм ребенка, где препарат достигает точки своего приложения – крупных и средних бронхов, и даже альвеол. Ингаляторы можно использовать с самого рождения ребенка, но необходимо обратить внимание на тип прибора, рекомендованные для него лекарственные вещества, их дозировки и кратность применения.
Действия до прихода врача
Иногда, особенно в сезон высокой заболеваемости гриппом и простудой, возникают затруднения с визитом врача, приходится ждать приема, врач не успевает прийти так быстро, как хотелось бы родителям. Есть такие меры, которые можно предпринять до прихода специалиста. Нужно померить температуру ребенку и данные о проведенной термометрии записать в дневничок, который затем показать доктору. Если температура высокая, не следует кутать или даже тепло одевать ребенка. Дома вообще можно раздеть до нижнего белья. Одноразовый подгузник с младенцев тоже рекомендовано снять. Не стоит забывать про физические методы охлаждения – можно обтирать прохладной водой, на голову, живот, места магистральных сосудов можно положить смоченную водой ткань. Следует обильно дробно поить заболевшего ребенка, даже если отказывается пить, необходимо постоянно предлагать из чайной ложечки, смачивать губы.
Дома вообще можно раздеть до нижнего белья. Одноразовый подгузник с младенцев тоже рекомендовано снять. Не стоит забывать про физические методы охлаждения – можно обтирать прохладной водой, на голову, живот, места магистральных сосудов можно положить смоченную водой ткань. Следует обильно дробно поить заболевшего ребенка, даже если отказывается пить, необходимо постоянно предлагать из чайной ложечки, смачивать губы.
Не бывает ребятишек, которые не болеют. Болеют все, только одни часто, а другие не очень. Главное помнить, что любые лекарственные средства должны назначаться врачом на очном приеме, после осмотра.
Не лечите ОРВИ. Почему противовирусные препараты и антибиотики неэффективны | Здоровье ребенка | Здоровье
Каждую осень и зиму наши дети простужаются – кашляют, шмыгают носами. А эффективных лекарств от вирусных инфекций наука так и не придумала. Да и нужны ли они?
Лекарств не назначил
Многие ли родители, вызвавшие врача к своему затемпературившему и кашляющему ребёнку, готовы принять такую ситуацию: педиатр осмотрел маленького пациента и… никаких лекарств не назначил? Но, если это ваш случай, знайте: вам повезло с доктором.
В 2018 г. утверждены новые клинические рекомендации по лечению ОРВИ, разработанные Союзом педиатров России. Большая часть их посвящена тому, что НЕ надо делать при простудных заболеваниях. Главное – не надо лечить, как это ни парадоксально.
«ОРВИ – наиболее частая причина применения различных лекарственных средств и процедур, чаще всего ненужных, с недоказанным действием, нередко вызывающих побочные эффекты. Поэтому очень важно разъяснить родителям доброкачественный характер болезни и сообщить, какова предполагаемая длительность имеющихся симптомов, а также убедить их в достаточности минимальных вмешательств», – сообщается в документе.
Разъяснить, почему при простуде не надо давать ребёнку привычные лекарства, «АиФ» попросил профессора Национального медицинского исследовательского центра здоровья детей, эксперта Всемирной организации здравоохранения Владимира Таточенко.
Фото: АиФ6 раз в год – нормально
– Прежде всего простуд не нужно бояться. Примите как данность: дети должны болеть и зарабатывать иммунитет. Нормально, если ребёнок заболевает ОРВИ до 6 раз в год. Не зря есть такая шутка: до свадьбы заживёт. К взрослому возрасту человек переболевает многими инфекциями и вырабатывает иммунитет.
Примите как данность: дети должны болеть и зарабатывать иммунитет. Нормально, если ребёнок заболевает ОРВИ до 6 раз в год. Не зря есть такая шутка: до свадьбы заживёт. К взрослому возрасту человек переболевает многими инфекциями и вырабатывает иммунитет.
Большинство основную массу инфекций даже не замечает – на день-два снизилось самочувствие, и всё прошло. Ну, ещё 2–3 раза в год сляжет с температурой. Мы живём и растём вместе с вирусами, здоровые малыши их нормально переносят. Они могут быть опасны для детей с хроническими заболеваниями, например, бронхиальной астмой. Если ребёнка изолировать, чтобы не простужался – не имел вирусных инфекций, его иммунная система будет склоняться в сторону аллергии.
Очень часто простудные заболевания вызывают риновирусы – они размножаются в слизистой оболочке носоглотки и дают лихорадку, насморк, кашель. Иногда ОРВИ у детей вызывает вирус Эпштейна – Барр. Маленькие болеют довольно выраженно (резко, иногда длительно повышается температура, сильно болят горло, голова, увеличиваются лимфоузлы), но выздоравливают и никаких осложнений не получают.
Аденовирусная инфекция даёт примерно 5% ОРВИ. Для неё типичны ангина и конъюнктивит – резь, зуд, слезотечение на фоне высокой лихорадки в течение 5–7 дней. Практически нет средств, чтобы облегчить состояние. Жаропонижающие помогут снизить температуру, но длительность лихорадки не сократят. Аденовирусная инфекция почти всегда заканчивается благополучно, а к взрослому возрасту обычно к этим вирусам вырабатывается иммунитет.
Не так давно были открыты новые возбудители – бокавирус (до 20% ОРЗ у детей), метапневмовирус и др. Но пугаться и их не стоит, от них не умирают. Бояться надо только гриппа. Это единственный смертельный вирус среди ОРВИ. Поэтому надо прививаться.
Не цепляйтесь за интерфероны
А теперь главное – никаких противовирусных лекарств нет! Есть противогриппозные, которые нужно принимать в первые 48 часов от начала симптомов заболевания. Позже – бесполезно. Большинство разрекламированных и не очень средств значимого эффекта не дают.
Любимые многими иммуномодуляторы никто в мире, кроме нас и итальянцев, не применяет. Доказано, что интерфероногены у детей старше 7 лет могут сократить период лихорадки меньше чем на 1 день. Нужно травить ребёнка из-за этого? Всевозможные «фероны» нигде в мире не применяются и даже не признаны гомеопатическими средствами. Серьёзные иммунотропные и противовирусные препараты используют при вирусных гепатитах, онкологии после курса химиотерапии и ВИЧ-инфекции.
Отхаркивающие средства тоже принимать не стоит, за исключением редких случаев. Дети сами кашляют, стимулировать таблетками их не надо. Если болит горло, то для облегчения состояния можно использовать спреи, сосательные леденцы, таблетки и пастилки с антисептиком. Это не вредно. Ребёнка с больным горлом старше 4 лет желательно показать врачу, чтобы исключить стрептококковую инфекцию. Если она обнаружится, обязательно нужны антибиотики.
Капли в нос стоит применять, если он сильно заложен и ребёнку тяжело дышать, но не 3–4 раза в день, а по необходимости – скажем, на ночь, чтобы уснул. Не дольше 1–3 дней. А лучше промывать нос физраствором. Действие такое же. Гигиена носа поможет и от кашля: при ОРВИ он чаще вызван раздражением гортани стекающим в неё секретом.
Не дольше 1–3 дней. А лучше промывать нос физраствором. Действие такое же. Гигиена носа поможет и от кашля: при ОРВИ он чаще вызван раздражением гортани стекающим в неё секретом.
Если ребёнок плохо переносит высокую температуру, сильно мучается, можно использовать жаропонижающие – парацетамол и ибупрофен. Но не стремитесь сбить её до 36,6. Упала до 38 – хорошо. А если ребёнок может терпеть – не надо и таких лекарств. Сбивая температуру, вы «отключаете» иммунную защиту, и он будет заболевать от одного и того же вируса несколько раз. От лихорадки никто ещё не умер. Температура не поднимется выше, чем нужно. Даже судорог не стоит пугаться. Взрослые дрожат при температуре, а у детей начинаются судороги. Если они длятся разово до 15 минут, не страшно.
Что остаётся? Обычные домашние средства – чай с малиной, молоко с мёдом, капелькой соды или минералкой, компоты и морсы. С жидкостью выводятся токсины – продукты жизнедеятельности вредных бактерий и вирусов. К тому же высокая температура приводит к обезвоживанию, и организму требуется влага. Обильное питьё способствует также разжижению мокроты, слизи и облегчает их отхождение. Если ребёнок не может пить, если у него начинается рвота, давайте воду понемногу – по чайной ложечке, но часто.
ОРВИ при отсутствии бактериальных осложнений проходят через несколько дней, хотя и могут оставлять на 1–2 недели такие симптомы, как насморк и кашель.
Профилактика
Хотя болеть ОРВИ ребёнку нужно, это не значит, что надо пренебрегать мерами профилактики. Они просты.
Больше гулять. На улице сложнее заразиться, чем в замкнутом помещении. Ведь почему мы чаще заболеваем в холодное время года? Не от холода, а оттого, что больше находимся в закрытых, плохо проветриваемых помещениях, где много людей, а воздух сухой. Когда слизистая носоглотки пересыхает, сопротивляемость болезням снижается.
Не кутать детей. Представление о том, что надо потеплее одеваться, чтобы не простудиться, – миф. Чем больше вы будете кутать ребёнка, тем чаще он будет болеть. Должна быть естественная стимуляция организма. На ребёнка нужно надевать на один слой одежды меньше, чем на взрослого. Ведь дети на улице всё время двигаются. В дождь, сырую погоду лучше обувать его в резиновые сапоги. Конечно, если ребёнок жалуется, что ему холодно, оденьте его теплее.
Поддерживать дома влажность и оптимальную температуру. В квартире днём – +21…22°, ночью – +17…18°. Полезно даже приучить ребёнка спать при открытой форточке и не кутать его в пуховые одеяла. При температуре выше +23…25° воздух становится сухим. Поэтому регулярно проветривайте комнаты.
Чаще мыть руки. Причём не только после туалета. Каждый человек сотни раз за день залезает руками в нос, рот, глаза. Если на пальцах есть вирус, он попадёт в организм. Не позволяйте ребёнку хвататься лишний раз за ручки дверей в общественных местах – там скапливается огромное количество микробов.
Поменьше бывать на массовых сборищах. Например, в кино. Пока ребёнок ходит в свою группу в детском саду или свой класс в школе, он практически не болеет, потому что привыкает к тем микробам, которые циркулируют в коллективе. Когда коллективы смешиваются, дети начинают заражаться.
Не отказываться от прививок. Доказано, что вакцинация детей от гриппа и пневмококковой инфекции снижает риск развития острого среднего отита, то есть уменьшает вероятность осложнённого течения ОРВИ.
Когда нужно вызывать скорую и ехать в больницу?
- Высокая температура у ребёнка дольше 10 дней.
- Ребёнок не может пить (сосать грудь).
- Сонливость, частота дыхания менее 30 вдохов в минуту.
- Постоянная рвота.
- Сыпь на коже при высокой температуре.
- Изменения дыхания: ребёнок кряхтит, раздуваются крылья носа, дышит очень часто, кивает головой одновременно со вдохом, нижняя часть грудной клетки заметно втягивается при дыхании.
Президент Союза педиатров России Л.С. Намазова-Баранова о новой коронавирусной инфекции у детей (по итогам 2020 года)
Президент Союза педиатров России Л.С. Намазова-Баранова о новой коронавирусной инфекции у детей (по итогам 2020 года)
11 января 2021
Когда Землю накрывает шторм, или Мысли вслух об итогах 2020 года
Вспоминаю себя ровно год назад. Позади прекрасное празднование самого любимого семейного праздника, встреченного в активном горнолыжном времяпрепровождении. Впереди — широкие научные и медицинские перспективы года с таким прекрасным номером — 2020, что кажется, он просто обязан подарить миру новый виток развития и очень много прекрасных экономических, культурных, спортивных и прочих событий. Но, как говорится, человек предполагает, а Бог располагает… И вот уже через пару недель меня настигает странная болезнь (с высокой лихорадкой и полной потерей обоняния и вкуса на несколько суток), название которой еще не прописалось в нашем сознании. Еще через неделю я — в строю, но странное чувство усталости делает мышцы слабыми, а мышление — вялым и замедленным, однако повседневные хлопоты не дают возможности остановиться и восстановиться, ведь нужно провести наш традиционный февральский конгресс педиатров, и десятки тысяч детских врачей страны достойны того, чтобы мероприятие, как всегда, прошло на самом высоком уровне, стало прекрасной образовательной и дискуссионной площадкой и оставило глубокое «послевкусие» от услышанного и увиденного. Конгресс отпечатался в памяти теплыми словами, с которыми обратились к собравшимся два вновь назначенных федеральных министра (науки и образования — В.Н. Фальков и здравоохранения — М.А. Мурашко), Круглыми столами, организованными Счетной палатой, а также академиями образования (РАО) и наук (РАН), и необыкновенно высоким числом очных (9000) и онлайн-участников (более 73,5 тысяч индивидуальных и групповых просмотров). И казалось, что позитивный заряд, полученный детскими врачами России на конгрессе, непременно укажет правильный вектор и обеспечит заряд бодрости для нелегкой работы педиатров и педиатрических медицинских сестер в течение всего года.
Наступает март, и жизнь переворачивается, потому что две истины становятся очевидными: я переболела новой коронавирусной инфекцией, причем отделалась лишь «легким испугом», и мир уже никогда не будет таким, как прежде…
Прошел год. И с высоты наступившего 2021-го хочется переосмыслить пережитое и ответить на главный вопрос: что, собственно, принес нам предыдущий високосный, который мы проводили с такой радостью? Какое переосмысление произошло или перезагрузка каких представлений состоялась? И главное: чего нам ждать впереди?
Не знаю, как для кого, а для меня синонимом ушедшего года может стать слово «ШТОРМ». Мне кажется, до этого мы никогда так часто его не употребляли в обычной речи, если наша профессия не связана с выходом в море, конечно. И чтобы объяснить свою позицию, постараюсь последовательно изложить то, что на сегодняшний день с научной точки зрения нам известно о захлестнувших Землю в минувший год:
– ЦИТОКИНОВОМ ШТОРМЕ;
– МОЗГОВОМ ШТОРМЕ;
– СОЦИАЛЬНОМ ШТОРМЕ;
– ДИГИТАЛЬНОМ ШТОРМЕ;
– СУИЦИДАЛЬНОМ ШТОРМЕ.
А вы помните, как все начиналось? В январе 2020 г. стали появляться сообщения, что в одной из провинций КНР началась вспышка новой инфекции, вызванной коронавирусом. И казалось, ну подумаешь, там же все время какие-то вспышки. В 2004-ом в Китае тоже была вспышка коронавируса, и хоть летальность составила 10–12%, она быстро сошла на нет, даже вакцину не успели создать, не понадобилось… Да и вообще, педиатры прекрасно знают семейство коронавирусов, в течение каждого осенне-зимнего сезона обязательно бывает несколько детей с этим диагнозом. Научные публикации на тему коронавирусов можно найти еще с 60-х гг. ХХ века (кстати, описывают они чаще лиц мужского пола, перенесших эту инфекцию).
Но дни шли за днями, недели за неделями, в эфире все чаще показывали масштабные меры, принимаемые правительством КНР для сдерживания распространения инфекции, и к концу января стало ясно: что-то идет не так, и нам тоже нужно в эту историю вникать, ведь недаром у нас огромная общая граница и тесные социально-научно-культурные связи с китайцами. Обратившись за информацией к китайским коллегам, с которыми вместе после посещения их крупнейших детских госпиталей в конце декабря 2019-го строили общие научные и практические планы для улучшения оказания помощи педиатрическим пациентам, мы получили неожиданные данные о том, что среди заболевших новой коронавирусной инфекцией (тогда она еще называлась 2019-nCoV) детей практически нет! Так, по сведениям от иностранного члена РАН китайского профессора-пульмонолога К. Шен, с момента начала эпидемии нового коронавируса в КНР и по состоянию на 30.01.2020 в 31 провинции страны заболело 15 238 человек, диагноз подтвержден у 9692 пациентов (в том числе у 1527 больных заболевание протекало тяжело, 213 умерло). При этом среди детей от рождения до 17 лет включительно было зарегистрировано всего 28 (!) легких случаев новой инфекции, причем никто из детей не умер (World J Pediatrics, 07.02.2020). Безусловно, эпидемия в Китае поразила значительно большее число людей, и процент детей от всех заболевших стал потом выше, но эти первые данные были важны с точки зрения соотношения заболевшие / подтвержденные диагнозы / тяжелое течение / смертельные исходы и, конечно, взрослые/дети.
Именно тогда, собрав по крупицам сведения от коллег из разных регионов мира, также подтверждавшие практически отсутствие среди тяжело болевших, а тем более умерших пациентов детского возраста, мы написали первый обзор и разместили на сайте Союза педиатров России, во всех наших социальных сетях и опубликовали в журнале «Педиатрическая фармакология». Неизвестность иногда страшнее действительности, и нам было очень важно поддержать и наших коллег, и родителей их пациентов, объясняя, что за странная болезнь поразила наших соседей. Ведь при любой вспышке нового гриппа, мутации которого также регулярно случаются именно в этом регионе земного шара, страдают в первую очередь дети (и одновременно старики, потому что у первых иммунитет еще не завершил свое формирование, а у вторых уже вошел в стадию детренированности). В наших первых публикациях подчеркивались два тезиса: дети составляют очень незначительную часть заболевших, смертельных исходов среди них не регистрируется; заболевшие имеют легкие симптомы, чаще являются бессимптомными носителями (поэтому не нужно паниковать!). Однако именно дети должны быть в фокусе особого внимания, так как они могут играть роль в распространении болезни и иметь отсроченные последствия для здоровья, вызванные перенесенной бессимптомно инфекцией. А еще с этого момента и по сей день меня не оставляет мысль о каком-то тайном послании человечеству в виде новой коронавирусной инфекции, ведь малое поражение детей стало лишь первой из череды «странностей» нового вируса.
Уже в феврале-марте начали все чаще появляться сообщения о том, что стремительно растущее число летальных исходов от новой инфекции, шагнувшей из Китая в Европу и другие регионы мира, обусловлено так называемым цитокиновым штормом — массивной продукцией цитокинов и их разрушающим макроорганизм хозяина действием. Так мы узнали о первом шторме, а словосочетание «ЦИТОКИНОВЫЙ ШТОРМ» стало повседневным оборотом в речи людей, даже весьма далеких от медицины…
Выявление феномена цитокинового шторма подсказало терапевтическую стратегию, спасшую жизни сотням тысяч тяжело болеющих пациентов, но не ответило на новые вопросы. Цитокиновый шторм возникает в острый период всех известных инфекционных и неинфекционных болезней, например при инфаркте или инсульте, при ревматических болезнях, аллергических реакциях, — ведь это универсальный ответ организма на начинающееся иммунное воспаление. Могут разниться его выраженность, продолжительность, масштаб. При инфаркте, например, этот шторм даже более выражен, как и при многих других болезнях, но ведь он не требует применения антицитокиновых препаратов и не вызывает такой масштабной летальности. А при ревматических болезнях цитокиновый шторм более продолжителен, однако схемы ведения пациентов совершенно иные, чем при новой коронавирусной инфекции. И это осознание стало следующей «странностью» нового вируса.
Кстати, SARS-CoV-2 (новый коронавирус с февраля 2020 г. имеет именно это официальное название) весьма избирателен в поражении. Помимо людей более старших возрастов, он чаще поражает мужчин, чем женщин, чаще толстых, чем худых, чаще имеющих диабет и проблемы с повышенным свертыванием крови, чем не имеющих, а по анализу данных из США — людей из латиноамериканской и афроамериканской диаспоры, коренного индейского населения и коренных жителей Аляски. Есть ряд работ, связывающих гендерные различия в поражении и бо́льший риск тяжелого течения и летального исхода с женской Х-хромосомой (как известно, у мужчин она одна, поэтому и защита хуже). Межрасовые и межэтнические различия пока не нашли своего однозначного объяснения. И это, безусловно, «странность номер 3» — избирательность поражения для разных групп людей. Все вновь появляющиеся научные данные мы обобщали в наших следующих обзорах, регулярно размещаемых на сайте СПР, опубликованных в каждом из номеров нашего журнала и положенных в основу презентаций на многочисленных вебинарах по теме «COVID-19 и дети», проведенных нашей профессиональной ассоциацией за этот год.
С марта 2020 г., когда ВОЗ официально объявила вспышку COVID-19 пандемией, ученые мира и каждой отдельно взятой страны провели не один «мозговой штурм», чтобы понять болезнь и разработать лучшие терапевтические стратегии для помощи пациентам, но каждый раз сталкивались со все новыми и новыми «странностями» вируса и неэффективностью всего, что предлагалось ранее. Так, последовательно ушли в прошлое схемы ведения пациентов с применением анти-ВИЧ/СПИД-препаратов (лопинавира/ритонавира), антималярийных средств (гидроксихлорохина/хлорохина), в том числе в комбинации с антибиотиком азитромицином, противовирусных препаратов (ремдесивира и аналогов). И вновь человечество осталось с единственной группой лекарств — старых добрых кортикостероидов, имеющих хоть и не очень высокие, но все же доказанные эффективность и безопасность. А параллельно становилось все более очевидным, что SARS-CoV-2 поражает не только и не столько легкие, сколько разные органы и системы (ничего себе респираторный вирус!) — почки, сердце, систему свертывания крови, поджелудочную и другие железы внутренней секреции, органы репродуктивной системы, а главное — мозг! И вот уже стало понятным, что невероятная усталость, которая еще долго преследует даже легко переболевших людей, это то самое нейротропное действие вируса, о котором вначале никто и не догадывался и которое, во-первых, объяснило, почему так важно использовать не только маску, но и очки или цельные экраны для защиты (по одной из теорий вирус проникает в мозг через зрительный нерв), а во-вторых, придало совсем иной смысл словосочетанию «МОЗГОВОЙ ШТОРМ»! После этого стало очевидным, что необходимо изучать данный аспект проблемы особенно активно и заниматься реабилитацией пациентов, переболевших COVID-19, причем восстановлением не только их респираторных функций, но и тех, что связанны с работой мозга. Изучив состояние здоровья московских детей, переболевших новой коронавирусной инфекций, наша исследовательская команда отметила снижение примерно на треть их когнитивных (т.е. познавательных) функций, в большей степени там, где предпосылки проблемы в виде снижения памяти, внимания и т.д. имели место еще до начала болезни. И тогда призыв заниматься диспансеризаций и реабилитацией детей после COVID-19, изложенный в отдельном согласительном документе педиатров, получил научное обоснование.
Не надо забывать, что весь год протекал под знаком весьма значительных социальных потрясений: в первые месяцы года был объявлен весьма жесткий карантин, когда дети были заперты в четырех стенах и не могли выходить на улицу в течение не одной недели, во многих семьях родители потеряли работу, а доходы семей снизились, образовательная деятельность была перенесена в онлайн-режим, закрылись границы не только между странами, но и между регионами, в летние месяцы резко сократилась возможность пребывания в лагерях летнего отдыха и т.д. и т.п., что, безусловно, можно назвать «СОЦИАЛЬНЫМ ШТОРМОМ», захлестнувшим общество. Его последствия краткосрочного порядка уже проявились, а средне- и долгосрочные нам еще только предстоит осмыслить. Из краткосрочных — это, конечно, «ДИГИТАЛЬНЫЙ, ИЛИ ЦИФРОВОЙ, ШТОРМ», в результате которого дети стали в разы больше времени проводить в виртуальном мире и новом цифровом формате, что не могло не сказаться на их здоровье в виде резкого падения зрения, невротизации, увеличения массы тела, снижения физических и адаптационных возможностей организма. Наши турецкие коллеги подсчитали, что в период пандемии достоверно увеличились число часов, проводимых детьми перед экраном компьютера или иного гаджета, а также просмотр как детских, так и взрослых (!) программ и время, проводимое в компьютерных играх, причем это стало общей тенденцией в семьях любого социодемографического статуса (Turkish Arch Ped, 18.10.2020, doi: 10.14744/TurkPediatriArs.2020.41017).
Хотя справедливости ради следует отметить, что последние два вида шторма все же могут усугублять социальное неравенство, ведь если семья не имеет возможности предоставить ребенку полноэкранный компьютер с устойчивым интернетом для школьных занятий, а может дать лишь мобильный телефон, результаты учебы явно будут страдать. Или если для телемедицинских услуг, которые, наконец, стали широко внедряться в этом году, требуется опять же интернет и гаджет, а у пациента нет ни того, ни другого, то он может остаться без медико-социальной помощи вообще. Так что исследования в эпоху COVID-19, несомненно требуют мультидисциплинарного подхода и изучения влияния нового коронавируса не просто с точки зрения экспосома (совокупности факторов окружающей среды, влияющей на регуляцию генов и индивидуальное развитие организма, в данном случае — ребенка), а, несомненно, социоэкспосома (учитывающего среди всего прочего и социальные факторы).
Это становится особенно актуальным, когда выясняется, что пандемия SARS-CoV-2 привела к резкому увеличению проблем ментального характера, частоты депрессий и числа суицидов. С одной стороны, этот «СУИЦИДАЛЬНЫЙ ШТОРМ» не является неожиданностью, ведь из литературы мы знаем, что два предыдущих «прихода» коронавируса (вспышки тяжелых инфекций, вызванных SARS-CoV в 2004 г. и MERS-CoV в 2012 г.) сопровождались увеличением на 30% числа суицидов в тех регионах, где они отмечались. И подоснова этого явления понятна — явная нейротропность вируса, описанная выше. С другой стороны, это и есть те самые среднесрочные последствия COVID-19, которые требуют серьезной углубленной диспансеризации и реабилитации всех переболевших, в том числе (или скорее — в первую очередь) детей. Именно поэтому мы с первых своих публикаций предлагаем использовать термин не «социальное дистанцирование», а «физическое», ведь социальное — это все же про другое…
Ну а теперь к последним новостям. После довольно спокойных в отношении детей первых трех месяцев пандемии апрель взорвали сообщения о тяжелой болезни, вызываемой SARS-CoV-2 у педиатрических пациентов. Первоначально новая болезнь, внешне своими проявлениями напоминавшая синдром Кавасаки, была названа KawaCoid, однако позднее ее переименовали в мультисистемный воспалительный синдром у детей. Эту ранее никогда не наблюдавшуюся педиатрами болезнь описали всего у порядка семи сотен детей американского и европейского континентов, в семьях которых кто-то из взрослых переносил COVID-19. Причем вновь дети из латиноамериканских и афроамериканских коммун, особенно страдавшие избыточной массой тела и ожирением, диабетом и болезнями свертывающей системы крови, болели чаще других. Заболевание не развивалось в момент виремии — вирусной атаки на организм, а являлось ответом иммунной системы на «побывавший ранее в теле ребенка» SARS-CoV-2. Эти случаи стали отмечаться в каждой из стран Европы или Америки примерно через два месяца от начала вспышки. С учетом того, что в России случаи COVID-19 стали регистрироваться позже, чем в Европе и Америке, мы ждали проявлений нового синдрома в конце мая — начале июня. Так и случилось, и в нашей стране также диагностировали новое заболевание у нескольких десятков детей, подавляющее большинство которых было успешно пролечено. Как было указано выше, до лета заболеваемость детей (в основном старше 10 лет) отмечалась примерно на одном и том же низком уровне — 2–5% от всех заболевших, летальность, к счастью, сохранялась практически на нуле. Однако с лета заболеваемость стала потихоньку расти. После открытия школ в июле-августе в большинстве стран Европы и Америки заболеваемость детей повысилась до 7–12%. Заболеваемость детей первых 10 лет остается, по сути, казуистической, хотя отдельные пациенты грудного или младенческого возраста, имеющие серьезные проблемы здоровья, тоже могут быть уязвимы для нового коронавируса.
Европейское бюро ВОЗ, изучив все доступные статистические и научные данные, разработало рекомендации, согласно которым школы следует закрывать лишь после того, как в стране закроют все другие «источники социальной активности» — кафе и рестораны, театры и кинотеатры, магазины и спортивные сооружения. Ведь подростки (а официально все дети после 10 лет являются подростками), да и сами учителя заражаются не в школе от других детей, а как раз посещая места большого скопления людей (в транспорте, магазинах, кафе, спортзалах и т.д.). Последние данные о новых мутациях вируса свидетельствуют о его новых «странностях» — SARS-CoV-2 становится заразнее, но клиническая картина не становится тяжелее, схемы лечения остаются неизменными, а основной упор следует по-прежнему делать на профилактику. А потому всем нам необходимо, как и прежде, соблюдать «Правило 3Р и 3П» и этому же учить наших детей.
ПРАВИЛО 3Р и 3П
|
Соблюдайте правило 3Р |
Избегайте 3П |
|
1. Руки мойте с мылом не менее 30 с как можно чаще 2. Рот/нос/глаза должны быть закрыты маской или экраном 3. Расстояние от вас до других людей должно быть не менее 1,5 м |
1. Плохо проветриваемых помещений 2. Помещений или Площадок с большим скоплением людей 3. Подошедших к вам слишком близко разговаривающих или поющих людей |
Всем рекомендуется настроиться на вакцинацию, потому что разработанные вакцины эффективны и против новых мутаций тоже. А главное — всем следует сохранять бодрость духа и позитивный настрой — ведь именно в этом залог хорошего иммунного ответа и защиты от любых опасных возбудителей. И тогда, быть может, через несколько лет мы вновь вернемся к штилю на Земле, а пока у нас все еще действует ШТОРМОВОЕ ПРЕДУПРЕЖДЕНИЕ!
Отравление у детей
Во всем мире количество острых отравлений неуклонно растет, эту ситуацию называют «ползучей катастрофой». В связи с широким распространением в окружающей среде различных химических и фармакологических препаратов все больше детей поступает в токсикологические отделения с диагнозом острого экзогенного отравления.
Другая, еще более серьезная, причина – легкомысленное отношение матери к здоровью собственного ребенка, ее невнимательность и расчет на русский “авось”.
Годовалый малыш проснулся рано и вылез из кроватки. Мама одела его и пустила на “свободный выпас”, а сама легла досыпать.
Скажете: такого не может быть? К сожалению, может, как и все остальные случаи из личной врачебной практики.
Малыш, оставшись без присмотра, с удовольствием хозяйничал на кухне, рассыпал крупу, разлил масло, а потом забрался на стул и достал с полочки бабушкин клофелин. Через час, когда проснулась мама, спал уже малыш, зажав в кулачке флакончик с таблетками.
В гости к маме пришла подружка, с которой давно не виделись. Накопилось столько новостей, требующих немедленного обсуждения за чашкой кофе и сигаретой. Но ведь пассивное курение вредно для ребенка. Поэтому его оставили в комнате, а сами удалились на кухню. Сколько длился перекур, неизвестно. Мама утверждает, что совсем недолго. Но малышу хватило времени, чтобы из сумки гостьи достать противозачаточные таблетки и полакомиться ими.
Двухлетняя девочка играла на полу с игрушками и вдруг там же на полу уснула. Мама перенесла ее в кроватку, и занялась домашними делами, довольная, что ребенок не мешает. Через какое-то время мать обратила внимание, что сон девочки беспокоен, она плачет, не просыпаясь, производит беспорядочные движения конечностями, словно отбиваясь от кого-то.
Врач скорой помощи заподозрил медикаментозное отравление, и на полу среди игрушек был обнаружен пузырек с амитриптилином (применяется при депрессиях). Беспокойное поведение ребенка объяснялось возникновением галлюцинаций.
Мама налила в чайник “Антинакипин” и оставила на ночь, чтобы растворился весь осадок. Когда рано утром малыш потребовал законную бутылочку, полусонная мама развела молочную смесь водой из злополучного чайника и дала ребенку. Спохватилась она, лишь заметив, что смесь в бутылочке свернулась хлопьями. А за это время малыш уже успел отхлебнуть изрядную дозу.
Подобных примеров можно привести тысячи.
Но есть и другие случаи, когда мама собственной рукой превышает дозу лекарства или по ошибке дает ребенку другое средство.
В каждой семье есть аптечка с набором самых необходимых и, казалось бы, безобидных лекарств. Но так ли они безобидны?
Еще в XYI веке врач и естествоиспытатель Парацельс сказал: «Яд от лекарства отличает только доза.»
Известно ли вам, что широко рекламируемые и любимые родителями «Калпол», «Панадол», «Тайленол»и другие лекарства на основе парацетамола уже в дозе, лишь в два раза превышающей разовую, оказывают токсическое влияние на печень, а десятикратное превышение разовой дозы вызывает почечную недостаточность? Не слишком ли тяжелая расплата за бесконтрольное употребление «сиропа с ароматом клубники»?
Знакомые всем препараты димедрол, супрастин, пипольфен, кроме аллергического, обладают успокаивающим и снотворным действием, что делает их весьма популярными у некоторых родителей.
Желая, чтобы ребенок поспал подольше в выходной или праздничный день, мама дает малышу димедрол в повышенной дозе.
Вопреки ожидаемому результату ребенок не засыпает, и получает еще одну таблеточку. После этого ребенок не только не успокаивается, но напротив, становится возбужденным, не находит себе места в кроватке, отбивается от кого-то невидимого руками, извивается, плачет. Кожа у него покраснела и стала сухой, зрачки расширились, сердечко бьется учащенно. И виной всему стала передозировка димедрола.
У грудничка насморк. Он не может сосать грудь, плохо спит. Доктор назначил малютке сосудосуживающие капли в нос: нафтизин, галазолин или санорин. После первой же процедуры малыш свободно задышал носом, хорошо поел и спокойно заснул. Довольная мама стала закапывать ему капли перед каждым кормлением, а потом еще перед тем, как уложить спать. К вечеру ребенка словно подменили: он стал вялым, сонливым, отказывался от еды и просился в кроватку. Кожа стала бледной, холодной, усилилось потоотделение. Измерив температуру, мама пришла в ужас: 34,7 С. Так интенсивное лечение насморка привело к отравлению малыша.
Все чаще сосудосуживающие капли выпускаются в пластиковых флаконах, снабженных носиком-капельницей. Делается это для удобства потребителей: снял колпачок, надавил на податливые стенки, закапал лекарство в нос, и никакой возни с пипеткой. Для маленьких детей такой способ не годится, так как, применив усилие, можно впустить лекарство струей, значительно превысив дозу. Воспользуйтесь обычной пипеткой, набирая в нее столько капель, сколько назначил врач.
У ребенка многократная рвота, и мама, вместо того, чтобы пригласить врача, два дня подряд дает ему церукал («Я знаю, что он останавливает рвоту»). А о побочных действиях этого препарата, так же, как и о нежелательности его применения у детей до 14 лет, она и понятия не имеет. Поэтому, когда на 3-й день у ребенка появились насильственные движения в конечностях и мышцах шеи (переразгибание рук, непроизвольные повороты головы в сторону) и судорожные подергивания (гримасы) лицевой мускулатуры, мама очень удивилась и вызвала скорую помощь. Едва взглянув на мальчика, врач скорой помощи спросил: «Церукал давали?», и, получив утвердительный ответ, приступил к промыванию желудка через зонд.
К сожалению, отравления у детей не ограничиваются лекарственными средствами. В быту нас окружают химические вещества, призванные улучшить и облегчить нашу жизнь. Сколько бед и несчастий принесла и еще принесет детям уксусная эссенция, используемая в каждой семье для домашнего консервирования!.Ни в одной стране мира не выпускается уксусная кислота такой концентрации для бытовых целей, а у нас – пожалуйста, пей – не хочу.
Ни педантичной немке, ни легкомысленной француженке, ни дисциплинированной американке не придет в голову перелить ядовитое вещество в бутылку из-под «Пепси» или «Фанты», а у нас сплошь и рядом причиной отравления малышей является пренебрежение элементарными правилами хранения моющих и дезинфицирующих средств и предметов бытовой химии.
«Как же так получилось? – сокрушается мама, – ведь я же написала на бутылке, что здесь бензин».
Но малыш читать не умеет, зато хорошо помнит, что вчера на прогулке папа наливал ему вкусную водичку из такой бутылки.
У детей до одного года двигательная активность и поле деятельности ограничены кроваткой или манежем. Самостоятельно достать и проглотить лекарства или токсические вещества они не могут. Поэтому причина отравлений у малышей первого года жизни – это невнимательность и беспечность родителей, когда, перепутав посуду, они дают ребенку вместо воды спиртные напитки или другие токсические вещества; вместо капель для носа закапывают глазные капли с клофелином; выполняя назначения врача, превышают дозу лекарств, а нередко лечат ребенка самостоятельно, не советуясь с врачом, полагаясь на собственные знания или советы подруг.
Способность малыша к самостоятельному передвижению увеличивает риск несчастных случаев, в том числе и отравлений. Недоступных мест для ребенка становится все меньше, а предметов и веществ с привлекательным видом все больше. Разве можно пройти мимо пузырька с такими красивыми разноцветными таблетками? Надо немедленно достать их и попробовать. О, да они еще и в сладкой оболочке, настоящие конфеты!
Всегда помните о том, что ребенок «познает мир через рот». Этим обстоятельством и объясняется наибольшее количество отравлений в группе детей 2‑го и 3‑го лет жизни.
Добавьте сюда неряшливость матери в быту, небрежность взрослых при хранении лекарств и химических веществ, и картина будет полной.
Судьба ребенка с острым отравлением нередко зависит от правильного поведения матери или окружающих. Что должна сделать мать, если ребенок принял какое-то лекарственное или химическое вещество?
Если факт приема ядовитого вещества установлен, немедленно вызывайте скорую помощь, а до приезда бригады освободите ротовую полость ребенка от таблеток, которые он не успел проглотить, постарайтесь прополоскать ему рот и напоить большим количеством воды (до 200мл) с двумя растолченными таблетками активированного угля или другого адсорбента, например, полифепана (1—2 чайные ложки).
Не поите ребенка молоком, так как некоторые яды являются жирорастворимыми, и жир, содержащийся в молоке, ускорит всасывание яда.
Попробуйте собрать и сосчитать оставшиеся таблетки, прикиньте, сколько таблеток успел проглотить малыш. Каждому ясно, чем больше доза, тем тяжелее отравление, тем серьезнее прогноз.
Но не стоит успокаиваться, если не досчитались “всего одной” таблетки. Некоторые лекарственные препараты обладают таким сильным и быстрым действием, что и одна таблетка может привести к тяжелым нарушениям жизненно важных функций. К таким препаратам относятся нитроглицерин, аминазин, дигоксин, гемитон, клофелин, амитриптилин.
Ни в коем случае не вызывайте рвоту у ребенка, если отравление произошло концентрированной кислотой или едкой щелочью, вызывающими ожоги полости рта, глотки и пищевода. Едкое вещество при прохождении в обратном направлении неизбежно увеличит площадь и глубину ожога, а также может попасть в дыхательные пути. Постарайтесь напоить ребенка водой (1,5 – 2 стакана), чтобы уменьшить концентрацию едкого вещества в желудке.
Бытующее в народе мнение, что при отравлении кислотой надо пить щелочные напитки, а при отравлении щелочами – слабокислые растворы, неверно, так как образующийся в результате такой реакции углекислый газ является причиной перерастяжения желудка и ухудшения состояния ребенка.
Если отравление произошло газом или испарениями ядовитого вещества, ребенка срочно следует вывести из загазованного помещения, освободить от стесняющей одежды, очистить дыхательные пути от слизи и рвотных масс.
При попадании ядовитого вещества в глаза необходимо провести промывание глаз струей теплой воды с помощью шприца (без иглы) или резиновой груши в течение 5 минут.
Если отравляющее вещество попало на кожу, ребенка надо раздеть и тщательно промыть кожу теплой проточной водой с мылом, сначала обрабатывая загрязненные участки, а затем всю поверхность тела.
Порой факт приема ребенком лекарственных или химических веществ остается неизвестным матери или другим взрослым членам семьи, что существенно затрудняет диагностику, приводит к несвоевременному оказанию помощи, и ухудшает прогноз.
Настораживающим моментом, заставляющим мать подумать об отравлении, является изменение поведения ребенка: обычно активный и веселый, он вдруг становится вялым, сонливым, засыпает в неурочное время. Сон такой глубокий и крепкий, что его невозможно разбудить. Или, наоборот, во сне ребенок совершает активные движения, ползает по кровати, отбивается от кого-то руками и ногами, плачет, кричит, не просыпаясь. Такое поведение свидетельствует о галлюцинациях. Могут возникнуть судороги, потеря сознания.
Подумайте об отравлении, если…
– у вашего малыша насморк, и вы, не жалея лекарства, закапываете ему в нос сосудосуживающие капли, а ребенок становится вялым, отказывается от еды и просится спать;
– ребенок вдруг становится дурашливым, смешливым без причины, его «штормит», т.е. шатает в стороны при ходьбе, он натыкается на предметы, спотыкается на ровном месте;
– среди полного здоровья внезапно ухудшается состояние ребенка, нарушается сознание, появляются судороги, а признаки острого воспалительного заболевания отсутствуют.
Вызывайте скорую помощь и расскажите о своих наблюдениях и подозрениях врачу. Чем раньше вы это сделаете, тем лучше для ребенка.
Неужели ничего нельзя сделать, чтобы уберечь детей от воздействия токсических веществ? Можно и даже нужно!
Профилактика отравлений чрезвычайно проста и не требует от родителей ни моральных, ни материальных затрат.
Лекарства должны храниться в недоступном для ребенка месте. Периодически устраивайте ревизию в домашней аптечке и освобождайтесь от ненужных, с истекшим сроком годности, со стершейся надписью лекарств. Не держите лекарства «под рукой» в косметичке, в кармане, в сумочке. Ваш юный следопыт отыщет их везде и попробует «на зуб».
Если во время болезни вы даете ребенку таблетки или витамины, никогда не называйте их «конфетками».
Чистящие и моющие средства, аэрозоли для борьбы с насекомыми, пятновыводители и растворители, технические жидкости храните в закрытом помещении или в запертом на ключ шкафу.
Не допускается переливание потенциально ядовитых веществ в тару из-под пищевых продуктов.
Жидкость для снятия лака, дезодоранты, косметические лосьоны должны храниться на высокой полке, куда ребенок не сможет добраться даже со стула.
Не оставляйте в рюмках недопитые алкогольные напитки. Пока вы провожаете гостей, дети могут продолжить праздничное застолье, следуя вашему примеру.
Не держите в доме ядовитые растения, а на прогулке не разрешайте малышу пробовать «красивые ягодки» с деревьев и кустарников.
Все вышесказанное в большей мере относится к малышам, отравления которых носят, в основном, случайный характер.
О прививках. Как подготовить ребёнка к прививке?
Главная » Здоровье » О прививках. Как подготовить ребёнка к прививке?Родители знают: уберечь свое чадо от инфекционных заболеваний в большом детском коллективе, будь то ясли, детский садик или школа, практически невозможно. Единственным средством защиты детей остаются прививки.
Цифры в календаре прививок означают лишь приблизительный возраст, с которого можно начинать вакцинацию. Но родителям всегда стоит помнить, что нужный момент подбирается индивидуально. Если у малыша есть отклонения в развитии (не только отставание, но и опережение) или противопоказания (аллергия и т.п.) лечащий врач может отойти от строгого графика.
Раньше срока делаются лишь прививки в случаях, если в группе детского садика или семье кто-то заболел заразной болезнью.
Отложить прививку необходимо, если ребенок только что перенес какое-либо инфекционное или вирусное заболевание. Нужно хорошенько долечить его и только тогда отправляться на прививку. Врачи советуют переждать как минимум месяц после выздоровления, а также воздержаться от плановых прививок во время эпидемий гриппа и ОРЗ.
Количество плановых прививок рассчитано на самый слабый иммунитет. Потому что практически у всех наших детей сегодня он именно такой. И даже еще слабее, потому что участились случаи заболевания привитых детей, чей организм не способен выработать необходимые антитела даже будучи специально спровоцированным вакциной. Правда, в случае заболевания привитый ребенок переносит его в несравнимо более легкой форме и никогда не погибает.
Вакцины не оказывают на организм ребенка по-настоящему вредного воздействия. Реакция на внесение в организм «заразы» хотя часто и пугает родителей (повышение температуры, краснота, припухлость и болезненность в месте прививки), но неизмеримо легче самой инфекции, против которой делается прививка.
Чем мы можем помочь нашему малышу, чтобы прививка подействовала с максимальной пользой? Уже за 5-7 дней до прививки постарайтесь отгородить ребенка от многочисленных сборищ – и не только детских. Не стоит вести его на рынок, запихивать в переполненный автобус и идти с ним на юбилей к любимой троюродной бабушке. Если ребенок часто страдает пищевой аллергией, придется несколько дней соблюдать диету, отказавшись от всех «запретных» лакомств. Накануне искупайте ребенка, ведь, как правило, несколько следующих дней ему придется обойтись без ванны. В день прививки измерьте ребенку температуру.
После прививки будьте повнимательнее к малышу. Его «обычные» капризы на этот раз могут быть вызваны недомоганием: побалуйте его ласками, но не лакомствами. Контролируйте температуру – ее повышение до38,5 градусов можно считать нормой. Она держится не дольше 2-3 дней и снижается без применения каких-либо лекарственных препаратов. Если состояние ребенка выходит за рамки обычного легкого недомогания, побалуйте его ласками, но не лакомством.
О профилактике поствакцинальных осложненийКогда подходит время делать ребенку плановую прививку, у родителей возникает масса опасений и подозрений, касающихся ее безопасности. Как подготовить ребенка к вакцинации и в последствии отличить нормальную реакцию детского организма от негативной? Особенно эти вопросы волнуют родителей детей, страдающих хроническими заболеваниями.Вакцинация – единственный способ защиты от ряда заболеваний, которые невозможно вылечить другими средствами или само лечение может вызвать осложнение (например, корь, дифтерия и пр.). Врожденной невосприимчивости к инфекционным заболеваниям, от которых существуют прививки – нет. Если мама ребенка когда-то болела ими, то первые 3–6 месяцев жизни доношенный ребенок может быть защищен материнскими антителами, которые попали к нему через плаценту во время беременности и через грудное молоко. У недоношенных детей и детей на искусственном вскармливании такой защиты нет. Поскольку возможность заболеть из-за контактов с другими людьми велика, очень важно прививать малышей с самого раннего возраста.
Как же подготовить малыша к прививке и попытаться свести к минимуму риск возникновения осложнений?
Сразу отметим, что здоровых детей не требуется специально готовить к прививке, нужно лишь предварительно измерить температуру тела (она должна быть нормальной, чаще 36,6 градусов С; у детей до 1 года нормальной температурой может быть 37,1–37,2 градусов за счет особенностей теплообмена, он повышен, не зря детей, которые уже ходят, бегают, рекомендуется одевать чуть холоднее, чем взрослых), привести ребенка к специалисту и ответить на его вопросы.
Некоторые врачи прибегают к практике назначения всем детям перед прививкой, так сказать профилактически, приема противоаллергических препаратов, например ТАВЕГИЛА, КЛАРИТИНА, ЗИРТЕКА. В действительности такой “поголовной” необходимости нет. Не все дети предрасположены к аллергии и соответственно не все нуждаются в таких лекарствах. Скорее это происходит из-за желания врача лишний раз подстраховаться или из-за того, что выявление детей группы риска по аллергии это более трудоемкий процесс. Но если ребенок склонен к аллергическим реакциям, то профилактическое применение противоаллергических препаратов оправдано. Например, такая ситуация, ребенок первого года жизни, ранее аллергия не проявлялась, прививается против коклюша, дифтерии, столбняка (АКДС).
Первая прививка (на первом году АКДС делается трижды) прошла без особенностей, но после второй прививки ребенку начали вводить новое питание, и у малыша появилась впервые аллергическая сыпь, значит, перед третьей прививкой следует профилактически дать ребенку противоаллергический препарат, чтобы высыпания не повторились. Для профилактики поствакцинальных осложнений врач должен, в первую очередь, оценить состояние здоровья ребенка перед прививкой. Выявить противопоказания к ней — временные и постоянные (например, выраженная аллергическая реакция на предыдущее введение подобной вакцины), и решить вопрос о необходимости назначения каких-либо предварительных дополнительных обследований и лекарственных препаратов. Перед прививкой врач (фельдшер) осматривает ребенка, измеряет температуру (она должна быть нормальной – 36,6 градусов С), подробно расспрашивает родителей о жизни ребенка, перенесенных им заболеваниях и прочее. Родители, в свою очередь, должны проинформировать врача о всех особенностях и проблемах здоровья своего малыша.
О чем необходимо сказать врачу:
- Не повышалась ли температура в дни, предшествующие вакцинации? Не было ли каких-либо других признаков нездоровья, например, кашля, чихания, насморка, которые могут свидетельствовать о начале заболевания?
- Имеются ли у ребенка какие-либо хронические заболевания и не получает ли он в связи с этим постоянно лекарственные препараты, если да, то какие?
- Не было ли ранее судорог, выраженных аллергических реакций на пищу, лекарства и пр.?
- Необходимо рассказать, как ребенок переносил предыдущие прививки, повышалась ли у него температура, ухудшалось ли самочувствие и др.
- Не рекомендуется делать прививки сразу после возвращения из длительной поездки, особенно, если резко менялся климат, так как это создает условия для заболеваний.
- Необходимо сказать, получал ли ребенок в последние три месяца препараты, изготовленные на основе крови, или производилось ли переливание крови. Это влияет на сроки последующей вакцинации против кори, краснухи и паротита, они увеличиваются, т.к. препараты крови содержат готовые антитела – специфические защитные белки крови против указанных инфекций, которые “мешают” ребенку активно выработать иммунитет самому.
Если при осмотре перед прививкой врач делает заключение, что ребенок практически здоров, проводится прививка.
Когда и как прививают больных детей?Если у ребенка имеются заболевания, находящиеся в настоящее время вне обострения и ему нужно сделать прививку, то к мерам профилактики, проводимым у здоровых детей, добавляются предварительные обследования. Решается вопрос о необходимости назначения различных препаратов за 3–4 дня до проведения прививки и на весь период после процесса: 3–5 дней после введения неживых, химических вакцин и т.д., и 14 дней при использовании живых вакцин. В своих прошлых публикациях мы указывали на возможность развития осложнений после прививок . Их профилактика включает еще целый комплекс мероприятий, к которым относится соблюдение техники вакцинации, назначение в ряде случаев до прививки и после лекарственных средств, помогающих избежать осложнений, определенный режим и питание ребенка, патронаж (специальное наблюдение) после вакцинации. Медицинские работники навещают привитого ребенка на дому или узнают о состоянии его здоровья по телефону, чтобы не пропустить ситуации осложнения, развившиеся после прививки.
Какие признаки могут указать на неврологические проблемы ребенка при осмотре перед прививкой?У маленьких детей – напряжение, выбухание большого родничка в вертикальном положении, расширение подкожных вен головы, частые срыгивания, излишние движения языка, повышение мышечного тонуса рук и ног, тремор (мелкое дрожание) подбородка и рук в спокойном состоянии, нарушение сна и пр. Перечисленные признаки могут свидетельствовать о повышенном внутричерепном давлении. Чрезмерно быстрый рост головы, увеличение размеров большого родничка, вместо его сокращения и другие признаки могут свидетельствовать о гидроцефальном синдроме – избыточном накоплении мозговой жидкости в желудочках мозга и других внутричерепных пространствах. Эти и другие заболевания нервной системы выявляет и описывает при плановом осмотре детей до 3-х месяцев невролог.
Для подтверждения или исключения патологии проводят дополнительные исследования, например, ультразвуковое исследование головного мозга – нейросонографию, когда датчик аппарата устанавливается на большом родничке и на экране отображается картина строения мозга. Многие педиатры, неврологи склонны настороженно относиться к вакцинации детей с неврологическими проблемами из-за боязни усугубить течение патологии в поствакцинальном периоде. Это не правильно, так как инфекция, от которой проводится прививка, гораздо более опасна для ребенка с поражением нервной системы. Например, коклюш у таких детей, особенно в возрасте до года может вызывать тяжелые поражения мозга, судороги и прочее. К сожалению, иногда о поражении нервной системы начинают думать уже после прививки, которая спровоцировала временные ухудшения в работе этой системы. Поэтому основным средством предупреждения поствакцинальных осложнений со стороны нервной системы является своевременное выявление неврологической патологии у новорожденного, ее лечение и проведение прививок на фоне медикаментозной терапии или по ее окончании.
Какие медикаментозные средства обычно применяют при подготовке к иммунизации детей с неврологическими проблемами?
Детям с повышенным внутричерепным давлением и гидроцефальным синдромом, назначают мочегонные средства (в том числе травы), препараты, улучшающие кровоток и обмен веществ в мозговой ткани. Курсы терапии повторяют 2-3 раза в год, в эти же периоды может быть проведена иммунизация ребенка. Если прививкуделают после завершения лечения, то желательно в момент иммунизации снова провести короткий курс ранее применявшихся средств (мочегонных, успокоительных и т.п.). Если у ребенка были судороги, вызванные повышенной температурой, прививкиможно проводить не ранее, чем через 1 месяц после приступа. До и после прививки назначают противосудорожные, и иногда мочегонные лекарства. Детям, перенесшим судороги, причиной которых являлась температура выше 38,0 градусов С, в дальнейшем можно делать все прививки. Если судороги были на фоне температуры менее 38,0 градусов С, то не вводят коклюшную вакцину, входящую в состав комплексной вакцины против коклюша, дифтерии, столбняка (АКДС). Остальные вакцины могут быть использованы. Всем детям, ранее имевшим судороги или предрасположенным к ним, после прививки назначают и жаропонижающие препараты, так как вакцины могут вызвать высокую температуру и снова провоцировать судороги.
При наличии у ребенка эпилепсии, вакцинация также осуществляется не ранее, чем через 1 месяц после приступа, без коклюшной вакцины, на фоне противосудорожной терапии. При тяжелых формах эпилепсии вопрос о прививках решается индивидуально с врачом невропатологом. Дети с непрогрессирующими поражениями нервной системы (хромосомные, генетические заболевания, врожденные аномалии развития, детский церебральный паралич и т.п.), психическими заболеваниями вне острого периода, с умственной отсталостью и перенесшие воспалительные заболевания нервной системы не имеют противопоказаний к прививкам. Их вакцинируют с использованием симптоматической (применяемой при лечении конкретного заболевания) терапии или не назначают лекарств совсем.
Прививки и аллергические заболеванияДостаточно частой патологией на первом году жизни и в более старшем возрасте являются аллергические заболевания: пищевая аллергия, бронхиальная астма и т.п. Прививки в таком случае проводят не ранее 1 месяца после завершения обострения. Основными принципами профилактики осложнений после вакцинации у этой группы детей является – режим питания (особенно для детей с пищевой аллергией), исключающий введение новых продуктов за 5-7 дней до и после прививки. На новую пищу у них возможна аллергическая реакция, которую родители и врач ошибочно будут трактовать как реакцию на вакцину. Так же исключаются аллергены, на которые ребенок заведомо дает аллергические реакции. Например, ребенка с аллергией на пыльцу какого-либо растения не прививают, когда оно цветет.
До и после прививки могут быть назначены противоаллергические препараты, препараты, содержащие бифидо- и лактобактерии. Они благотворно влияют на микрофлору кишечника, так как при аллергических заболеваниях часто происходит ее нарушение. Детям с бронхиальной астмой, постоянно получающим ингаляционные препараты, в том числе и гормональные, это лечение не отменяется, а продолжается.
Вакцинация часто болеющих детейПри иммунизации детей, страдающих частыми респираторными заболеваниями, хроническими заболеваниями ЛОР – органов (уши, гортань, нос), повторными бронхитами, пневмониями, наиболее частой проблемой является развитие респираторных и других инфекций в поствакцинальном периоде. Предрасполагают к возникновению частых заболеваний особенности иммунной системы ребенка. Не у всех детей в одно время “созревают” иммунные реакции, поэтому одни являются более, а другие – менее восприимчивыми к инфекциям. Способствует заболеваниям и стрессовая ситуация, например, когда ребенок не комфортно себя чувствует в детском учреждении и находится в состоянии хронического стресса.
В какой-то мере к стрессу можно отнести и прививку. Для профилактики таких заболеваний до и после вакцинации назначают общеукрепляющие средства (витамины, растительные и гомеопатические средства) или противовирусные препараты, изготовленные на основе крови человека (ИНТЕРФЕРОН) или синтетический интерферон (ВИФЕРОН) и пр., а также, препараты, способные моделировать иммунитет (РИБОМУНИЛ, ПОЛИОКСИДОНИЙ и др.).
Как готовят к прививке старших дошкольников с хроническими заболеваниями?У более старших детей после прививки могут обостриться уже диагностированные хронические заболевания эндокринной системы, соединительной ткани, крови и кроветворных органов, почек, печени, сердца и др. Основной принцип иммунизации таких детей — прививать не ранее, чем через 1 месяц после окончания обострения и осуществлять профилактику обострений после прививки. Детям с хроническими заболеваниями проводят минимальное лабораторное обследование (например, анализы мочи при болезнях почек). Если анализы в норме, то ребенка прививают на фоне противорецидивной терапии, которую назначают за 3-5 дней до и на 7-14 дней после прививки. Рекомендуется провести контрольные лабораторные обследования через 7, 14 и 30 дней после прививки (анализы мочи, крови и др.). Такое обследование позволяет быть уверенным в достаточности медикаментозной терапии, которую получал ребенок в момент прививок. Если в анализах выявляются изменения, характерные для обострения хронического заболевания, то последующие прививки проводят после нормализации состояния на фоне более интенсивного лечения. Вот такая непростая последовательность комбинаций требуется для прививания заведомо нездорового малыша.
Но все же следует помнить о том, что инфекция, в плане обострения хронического заболевания много опаснее, чем возможность минимальных, крайне редко встречающихся, контролируемых обострений при вакцинации. Кроме того, детям с любыми хроническими заболеваниями рекомендуется проводить дополнительные прививки (помимо плановых) против гемофильной инфекции типа В, менингококковой, пневмококковой инфекций, гриппа. После прививки, и в последующие дни, родителям следует обращать внимание на состояние ребенка.
Первые три дня рекомендуется измерять температуру, особенно после прививкипротив коклюша, дифтерии и столбняка (АКДС, Тетракок). Если состояние не изменилось и не ухудшилось, т.е. малыш весел, бодр, у него хороший аппетит, спокойный сон и пр., то его режим жизни менять не нужно. Продолжайте как обычно, кормить, купать ребенка, гулять с ним. Единственно – следует ограничить общение с чихающими, кашляющими людьми, и детьми, чтобы ребенок не имел шансов заразиться. С этой же точки зрения не желательно путешествовать с ребенком сразу после прививки.
Если родителям необходимо куда-то уезжать с малышом, следует подумать о прививках заранее, за 1-2 недели до отъезда. За это время успеют выработаться антитела на введенную вакцину и успеют проявиться нежелательные эффекты от прививки, если им суждено быть. В дороге или в чужом городе может оказаться сложнее оказать медицинскую помощь ребенку.
Что же делать, если после прививки повысилась температура, ухудшилось общее состояние малыша?Следует воздержаться от купания и прогулок. Сообщите о нарушении состояния ребенка медицинской сестре, которая проводит патронаж после прививки или врачу. Дайте жаропонижающие средства в возрастной дозировке: для детей, перенесших ранее судороги – сразу же при любой повышенной температуре (даже если это 37,1 градусов С), для остальных – при температуре выше 38,5 градусов С. Своевременное обращение к врачу позволит выяснить, с чем связана температура – с обычной реакцией на вакцину, случайным заболеванием или с чем-либо еще.
Правильно поставленный диагноз – залог безопасности дальнейшей вакцинации. Помните, что в месте введения всех вакцин может появиться краснота и уплотнение, которые должны пройти через 1-3 дня. Если уплотнение, покраснение держится дольше 4 дней или его размеры более 5-8 см, необходимо обязательно проконсультироваться у врача.
Можно ли делать прививку в специальном центре?Любого ребенка, а тем более, страдающего каким-либо заболеванием можно прививать в специализированных центрах иммунопрофилактики (филиалы таких центров могут существовать и в участковых поликлиниках), под наблюдением врачей иммунологов. Они составят индивидуальный график прививок, подберут оптимальный тип вакцины для конкретного малыша и пр. Такие меры позволят свести к минимуму риск развития поствакцинальных осложнений и создать эффективную защиту организма от тяжелых и опасных инфекций.
Исключение из правилИзвестно, что детям во время острого заболевания или обострения хронического, плановые прививки не проводят. Вакцинацию откладывают до выздоровления или завершения обострения хронического процесса. Однако, если возникает экстренная ситуация, когда нужно привить нездорового ребенка, это может быть сделано (вакцинация по экстренным показаниям). Например, ребенок болен ОРВИ, или у него обострилось хроническое заболевание, и при этом он общался с больным дифтерией или его укусила собака и т.д. В таких случаях противопоказаниями к вакцинации можно пренебречь, чтобы по жизненно важным обстоятельствам срочно привить ребенка.
Использование противовирусных препаратов в неонатальном периоде
Clin Perinatol. Авторская рукопись; доступно в PMC 1 марта 2013 г.
Опубликован в окончательной отредактированной форме как:
PMCID: PMC32
NIHMSID: NIHMS351802
Ричард Дж. Уитли
Заслуженный профессор микробиологии, профессор педиатрии Леба Медицина и нейрохирургия, Университет Алабамы в Бирмингеме, Бирмингем, AL
Ричард Дж.Уитли, заслуженный профессор, научный сотрудник Леба в области педиатрии, профессор педиатрии, микробиологии, медицины и нейрохирургии, Университет Алабамы в Бирмингеме, Бирмингем, Алабама;
Окончательная отредактированная версия этой статьи издателем доступна в Clin Perinatol. См. Другие статьи в PMC, в которых цитируется опубликованная статья.Введение
Парентеральная терапия вирусных инфекций новорожденных и младенцев стала реальностью с появлением в начале 1980-х годов видарабина (аденин арабинозида) для лечения инфекций, вызванных вирусом простого герпеса (ВПГ) новорожденных.С тех пор ацикловир стал препаратом выбора для лечения неонатальных инфекций HSV, а также множества других герпесвирусных инфекций. Аналогичным образом было установлено, что ганцикловир полезен для лечения врожденных цитомегаловирусных (ЦМВ) инфекций, поражающих центральную нервную систему (ЦНС). В этой главе будут рассмотрены уроки, извлеченные из лечения неонатального ВПГ и врожденных ЦМВ-инфекций в связи с применением ацикловира и ганцикловира. Хотя естественная история этих заболеваний рассматривается в другом месте в этом тексте, краткое изложение будет предшествовать подробному обсуждению имеющихся установленных и альтернативных методов лечения.Отсылаем читателя к более обширным обзорам противовирусной терапии у детей и взрослых [1, 2].
Терапия инфекций, вызванных вирусом простого герпеса
Неонатальные инфекции ВПГ встречаются примерно у 1 из 3200 родов в США [3], и примерно у двух третей из них развивается какая-либо форма заболевания ЦНС [4]. Большинство случаев вызвано ВПГ-2 [5]. Риск передачи увеличивается при первичной материнской инфекции в третьем триместре, составляя 30–50%, и может быть снижен путем кесарева сечения, если HSV был изолирован из шейки матки или наружных половых органов незадолго до родов [3].Согласно обзору Кимберлина, 85% случаев неонатальной передачи вируса простого герпеса возникают в результате послеродовой передачи, в то время как 10% происходят в результате послеродовой передачи и только 5% связаны с передачей внутриутробно [6].
Младенцы с внутриутробной инфекцией ВПГ характеризуются триадой кожных проявлений (активные поражения, рубцы), неврологических признаков (микроцефалия, гидранэнцефалия) и глазных патологий (хориоретинит, микрофтальмия), присутствующих при рождении. Было обнаружено, что внутриутробная инфекция ВПГ возникает как при первичной, так и при рецидивирующей материнской инфекции ВПГ [7], хотя риск повторной инфекции меньше.
Инфекция HSV, приобретенная в послеродовом или послеродовом периоде, может быть классифицирована как заболевание кожи, глаз и / или рта (SEM), заболевание ЦНС или диссеминированное заболевание. По определению, болезнь SEM не затрагивает ЦНС. Распространенное заболевание может поражать ЦНС (75% случаев) вместе с множеством других систем органов, включая печень, надпочечники, желудочно-кишечный тракт, кожу, глаза или рот [8]. Заболевание ЦНС также может иметь компонент вовлечения SEM, но не затрагивает другие системы органов.Из всех младенцев с неонатальной инфекцией ВПГ около 33% имеют заболевание ЦНС, а около 25% имеют диссеминированное заболевание [9]. Таким образом, около 50% младенцев с неонатальной инфекцией ВПГ имеют заболевание ЦНС.
Патогенез поражения ЦНС при неонатальных инфекциях ВПГ различается в зависимости от того, является ли инфекция диссеминированной. Энцефалит, связанный с диссеминацией, происходит из-за гематогенного распространения, тогда как изолированный энцефалит или энцефалит, связанный только с вовлечением SEM, вероятно, возникает из-за ретроградного внутринейронального транспорта HSV [4].Это различие соответствует клиническим проявлениям диссеминированного заболевания по сравнению с заболеванием ЦНС в том смысле, что распространение диссеминированного заболевания через кровь проявляется раньше (в среднем от 9 до 11 дней жизни) и вызывает более диффузное поражение мозга с множественными участками геморрагического некроза, в то время как заболевание ЦНС происходящий через более медленный аксональный транспорт, проявляется позже (примерно от 16 до 17 дней жизни) и обычно вызывает более очаговое поражение ЦНС [10].
Ранняя эра противовирусной терапии неонатальной инфекции ВПГ была отмечена повышением смертности при внутривенном введении видарабина, а также при внутривенном введении стандартной дозы (SD) ацикловира (30 мг / кг / день в 3 приема).Годовая смертность от диссеминированного заболевания снизилась с 85% при отсутствии терапии до 50% при использовании видарабина и 61% при использовании ацикловира SD, в то время как смертность за 1 год от заболевания ЦНС снизилась с 35% без лечения до 14% как для видарабина, так и для ацикловира SD. [11]. Совсем недавно было показано, что ацикловир в высоких дозах (HD) дополнительно улучшает эти показатели смертности. При внутривенном введении ацикловира на HD (60 мг / кг / день в 3 приема в течение 21 дня) уровень смертности в течение одного года составил 29% и 4% от диссеминированных заболеваний и заболеваний ЦНС, соответственно [12].В то время как HD ацикловир снижал заболеваемость младенцев с диссеминированным заболеванием (83% выживших имели нормальные исходы нервного развития), у младенцев с заболеванием ЦНС не наблюдалось значительного улучшения заболеваемости (31% выживших имели нормальные исходы неврологического развития).
Младенцы с поражением SEM имеют наилучший прогноз и, как указано ниже, им требуется всего 14 дней внутривенной терапии ацикловиром на HD.
В последнее время супрессивная терапия ацикловиром для младенцев с ЦНС после завершения внутривенного лечения значительно улучшила неврологический исход, измеренный по шкале Bailey Developmental Scores [13].Этот режим привел к тому, что примерно 60% (по сравнению с 31%) детей с заболеванием ЦНС развились нормально или с легкими нарушениями. Лечение проводилось в дозе 300 / мг / м 2 за три раза в день в течение шести месяцев.
Терапия неонатальных инфекций, вызванных вирусом ветряной оспы
У женщин, перенесших первичную инфекцию вируса ветряной оспы (VZV) в течение 48 часов после родов, рождаются дети с риском развития ветряной оспы в течение первых трех недель жизни. Новорожденным этим женщинам традиционно вводят иммуноглобулин против опоясывающего лишая (ZIG), чтобы предотвратить заболевание.Однако при спорадической нехватке ZIG у некоторых новорожденных могут развиться неонатальные заболевания. Никакие контролируемые клинические испытания не оценивали терапию этого заболевания ацикловиром; однако специалисты рекомендуют этот препарат для лечения болезней новорожденных.
Доступные методы лечения инфекций HSV и VZV
Ацикловир (Ациклогуанозин, Зовиракс, ACV)
Ацикловир является наиболее часто назначаемым противовирусным средством для лечения инфекций HSV новорожденных и младенцев.Он был доступен для клинического использования в течение почти трех десятилетий и продемонстрировал замечательную безопасность и эффективность против легких и тяжелых инфекций, вызванных HSV и VZV, как у здоровых пациентов, так и у пациентов с ослабленным иммунитетом, включая новорожденных.
Химия и механизм действия
Ацикловир – аналог дезоксигуанозина. После преимущественного поглощения инфицированными вирусом клетками ацикловир фосфорилируется кодируемой вирусом тимидинкиназой (ТК). Последующее ди- и трифосфорилирование катализируется ферментами клетки-хозяина.Ацикловиртрифосфат предотвращает синтез вирусной ДНК, как ингибируя вирусную ДНК-полимеразу, так и являясь терминатором цепи.
Спектр и устойчивость
Ацикловир наиболее активен против ВПГ; активность против VZV также значительна, но примерно в 10 раз меньше. Ацикловир считается препаратом выбора как при неонатальных инфекциях HSV, так и при VZV-инфекциях. Активность против ЦМВ низкая, поскольку ЦМВ не обладает активностью тимидинкиназы, а ДНК-полимераза ЦМВ слабо ингибируется ацикловиртрифосфатом.
Резистентность HSV и VZV к ацикловиру стала важной клинической проблемой среди пациентов с ослабленным иммунитетом, получающих длительную терапию [14]. Устойчивость вирусов к ацикловиру обычно является результатом мутаций в вирусном гене TK, хотя мутации в гене вирусной ДНК-полимеразы также встречаются редко. Резистентные изоляты могут вызывать тяжелые, прогрессирующие, изнурительные заболевания слизистой оболочки у взрослых и, в редких случаях, висцеральное распространение [15, 16]. Изоляты ВПГ, устойчивые к ацикловиру, также были зарегистрированы у здоровых хозяев, чаще всего у пациентов с часто рецидивирующими генитальными инфекциями, которые лечились хроническим ацикловиром [17].
Показания
Ацикловир эффективен для лечения инфекций, вызванных HSV и VZV, у иммунокомпетентных и иммунодефицитных хозяев, включая новорожденных. Для лечения неонатальных инфекций HSV рекомендуемая доза составляет 20 мг / кг / каждые 8 часов. Продолжительность терапии SEM-заболевания составляет 14 дней, в то время как для детей с ЦНС или диссеминированным заболеванием терапию следует продлить на 21 день.
Ацикловир для перорального применения – это экспериментальный подход к супрессивной терапии, который в настоящее время не одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов.
Фармакокинетика
После внутривенного введения доз от 2,5 до 15 мг / кг стабильные концентрации ацикловира колеблются от 6,7 до 20,6 мкг / мл. Ацикловир широко распространен; высокие концентрации достигаются в почках, легких, печени, сердце и кожных пузырьках; концентрации в спинномозговой жидкости (CSF) составляют около 50% от концентрации в плазме [18]. Ацикловир проникает через плаценту и накапливается в грудном молоке. Связывание с белками составляет от 9% до 33%, и менее 20% препарата метаболизируется до биологически неактивных метаболитов.Фармакокинетические данные для новорожденных при применении 20 мг / кг / доза отсутствуют.
При отсутствии нарушения функции почек период полувыведения ацикловира составляет от 2 до 3 часов у детей старшего возраста и взрослых и от 2,5 до 5 часов у новорожденных с нормальным клиренсом креатинина. Более 60% введенного препарата выводится с мочой [18]. Выведение продлевается у пациентов с нарушением функции почек; Период полувыведения составляет приблизительно 20 часов у лиц с терминальной стадией почечной недостаточности, что требует изменения дозы для пациентов с клиренсом креатинина менее 50 мл / мин / л.73 м 2 [19]. Ацикловир эффективно удаляется гемодиализом, но не постоянным амбулаторным перитонеальным диализом [20, 21].
Побочные эффекты
Ацикловир, как правило, является безопасным лекарством. Почечная дисфункция возникает в результате обструктивной нефропатии, вызванной образованием кристаллов ацикловира, осаждающихся в почечных канальцах. Иногда внутривенное введение ацикловира вызывает сыпь, потливость, тошноту, головную боль, гематурию и гипотонию. Высокие дозы внутривенного введения ацикловира (60 мг / кг / день) новорожденным были связаны с нейтропенией [22, 23].
Нейротоксичность может возникать у субъектов с нарушенной функцией почек, которые достигают высоких концентраций препарата в сыворотке [24]. Нейротоксичность проявляется в виде летаргии, спутанности сознания, галлюцинаций, тремора, миоклонуса, судорог, экстрапирамидных признаков и изменений состояния сознания, развивающихся в течение первых нескольких дней после начала терапии. Эти признаки и симптомы обычно проходят спонтанно в течение нескольких дней после прекращения приема ацикловира.
Хотя ацикловир обладает мутагенным действием при высоких концентрациях в некоторых анализах in vitro , он не обладает тератогенным действием на животных.Ограниченные данные о людях позволяют предположить, что использование ацикловира беременными женщинами не связано с врожденными дефектами или другими неблагоприятными исходами беременности.
Лекарственные взаимодействия
Вероятность почечной токсичности ацикловира увеличивается при приеме нефротоксических препаратов, таких как циклоспорин или амфотерицин B.
Терапия врожденной цитомегаловирусной инфекции
Цитомегаловирус (ЦМВ) обычно вызывает у людей серозную инфекцию во всем мире. 40% у подростков и приближается к 90% у взрослых с плохим социально-экономическим статусом [25, 26].Врожденная ЦМВ-инфекция – наиболее распространенная врожденная инфекция в развитых странах, обнаруживаемая примерно у 1% живорожденных младенцев в Соединенных Штатах [27]. Врожденные ЦМВ-инфекции чаще всего возникают при внутриутробной передаче, но, поскольку вирус распространяется с жидкостями организма, передача также может передаваться перинатально во время родов или постнатально через грудное молоко.
Из всех младенцев, рожденных с врожденной ЦМВ-инфекцией, примерно 7–10% имеют клинически очевидное заболевание при рождении [28].Клинические характеристики внутриутробной инфекции включают ограничение внутриутробного развития, гепатоспленомегалию, желтуху, тромбоцитопению, микроцефалию, перивентрикулярные кальцификации и хориоретинит. Согласно обзору Dollard, истинные показатели смертности трудно получить, и, как сообщается, они достигают 30% для младенцев с симптомами [29], но, скорее всего, в среднем составляют около 5–10% [30]. Смерть обычно происходит из-за проявлений инфекции, не связанных с ЦНС, таких как нарушение функции печени или кровотечение. По оценкам, 40–58% младенцев с симптоматической врожденной ЦМВ-инфекцией имеют необратимые последствия, в то время как младенцы, у которых нет симптомов при рождении, страдают необратимыми последствиями почти в 14% случаев [29].Сенсорно-невральная тугоухость (SNHL), умственная отсталость, судороги, задержка психомоторной и речевой активности, нарушение обучаемости, хориоретинит, атрофия зрительного нерва и дефекты зубных рядов являются наиболее частыми долгосрочными последствиями [31]. В отличие от внутриутробных инфекций, перинатально приобретенные ЦМВ-инфекции обычно не связаны с долгосрочными последствиями, хотя сообщалось об острых заболеваниях у недоношенных детей с очень низкой массой тела при рождении [32]. У доношенных детей перинатальные инфекции обычно протекают бессимптомно, но могут проявляться пневмонитом в течение первых нескольких месяцев жизни [33].
Врожденная ЦМВ-инфекция является следствием инфицирования матери и плода, причем большинство симптоматических врожденных случаев возникает из-за бессимптомной материнской инфекции. При материнской первичной инфекции, по-видимому, происходит нарушение плацентарного кровотока после инфицирования плацентарных вилок [34]. Патогенез вовлечения ЦНС в врожденную ЦМВ-инфекцию начинается с диссеминированного распространения виремии, включая эндотелиальные клетки головного мозга и эпителиальные клетки сосудистого сплетения.Из эндотелиальных клеток головного мозга вирус распространяется на смежные астроциты. Из сосудистого сплетения вирус затем перемещается к эпендимным поверхностям через спинномозговую жидкость (CSF). После инфицирования этих клеток вирус подвергается непрерывной репликации, что приводит к характерным внутриядерным тельцам включения и гибели клеток. Поскольку антитела вырабатываются в условиях непрерывной репликации вируса, также образуются иммунные комплексы, что приводит к дальнейшему иммуноопосредованному повреждению [31]. Хотя специфический патогенез SNHL, опосредованного CMV, не выяснен, гистология показала доказательства инфекции в клетках как улиткового, так и вестибулярного эндолабиринта [35].ЦМВ также был выделен из перилимфы улитки при вскрытии новорожденных с врожденной ЦМВ-инфекцией [36].
Недавние исследования лечения ганцикловиром врожденных ЦМВ-инфекций с поражением ЦНС были многообещающими. Введение ганцикловира в дозах 12 мг / кг / день, разделенных каждые 12 часов в течение 6 недель, улучшило исходы слуха у новорожденных с симптоматической врожденной ЦМВ-инфекцией с поражением ЦНС (о чем свидетельствуют микроцефалия, внутричерепные кальцификации, аномалии спинномозговой жидкости для возраста, хориоретинит и др.) / или нарушения слуха) [37].Первичной конечной точкой был улучшенный ответ, вызванный стволом мозга (BSER) между исходным уровнем и 6-месячным периодом наблюдения (или отсутствие ухудшения в течение 6-месячного периода наблюдения, если исходный BSER был нормальным). Что касается общего количества ушей, подлежащих оценке, 69% пациентов, получавших ганцикловир, достигли первичной конечной точки по сравнению с 39% в контрольной группе. Ни у одного пациента, получавшего ганцикловир, не было ухудшения слуха между исходным уровнем и 6 мес. У реципиентов ганцикловира также отмечалось более быстрое разрешение нарушений АЛТ, чем в контрольной группе, хотя вероятность развития нейтропении у них была значительно выше.Дополнительный анализ этого рандомизированного контролируемого исследования позволяет предположить, что ганцикловир может также уменьшать задержки в развитии нервной системы [38]. Улучшение смертности при терапии ганцикловиром пока не показано.
Лечение ЦМВ-инфекций
Ганцикловир (Цитовен)
Ганцикловир был первым противовирусным препаратом, доступным для терапии и профилактики инфекций, вызванных ЦМВ. Доказано, что это очень ценный препарат для пациентов с ослабленным иммунитетом, особенно для пациентов с рецептами трансплантации гемопоэтических стволовых клеток, которые страдают от значительной заболеваемости и смертности от ЦМВ-инфекций, а в последнее время – для детей с врожденной ЦМВ-инфекцией, хотя и не одобрено Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США. Администрация (FDA) в настоящее время.
Химия и механизм действия
Ганцикловир структурно похож на ацикловир, за исключением гидроксиметильной группы на его ациклической боковой цепи. Первоначальный этап фосфорилирования осуществляется pUL97, вирусной протеинкиназой. Затем клеточные киназы фосфорилируют агент еще два раза, чтобы преобразовать его в его трифосфатное производное, которое способно ингибировать ДНК-полимеразу ЦМВ, кодируемую UL97 , а также встраиваться в вирусную ДНК и обрывать ее.
Ганцикловир трифосфат – конкурентный ингибитор герпесвирусных ДНК-полимераз, приводящий к прекращению удлинения цепи ДНК [1, 20].
Спектр и устойчивость
Ганцикловир имеет сходную с ацикловиром активность против HSV-1, HSV-2 и VZV, но, в отличие от ацикловира, его наибольшая активность против CMV. Устойчивость изолятов ЦМВ обычно возникает в результате мутаций в гене UL97 [39]. Мутации в гене ДНК-полимеразы ЦМВ встречаются реже. Показания .Ганцикловир лицензирован по нескольким показаниям за пределами новорожденных. В нескольких обзорах резюмируются эти клинические исходы [2]. Для лечения новорожденных, врожденно инфицированных ЦМВ, было проведено контролируемое исследование [40]. Как отмечалось выше, по сравнению с отсутствием лечения терапия ганцикловиром предотвращала ухудшение слуха через два года, хотя примерно у двух третей пролеченных младенцев развилась нейтропения, часто требующая изменения дозы.
Фармакокинетика
Биодоступность ганцикловира при пероральном приеме низкая, при пероральном приеме всасывается менее 10% препарата [41, 42].Пероральный препарат ганцикловира больше не продается. Пиковые концентрации ганцикловира в сыворотке после введения 6 мг / кг (доза для новорожденных) внутривенно вводимого лекарственного средства колеблются от 8 до 11 мкг / мл с концентрациями, достаточными для подавления чувствительных штаммов ЦМВ в водянистой влаге, субретинальной жидкости, спинномозговой жидкости и ткани мозга [ 1]. Период полувыведения ганцикловира составляет от 2 до 3 часов, и большая часть препарата выводится в неизмененном виде с мочой. Фармакокинетика ганцикловира в популяции новорожденных аналогична таковой у взрослых [43, 44].Снижение дозы, пропорциональное степени снижения клиренса креатинина, необходимо лицам с нарушением функции почек. Дополнительная доза рекомендуется после диализа, поскольку она эффективно удаляется гемодиализом [45].
Побочные эффекты
Миелосупрессия – наиболее частое побочное действие ганцикловира; Дозозависимая нейтропения (менее 1000 лейкоцитов / мкл) является наиболее стойким гематологическим отклонением с частотой около 40% [42]. Нейтропения ограничивает дозу примерно в одном из семи курсов и исчезает после прекращения приема препарата.При пероральном приеме ганцикловира нейтропения возникает реже. Тромбоцитопения (менее 50 000 тромбоцитов / мкл) встречается примерно у 20%, а анемия – примерно у 2% реципиентов ганцикловира. От 2 до 5% реципиентов ганцикловира испытывают головную боль, спутанность сознания, изменение психического статуса, галлюцинации, кошмары, беспокойство, атаксию, тремор, судороги. лихорадка, сыпь и аномальные уровни сывороточных печеночных ферментов по отдельности или в некоторой комбинации.
Дозировка
Доза ганцикловира для лечения симптоматической врожденной ЦМВ-инфекции составляет 12 мг / кг / день внутривенно дважды в день в течение 6 недель.
Исследуемый препарат
Валганцикловир (Valcyte)
Валганцикловир был одобрен FDA в марте 2001 г. для лечения ЦМВ-ретинита. Поскольку он хорошо всасывается после перорального приема, он может представлять собой благоприятный вариант по сравнению с внутривенным введением ганцикловира для лечения врожденной ЦМВ-инфекции. В настоящее время он лицензирован для лечения ЦМВ-инфекций в отдельных популяциях трансплантатов и ЦМВ-ретинита у пациентов с ВИЧ / СПИДом.
Химия, механизм действия, спектр и устойчивость
Валганцикловир является пролекарством ганцикловира на основе эфира L-валина и, как таковой, имеет тот же механизм действия, противовирусный спектр и потенциал развития устойчивости, что и ганцикловир [1, 20] .
Показания
Валганцикловир имеет аналогичные показания к ганцикловиру. Однако, основываясь на опубликованных на сегодняшний день ограниченных контролируемых исследованиях, в настоящее время он одобрен для индукционной и поддерживающей терапии ЦМВ-ретинита и для отдельных популяций трансплантатов [46].В настоящее время исследуется возможность лечения врожденной ЦМВ-инфекции. В этом рандомизированном контролируемом исследовании, проводимом Группой по совместным антивирусным исследованиям (CASG) Национального института аллергии и инфекционных заболеваний (NIAID), в качестве основной конечной точки используется SNHL.
Фармакокинетика
Валганцикловир быстро превращается в ганцикловир со средним периодом полувыведения из плазмы около 30 минут [46]. Абсолютная биодоступность валганцикловира превышает 60% и фактически увеличивается примерно на 30% при одновременном приеме пищи [47].Площадь под кривой ганцикловира после перорального приема валганцикловира составляет от одной трети до половины площади, полученной после внутривенного введения ганцикловира. Пациентам с нарушением функции почек требуется снижение дозировки, примерно пропорциональное снижению клиренса креатинина.
Побочные эффекты
Наиболее частые побочные эффекты, связанные с терапией валганцикловиром у взрослых, включают диарею (41%), тошноту (30%), нейтропению (27%), анемию (26%) и головную боль (22%) [ 46].Лишь ограниченное число новорожденных получали терапию валганцикловиром. Единственным значимым открытием была нейтропения у 15% пациентов.
Дозировка
Доза валганцикловира зависит от возраста пациента и функции почек. В настоящее время препарат не разрешен к применению у новорожденных с врожденной ЦМВ-инфекцией.
Непроверенные и непроверенные методы лечения неонатальных инфекций HSV, VZV и врожденных CMV-инфекций
Следующие два препарата используются для лечения HSV, VZV и CMV инфекций у детей старшего возраста и взрослых.Данные об этих препаратах предоставляются, если у новорожденных возникает устойчивость к противовирусным препаратам при инфекциях ВПГ или ЦМВ. Ни один из препаратов не был оценен в рамках доказательных исследований на новорожденных, и оба связаны со значительной токсичностью. Кроме того, валацикловир может стать доступным для педиатрического применения, особенно для младенцев с инфекцией HSV, ограниченной кожей, глазами и ртом
Цидофовир (HPMPC, Vistide)
Цидофовир был впервые одобрен для использования в США для лечения СПИДа -ассоциированный ретинит, вызванный ЦМВ.Это остается основным показанием к применению этого противовирусного препарата.
Химия и механизм действия
Цидофовир – это новый аналог ациклических фосфонатных нуклеозидов с механизмом действия, аналогичным другим аналогам нуклеозидов. В отличие от ацикловира, вирусные ферменты не требуются для начального фосфорилирования, поскольку нативный цидофовир уже имеет одну присоединенную фосфатную группу. После дифосфорализации клеточными киназами цидофовир конкурентно ингибирует ДНК-полимеразу [48].Активная форма цидофовира проявляет в 25-50 раз большее сродство к вирусной ДНК-полимеразе по сравнению с клеточной ДНК-полимеразой.
Спектр и устойчивость
Цидофовир активен против ВПГ и ЦМВ, включая устойчивые к ацикловиру и фоскарнету изоляты ВПГ и мутанты ЦМВ, устойчивые к ганцикловиру и фоскарнету [49]. Он также активен in vitro против VZV, EBV, вируса герпеса человека-6, вируса герпеса человека-8, полиомавирусов, аденовируса и ВПЧ человека.
Было описано небольшое количество устойчивых к цидофовиру изолятов ЦМВ, которые также устойчивы к ганцикловиру на основе мутаций в гене ДНК-полимеразы [50].Сообщалось также о мутанте ЦМВ, устойчивом к ганцикловиру, фоскарнету и цидофовиру [51].
Показания
Цидофовир замедляет прогрессирование заболевания сетчатки у пациентов со СПИДом [52, 53]. Цидофовир также был полезен при лечении заболеваний, вызванных устойчивыми к ацикловиру изолятами ВПГ [54]. Были опубликованы отдельные сообщения об улучшении папилломатоза гортани после инъекции цидофовира в очаг поражения, но на основании этого ограниченного опыта невозможно сделать окончательные выводы об эффективности [55, 56].
Фармакокинетика
Только 2–26% цидофовира всасывается после перорального приема, поэтому его вводят внутривенно. Период полувыведения цидофовира из плазмы составляет 2,6 часа, но период полураспада активных внутриклеточных метаболитов цидофовира составляет от 17 до 48 часов [ 57]. Девяносто процентов препарата выводится с мочой, в основном с секрецией почечных канальцев [58]. Важно отметить, что препарат не проникает через гематоэнцефалический барьер и, следовательно, не должен использоваться для лечения инфекций ЦНС.
Побочные эффекты
Поскольку цидофовир концентрируется в почечных клетках в количествах в 100 раз больше, чем в других тканях, нефротоксичность является основным побочным эффектом, особенно если гидратация не поддерживается [57, 58].Проявления почечной токсичности включают протеинурию и глюкозурию. Агрессивная внутривенная прегидратация, одновременное введение пробенецида и избегание других нефротоксических агентов снижают вероятность токсичности. Цидофовир противопоказан пациентам с креатинином сыворотки> 1,5 мг / дл, расчетным клиренсом креатинина ≤ 55 мл / мин или белком мочи ≥ 100 мг / дл, и препарат следует отменить, если креатинин сыворотки повышается на ≥ 0,5 мг / дл выше исходного уровня. .
Дозировка
Цидофовир вводят внутривенно детям старшего возраста и взрослым в дозе 5 мг / кг один раз в неделю с пробенецидом.Пациенты с нарушением функции почек (расчетный клиренс креатинина <55 мл / мин) проходят лечение каждые 2 недели. Дозу следует уменьшить с 5 мг / кг до 3 мг / кг, если креатинин сыворотки повышается на> 0,3 мг / дл выше исходного уровня. Данных о дозировании цидофовира новорожденным нет.
Фоскарнет (PFA, Foscavir)
Фоскарнет – единственный противогерпетический препарат, не являющийся аналогом нуклеозидов. Это не препарат первой линии, но он полезен для лечения инфекций, вызванных устойчивыми вирусами герпеса.
Химия и механизм действия
Фоскарнет – неорганический аналог пирофосфата, который напрямую ингибирует ДНК-полимеразу, блокируя сайт связывания пирофосфата [20, 59].
Спектр и устойчивость
Фоскарнет ингибирует все известные герпесвирусы человека, включая большинство устойчивых к ганцикловиру изолятов ЦМВ и устойчивые к ацикловиру штаммы ВПГ и ВЗВ. Он также активен против ВИЧ. Устойчивость возникает в результате мутаций ДНК-полимеразы. Сообщалось о штаммах CMV, HSV и VZV с пониженной чувствительностью к фоскарнету [59, 60].
Показания
Фоскарнет так же эффективен, как и ганцикловир, для лечения угрожающего зрению хориоретинита, вызванного ЦМВ, у взрослых пациентов со СПИДом [61]. Из-за присущей ему активности против ВИЧ, он может даже обеспечить преимущество в выживаемости для пролеченных пациентов [62]. Рефрактерные случаи хориоретинита могут поддаваться лечению комбинацией фоскарнета и ганцикловира. Фоскарнет также эффективен при терапии ЦМВ-инфекций, вызванных ганцикловир-резистентными штаммами вируса [62]. Ограниченные данные также предполагают, что фоскарнет может быть полезным при назначении пациентам со СПИДом, у которых есть желудочно-кишечные и легочные инфекции, вызванные ЦМВ.
Инфекции, вызванные устойчивыми к ацикловиру штаммами HSV и VZV, успешно контролируются с помощью фоскарнета [63, 64].
Фармакокинетика
Только около 20% фоскарнета абсорбируется после перорального приема. Максимальная концентрация в сыворотке, достигаемая после внутривенного введения 60 мг / кг, составляет примерно 500 мкмоль / л [59]. Концентрация в спинномозговой жидкости составляет около двух третей от концентрации в сыворотке. Период полувыведения фоскарнета составляет около 48 часов, и 80% введенной дозы выводится в неизмененном виде с мочой.Необходимо снижение дозы пропорционально уменьшению клиренса креатинина. Гемодиализ эффективно устраняет фоскарнет, поэтому после диализа рекомендуется дополнительная доза [65]. Данных о применении фоскарнета новорожденным нет.
Побочные эффекты
Наиболее частыми побочными эффектами фоскарнета являются нефротоксичность и метаболические нарушения. Доказательства нефротоксичности включают азотемию, протеинурию, острый некроз канальцев, кристаллурию и интерстициальный нефрит.Концентрация креатинина в сыворотке увеличивается до 50% пациентов. К счастью, функция почек приходит в норму в течение 2–4 недель после прекращения терапии. Существующее ранее заболевание почек, одновременный прием других нефротоксических препаратов, обезвоживание, быстрое введение или непрерывное внутривенное вливание препарата являются факторами риска развития почечной дисфункции [66]. Метаболические нарушения, связанные с терапией фоскарнетом, включают гипо- и гиперкальциемию, а также гипо- и гиперфосфатемию [67]. Гипокальциемия может быть связана с парестезиями, тетанией, судорогами и аритмиями.Метаболические нарушения сводятся к минимуму, если вводить фоскарнет медленной инфузией. Симптомы со стороны ЦНС, связанные с терапией фоскарнетом, включают головную боль, тремор, раздражительность, судороги и галлюцинации. Сообщалось также о лихорадке, тошноте, рвоте, аномальных ферментах сыворотки крови, анемии, гранулоцитопении и генитальных изъязвлениях.
Лекарственные взаимодействия
Одновременное применение амфотерицина B, циклоспорина, гентамицина и других нефротоксических препаратов увеличивает вероятность нарушения функции почек.Одновременный прием пентамидина увеличивает риск гипокальциемии. Анемия и нейтропения чаще встречаются, когда пациенты также получают зидовудин.
Дозировка
Обычная доза фоскарнета при ЦМВ-инфекции составляет 180 мг / кг / день в три приема в течение 14–21 дней, после чего следует ежедневная поддерживающая доза от 90 до 120 мг / кг. Дозировка фоскарнета, используемого при инфекциях, вызванных устойчивыми к ацикловиру HSV и VZV, составляет 120 мг / кг / день в три приема.
Резюме
Несмотря на то, что в лечении врожденных ЦМВ и неонатальных инфекций ВПГ достигнут значительный прогресс, дальнейшие достижения являются обязательными.С появлением новых противовирусных препаратов, обладающих другим механизмом действия, появляется возможность для комбинированной терапии, если можно доказать, что лекарства безопасны.
Выражение признательности
Этот проект полностью или частично финансируется за счет федеральных средств Национального института аллергии и инфекционных заболеваний, Национальных институтов здравоохранения, Министерства здравоохранения и социальных служб, по контракту № N01-AI-30025.
Сноски
Заявление издателя: Это PDF-файл неотредактированной рукописи, принятой к публикации.В качестве услуги для наших клиентов мы предоставляем эту раннюю версию рукописи. Рукопись будет подвергнута копированию, верстке и рассмотрению полученного доказательства, прежде чем она будет опубликована в окончательной форме для цитирования. Обратите внимание, что во время производственного процесса могут быть обнаружены ошибки, которые могут повлиять на содержание, и все юридические оговорки, относящиеся к журналу, имеют отношение.
Список литературы
1. Кимберлин Д. Противовирусные агенты. В: Лонг С., Пикеринг Л., Пробер С., редакторы. Принципы и практика детских инфекционных болезней.3-е изд. Нью-Йорк: Эльзевир; 2008. С. 1470–1488. [Google Scholar] 2. Ра Б., Кимберлин Д. В., Уитли Р. Противовирусные препараты. В: Джером К., редактор. Лабораторная диагностика вирусных инфекций. 3-е изд. Нью-Йорк: Informa Healthcare; 2009. [Google Scholar] 3. Brown ZA, Wald A, Morrow RA, Selke S, Zeh J, Corey L. Влияние серологического статуса и кесарева сечения на скорость передачи вируса простого герпеса от матери к ребенку. ДЖАМА. 2003. 289 (2): 203–209. [PubMed] [Google Scholar] 4. Уитли Р.Дж. Вирус простого герпеса.В: Scheld MW, Whitley RJ, Marra CM, редакторы. Инфекции центральной нервной системы. 3-е изд. Филадельфия: Липпинкотт Уильямс и Уилкинс; 2004. С. 123–144. [Google Scholar] 5. Kimberlin DW, Lin CY, Jacobs RF, Powell DA, Frenkel LM, Gruber WC, et al. Естественная история инфекций, вызванных вирусом простого герпеса новорожденных, в эпоху ацикловира. Педиатрия. 2001. 108 (2): 223–229. [PubMed] [Google Scholar] 6. Kimberlin DW. Ведение энцефалита, вызванного вирусом простого герпеса, у взрослых и новорожденных: диагностика, прогноз и лечение.Герпес. 2007 июн; 14 (1): 11–16. [PubMed] [Google Scholar] 7. Хатто С., Арвин А., Джейкобс Р., Стил Р., Стагно С., Лайрин Р. и др. Внутриутробные инфекции, вызванные вирусом простого герпеса. Журнал педиатрии. 1987. 110 (1): 97–101. [PubMed] [Google Scholar] 8. Уитли Р.Дж. Инфекции, вызванные вирусом простого герпеса. В: Remington JS, Klein JO, редакторы. Инфекционные болезни плода и новорожденных. 3-е изд. Филадельфия: W.B. Компания Сондерс; 1990. С. 282–305. [Google Scholar] 9. Уитли Р.Дж., Кори Л., Арвин А., Лейкман Ф.Д., Сумая К.В., Райт П.Ф. и др.Изменение представления инфекции вируса простого герпеса у новорожденных. Журнал инфекционных болезней. 1988. 158 (1): 109–116. [PubMed] [Google Scholar] 10. Уитли Р.Дж., Ройзман Б. Вирусы простого герпеса. В: Ричман Д.Д., Уитли Р.Дж., Хайден Ф.Г., редакторы. Клиническая вирусология. 2-е изд. Вашингтон, округ Колумбия: ASM Press; 2004. С. 375–401. [Google Scholar] 11. Уитли Р., Арвин А., Пробер С., Берчетт С., Кори Л., Пауэлл Д. и др. Контролируемое испытание по сравнению видарабина с ацикловиром при неонатальной инфекции вирусом простого герпеса.Медицинский журнал Новой Англии. 1991. 324 (7): 444–449. [PubMed] [Google Scholar] 12. Kimberlin DW, Lin CY, Jacobs RF, Powell DA, Corey L, Gruber WC, et al. Безопасность и эффективность высоких доз внутривенного ацикловира при лечении инфекций, вызванных вирусом простого герпеса у новорожденных. Педиатрия. 2001. 108 (2): 230–238. [PubMed] [Google Scholar] 13. Кимберлин Д., Уитли Р., Ван В., Пауэлл Д., Сторч Г., Ахмед А. и др. Влияние перорального подавления ацикловира на исходы развития нервной системы и рецидивы кожи после неонатальной болезни, вызванной вирусом простого герпеса.NEJM. 2011 В печати. [Google Scholar] 14. Englund JA, Zimmerman ME, Swierkosz EU, Goodman JL, Scholl D, Balfour HH. Вирус простого герпеса устойчив к ацикловиру. Исследование в центре третичной медицинской помощи. Ann Intern Med. 1990; 112: 416–422. [PubMed] [Google Scholar] 15. Полевой АК, Бирон К.К. Возвращение к «концу невинности»: устойчивость герпесвирусов к противовирусным препаратам. Clin Microbiol Rev.1994, январь; 7 (1): 1–13. [Бесплатная статья PMC] [PubMed] [Google Scholar] 16. Лайалл Э.Г., Огилви М.М., Смит Н.М., Бернс С. Устойчивость к ацикловиру ветряной оспы и ВИЧ-инфекция.Arch Dis Child. 1994 Февраль; 70 (2): 133–135. [Бесплатная статья PMC] [PubMed] [Google Scholar] 17. Морфин Ф, Тувено Д. Устойчивость вируса простого герпеса к противовирусным препаратам. J Clin Virol. 2003 Янв; 26 (1): 29–37. [PubMed] [Google Scholar] 18. Wagstaff AJ, Faulds D, Goa Kl. Ацикловир. Переоценка его противовирусной активности, фармакокинетических свойств и терапевтической эффективности. Наркотики. 1994; 47: 153–205. [PubMed] [Google Scholar] 19. Ласкин О.Л., Лонгстрет Дж. А., Велтон А., Красный Х. С., Кини Р. Э., Рокко Л. и др. Влияние почечной недостаточности на фармакокинетику ацикловира.Am J Med. 20 июля 1982 г.; 73 (1A): 197–201. [PubMed] [Google Scholar] 20. Инь М., Браст Дж., Тиеу Х., Хаммер С. Антигепатитные и противодыхательные вирусные агенты. В: Ричман Д., Уитли Р., Хайден Ф., редакторы. Клиническая вирусология. Вашингтон, округ Колумбия: ASM Press; 2009. С. 217–264. [Google Scholar] 21. Красный ХК, Ляо С.Х., де Миранда П., Ласкин О.Л., Велтон А., Литман П.С. Влияние гемодиализа на фармакокинетику ацикловира у пациентов с хронической почечной недостаточностью. Am J Med. 20 июля 1982 г.; 73 (1A): 202–204. [PubMed] [Google Scholar] 22.Кимберлин Д., Пауэлл Д., Грубер В., Диаз П., Арвин А., Кумар М. и др. Назначение пероральной супрессивной терапии ацикловиром после неонатальной болезни, вызванной вирусом простого герпеса, с поражением кожи, глаз и рта: результаты тирала фазы I / II. Pediatr Infect Dis J. 1996; 15: 247–254. [PubMed] [Google Scholar] 23. Kimberlin DW, Lin CY, Jacobs RF, Powell DA, Corey L, Gruber WC, et al. Безопасность и эффективность высоких доз внутривенного ацикловира при лечении инфекций, вызванных вирусом простого герпеса у новорожденных. Педиатрия.2001 август; 108 (2): 230–238. [PubMed] [Google Scholar] 24. Реванкар С.Г., Эпплгейт А.Л., Марковиц Д.М. Делирий, связанный с лечением ацикловиром у пациента с почечной недостаточностью. Clin Infect Dis. 1995 августа; 21 (2): 435–436. [PubMed] [Google Scholar] 25. Гриффитс П.Д., Эмери В.К. Цитомегаловирус. В: Ричман Д.Д., Уитли Р.Дж., Хайден Ф.Г., редакторы. Клиническая вирусология. 2-е изд. Вашингтон, округ Колумбия: ASM Press; 2002. С. 433–461. [Google Scholar] 26. Старас С.А., Доллард СК, Рэдфорд К.В., Фландрия В.Д., Пасс РФ, Кэннон М.Дж. Распространенность цитомегаловирусной инфекции в США: 1988–1994 гг.Clin Infect Dis. 2006 г., 1 ноября; 43 (9): 1143–1151. [PubMed] [Google Scholar] 27. Demmler GJ. Американское общество инфекционных болезней и Центры по контролю за заболеваниями. Резюме семинара по надзору за врожденными цитомегаловирусными заболеваниями. Обзоры инфекционных болезней. 1991. 13 (2): 315–329. [PubMed] [Google Scholar] 28. Conboy TJ, Pass RF, Stagno S, Alford CA, Myers GJ, Britt WJ и др. Ранние клинические проявления и интеллектуальный исход у детей с симптоматической врожденной цитомегаловирусной инфекцией.Журнал педиатрии. 1987. 111 (3): 343–348. [PubMed] [Google Scholar] 29. Доллард СК, Гроссе С.Д., Росс Д.С. Новые оценки распространенности неврологических и сенсорных последствий и смертности, связанных с врожденной цитомегаловирусной инфекцией. Rev Med Virol. 1 июня 2007 г .; [PubMed] [Google Scholar] 30. Росс С.А., Боппана С.Б. Врожденная цитомегаловирусная инфекция: исход и диагноз. Semin Pediatr Infect Dis. 2005 Янв; 16 (1): 44–49. [PubMed] [Google Scholar] 31. Гриффитс PD, Маклафлин JE. Цитомегаловирус.В: Scheld WM, Whitley RJ, Marra CM, редакторы. Инфекции центральной нервной системы. Филадельфия: Липпинкотт Уильямс и Уилкинс; 2004. С. 159–173. [Google Scholar] 32. Машманн Дж., Хампрехт К., Дитц К., Ян Дж., Шпеер С.П. Цитомегаловирусная инфекция младенцев с крайне низкой массой тела при рождении через грудное молоко. Клинические инфекционные болезни. 2001; 33 (12): 1998–2003. [PubMed] [Google Scholar] 33. Brasfield DM, Stagno S, Whitley RJ, Cloud G, Cassell G, Tiller RE. Детский пневмонит, связанный с цитомегаловирусом, хламидиозом, пневмоцистом и уреаплазмой.Педиатрия. 1987. 79: 76–83. [PubMed] [Google Scholar] 34. Перейра Л., Майджи Э. Цитомегаловирусная инфекция в плаценте человека: материнский иммунитет и рецепторы, регулируемые развитием трофобластов, сходятся. Актуальные темы микробиологии и иммунологии. 2008. 325: 383–395. [PubMed] [Google Scholar] 35. Штраус М. Цитомегаловирусный лабиринтит человека. Am J Otolaryngol. Сентябрь – октябрь 1990 г., 11 (5): 292–298. [PubMed] [Google Scholar] 36. Дэвис Л.Е., Джонссон Л.Г., Корнфельд М. Цитомегаловирусный лабиринтит у младенцев: морфологические, вирусологические и иммунофлуоресцентные исследования.J Neuropathol Exp Neurol. 1981, январь; 40 (1): 9–19. [PubMed] [Google Scholar] 37. Kimberlin DW, Lin CY, Sanchez PJ, Demmler GJ, Dankner W, Shelton M и др. Влияние терапии ганцикловиром на слух при симптоматическом врожденном цитомегаловирусном заболевании с поражением центральной нервной системы: рандомизированное контролируемое исследование. Журнал педиатрии. 2003. 143 (1): 16–25. [PubMed] [Google Scholar] 38. Оливер С., Клауд Дж., Санчес П., Деммлер Дж., Данкнер В., Шелтон М. и др. Влияние терапии ганцикловиром (GCV) на исходы нервного развития при симптоматических врожденных цитомегаловирусных (CMV) инфекциях с поражением центральной нервной системы (ЦНС): рандомизированное контролируемое исследование.Ежегодное собрание Общества педиатрических исследований (SPR); 2006 29 апреля; Сан-Франциско, Калифорния. 2006. с. Реферат № 752908. [Google Scholar] 39. Маркхам А., Фолдс Д. Ганцикловир: обновление его терапевтического использования при цитомегаловирусной инфекции. Наркотики. 1994; 48: 455. [PubMed] [Google Scholar] 40. Kimberlin DW, Lin C-Y, Sanchez PJ, Demmler GJ, Dankner W, Shelton MD, et al. Влияние ганцикловира на слух при симптоматическом врожденном цитомегаловирусном заболевании с поражением центральной нервной системы: рандомизированное контролируемое исследование.J Pediatr. 2003. 143: 16–25. [PubMed] [Google Scholar] 41. Редди В., Хао Ю., Липтон Дж., Мехарчанд Дж., Минден М., Мацзулли Т. и др. Ведение реципиентов аллогенного трансплантата костного мозга с риском цитомегаловирусной болезни с использованием контрольной бронхоскопии и длительной упреждающей терапии ганцикловиром. J Clin Virol. 1999, август; 13 (3): 149–159. [PubMed] [Google Scholar] 42. Jacobson MA, Gambertoglio JG, Aweeka FT, Causey DM, Portale AA. Гипокальциемия, вызванная фоскарнетом, и влияние фоскарнета на метаболизм кальция.J Clin Endocrinol Metab. 1991 Май; 72 (5): 1130–1135. [PubMed] [Google Scholar] 43. Френкель Л.М., Каппарелли Е.В., Данкнер В.М., Сюй Дж., Смит И.Л., Баллоу А. и др. Ганцикловир для приема внутрь у детей: фармакокинетика, безопасность, переносимость и противовирусное действие. Группа педиатрических клинических испытаний СПИДа. Журнал инфекционных болезней. 2000 декабрь; 182 (6): 1616–1624. [PubMed] [Google Scholar] 44. Транг Дж. М., Кидд Л., Грубер В., Сторч Дж., Деммлер Дж., Джейкобс Р. и др. Линейная фармакокинетика однократной дозы ганцикловира у новорожденных с врожденными цитомегаловирусными инфекциями.Clin Pharmacol Ther. 1993; 53: 15–21. [PubMed] [Google Scholar] 45. Свон С.К., Мунар М.Ю., Виггер М.А., Беннетт В.М. Фармакокинетика ганцикловира у пациента, находящегося на гемодиализе. Am J Kidney Dis. 1991, январь; 17 (1): 69–72. [PubMed] [Google Scholar] 46. Cocohoba JM, McNicholl IR. Валганцикловир: прогресс в лечении цитомегаловирусов. Энн Фармакотер. 2002 июн; 36 (6): 1075–1079. [PubMed] [Google Scholar] 47. Юнг Д., Дорр А. Фармакокинетика однократной дозы валганцикловира у ВИЧ- и ЦМВ-серопозитивных субъектов.J Clin Pharmacol. 1999, август; 39 (8): 800–804. [PubMed] [Google Scholar] 48. Хо Х.Т., Вудс К.Л., Бронсон Дж. Дж., Де Бок Х., Мартин Дж. К., Хичкок МД. Внутриклеточный метаболизм антигерпетических средств -1- {3-гидрокси-2- (фосфонилметокси) пропил} цитозин. Mol Pharmacol. 1992; 41: 197–202. [PubMed] [Google Scholar] 49. Сафрин С, Черрингтон Дж, Джаффе Х.С. Клиническое использование цидофовира. Rev Med Virol. 1997 сентябрь; 7 (3): 145–156. [PubMed] [Google Scholar] 50. Lurain N, Spafford LE, Thompson KD. Мутация в открытой рамке считывания UL97 штаммов цитомегаловируса человека, устойчивых к ганцикловиру.Журнал вирусологии. 1994b; 68: 4427–4431. [Бесплатная статья PMC] [PubMed] [Google Scholar] 51. Черрингтон Дж. М., Майнер Р., Аллен С. Дж. У. и др. Сенситивы клинических изолятов цитомегаловируса человека (HCMV) к цидофовиру. Восьмая международная конференция по противовирусным исследованиям; 1995 г. 23–28 апреля; Санта-Фе, Нью-Мексико. 1995. [Google Scholar] 52. Исследования глазных осложнений Группы исследований СПИДа в сотрудничестве с Группой клинических испытаний СПИДа. Цидофовир (HPMPC) для лечения цитомегаловирусного ретинита у пациентов со СПИДом: исследование периферического цитомегаловирусного ретинита HPMPC.Ann Intern Med. 1997. 126: 264–274. [PubMed] [Google Scholar] 53. Lalezari JP, Staagg RJ, Kuppermann BD, Holland GN, Kramer F, Ives DV, et al. Внутривенное введение цидофовира при периферическом цитомегаловирусном ретините у пациентов со СПИДом: рандомизированное контролируемое исследование. Ann Intern Med. 1997. 126: 257–263. [PubMed] [Google Scholar] 54. Лалезари Дж. П., Дрю В. Л., Глутцер Э., Майнер Д., Сафрин С., Оуэн В. Ф., младший и др. Лечение внутривенным (S) -1- [3-гидрокси-2- (фосфонилметокси) пропил) -цитозином ацикловир-резистентной кожно-слизистой инфекции вирусом простого герпеса у пациента со СПИДом.Журнал инфекционных болезней. 1994; 170: 570–572. [PubMed] [Google Scholar] 55. Кимберлин DW, Малис DJ. Рецидивирующий респираторный папилломатоз с юношеским началом: возможности успешной противовирусной терапии. Antiviral Res. 2000 Февраль; 45 (2): 83–93. [PubMed] [Google Scholar] 56. Прански С.М., Магит А.Е., Кернс Д.Б., Канг Д.Р., Дункан Н.О. Цидофовир внутриочаговый при рецидивирующем респираторном папилломатозе у детей. Arch Otolaryngol Head Neck Surg. 1999 Октябрь; 125 (10): 1143–1148. [PubMed] [Google Scholar] 57. Канди К.С., Петти Б.Г., Флаэрти Дж., Фишер П.Е., Полис М.А., Ваксман М. и др.Клиническая фармакокинетика цидофовира у пациентов, инфицированных вирусом иммунодефицита человека. Противомикробные агенты Chemother. 1995; 39: 1247–1252. [Бесплатная статья PMC] [PubMed] [Google Scholar] 58. Лалезари Дж. П., Дрю В. Л., Глутцер Э., Джеймс С., Майнер Д., Флаэрти Дж. И др. (S) -1 {3-гидрокси-2- (фосфонилметокси) пропил} цитозин (цидофовиир): результаты исследования фазы I / II нового противовирусного аналога нуцелотида. Журнал инфекционных болезней. 1995; 171: 788–796. [PubMed] [Google Scholar] 59. Wagstaff AJ, Bryson HM.Фоскарнет: переоценка его противовирусной активности, фармакокинетических свойств и терапевтического использования у пациентов с ослабленным иммунитетом и вирусной инфекцией. Наркотики. 1994. 48: 199–226. [PubMed] [Google Scholar] 60. Сафрин С., Кеммерли С., Плоткин Б., Смит Т., Вайсбах Н., Де Веранес Д. и др. Инфекция, вызванная устойчивым к фоскарнету вирусом простого герпеса, у больных СПИДом. Журнал инфекционных болезней. 1994; 169: 193–196. [PubMed] [Google Scholar] 61. Снок Р., Андрей Г., Джерард М., Сильверман А., Хеддерман А., Бальзарини Дж. И др.Успешное лечение прогрессирующей кожно-слизистой инфекции, вызванной устойчивым к ацикловиру и фоскарнету вирусом простого герпеса, с помощью (S) -1- (3-гидрокси-2-фосфонилметоксипропил) цитозина (HPMPC) Clin Infect Dis. 1994 Апрель; 18 (4): 570–578. [PubMed] [Google Scholar] 62. Якобсон М.А., Дрю В.Л., Файнберг Дж., О’Доннелл Дж. Дж., Уитмор П.В., Майнер Р.Д. и др. Терапия фоскарнетом при ганцикловиррезистентном цитомегаловирусном ретините у больных СПИДом. Журнал инфекционных болезней. 1991; 163: 1348–1351. [PubMed] [Google Scholar] 63.Сафрин С., Бергер Т.Г., Гилсон И. Терапия фоскарнетом у пяти пациентов со СПИДом и инфекцией вируса ветряной оспы, устойчивой к ацикловиру. Ann Intern Med. 1991; 115: 19–21. [PubMed] [Google Scholar] 64. Исследования глазных осложнений исследовательской группы СПИДа. Смертность у пациентов с синдромом приобретенного иммунодефицита, получавших фоскарнет или ганцикловир от цитомегаловируса ретинита. N Engl J Med. 1992; 326: 213–220. [PubMed] [Google Scholar] 65. Сафрин С., Крампакер С., Чатис П., Дэвис Р., Хафнер Р., Раш Дж. И др.Контролируемое исследование по сравнению фоскарнета и видарабина при лечении ацикловир-резистентного кожно-слизистого простого герпеса при синдроме приобретенного иммунодефицита. N Engl J Med. 1991; 325: 551–555. [PubMed] [Google Scholar] 66. МакГрегор Р. Р., Грациани А. Л., Вайс Р., Грюнвальд Дж. Э., Гамбертольо Дж. Г.. Успешная терапия фоскарнетом при цитомегаловирусном ретините у пациента со СПИДом, находящегося на гемодиализе: обоснование эмпирического дозирования и мониторинга уровня в плазме. Журнал инфекционных болезней. 1991 Октябрь; 164 (4): 785–787.[PubMed] [Google Scholar] 67. Дерай Дж., Мартинес Ф., Катлама С., Левальтье Б., Бофилс Н., Данис М. и др. Нефротоксичность фоскарнета: механизм, частота возникновения и профилактика. Am J Nephrol. 1989. 9 (4): 316–321. [PubMed] [Google Scholar]Использование противовирусных препаратов в неонатальном периоде
Clin Perinatol. Авторская рукопись; доступно в PMC 1 марта 2013 г.
Опубликован в окончательной отредактированной форме как:
PMCID: PMC32
NIHMSID: NIHMS351802
Richard J.Whitley
Заслуженный профессор, стипендиат Лоеба в области педиатрии, профессор педиатрии, микробиологии, медицины и нейрохирургии, Университет Алабамы в Бирмингеме, Бирмингем, AL
Ричард Дж. Уитли, заслуженный профессор, стипендиат Лоеба в педиатрии, профессор педиатрии, Микробиология, медицина и нейрохирургия, Университет Алабамы в Бирмингеме, Бирмингем, Алабама;
Окончательная отредактированная версия этой статьи издателем доступна в Clin Perinatol. См. Другие статьи в PMC, в которых цитируется опубликованная статья.Введение
Парентеральная терапия вирусных инфекций новорожденных и младенцев стала реальностью с появлением в начале 1980-х годов видарабина (аденин арабинозида) для лечения инфекций, вызванных вирусом простого герпеса (ВПГ) новорожденных. С тех пор ацикловир стал препаратом выбора для лечения неонатальных инфекций HSV, а также множества других герпесвирусных инфекций. Аналогичным образом было установлено, что ганцикловир полезен для лечения врожденных цитомегаловирусных (ЦМВ) инфекций, поражающих центральную нервную систему (ЦНС).В этой главе будут рассмотрены уроки, извлеченные из лечения неонатального ВПГ и врожденных ЦМВ-инфекций в связи с применением ацикловира и ганцикловира. Хотя естественная история этих заболеваний рассматривается в другом месте в этом тексте, краткое изложение будет предшествовать подробному обсуждению имеющихся установленных и альтернативных методов лечения. Отсылаем читателя к более обширным обзорам противовирусной терапии у детей и взрослых [1, 2].
Терапия инфекций, вызванных вирусом простого герпеса
Неонатальные инфекции ВПГ встречаются примерно у 1 из 3200 родов в США [3], и примерно у двух третей из них развивается какая-либо форма заболевания ЦНС [4].Большинство случаев вызвано ВПГ-2 [5]. Риск передачи увеличивается при первичной материнской инфекции в третьем триместре, составляя 30–50%, и может быть снижен путем кесарева сечения, если HSV был изолирован из шейки матки или наружных половых органов незадолго до родов [3]. Согласно обзору Кимберлина, 85% случаев неонатальной передачи вируса простого герпеса возникают в результате послеродовой передачи, в то время как 10% происходят в результате послеродовой передачи и только 5% связаны с передачей внутриутробно [6].
Младенцы с внутриутробной инфекцией ВПГ характеризуются триадой кожных проявлений (активные поражения, рубцы), неврологических признаков (микроцефалия, гидранэнцефалия) и глазных патологий (хориоретинит, микрофтальмия), присутствующих при рождении.Было обнаружено, что внутриутробная инфекция ВПГ возникает как при первичной, так и при рецидивирующей материнской инфекции ВПГ [7], хотя риск повторной инфекции меньше.
Инфекция HSV, приобретенная в послеродовом или послеродовом периоде, может быть классифицирована как заболевание кожи, глаз и / или рта (SEM), заболевание ЦНС или диссеминированное заболевание. По определению, болезнь SEM не затрагивает ЦНС. Распространенное заболевание может поражать ЦНС (75% случаев) вместе с множеством других систем органов, включая печень, надпочечники, желудочно-кишечный тракт, кожу, глаза или рот [8].Заболевание ЦНС также может иметь компонент вовлечения SEM, но не затрагивает другие системы органов. Из всех младенцев с неонатальной инфекцией ВПГ около 33% имеют заболевание ЦНС, а около 25% имеют диссеминированное заболевание [9]. Таким образом, около 50% младенцев с неонатальной инфекцией ВПГ имеют заболевание ЦНС.
Патогенез поражения ЦНС при неонатальных инфекциях ВПГ различается в зависимости от того, является ли инфекция диссеминированной. Энцефалит, связанный с диссеминацией, происходит из-за гематогенного распространения, тогда как изолированный энцефалит или энцефалит, связанный только с вовлечением SEM, вероятно, возникает из-за ретроградного внутринейронального транспорта HSV [4].Это различие соответствует клиническим проявлениям диссеминированного заболевания по сравнению с заболеванием ЦНС в том смысле, что распространение диссеминированного заболевания через кровь проявляется раньше (в среднем от 9 до 11 дней жизни) и вызывает более диффузное поражение мозга с множественными участками геморрагического некроза, в то время как заболевание ЦНС происходящий через более медленный аксональный транспорт, проявляется позже (примерно от 16 до 17 дней жизни) и обычно вызывает более очаговое поражение ЦНС [10].
Ранняя эра противовирусной терапии неонатальной инфекции ВПГ была отмечена повышением смертности при внутривенном введении видарабина, а также при внутривенном введении стандартной дозы (SD) ацикловира (30 мг / кг / день в 3 приема).Годовая смертность от диссеминированного заболевания снизилась с 85% при отсутствии терапии до 50% при использовании видарабина и 61% при использовании ацикловира SD, в то время как смертность за 1 год от заболевания ЦНС снизилась с 35% без лечения до 14% как для видарабина, так и для ацикловира SD. [11]. Совсем недавно было показано, что ацикловир в высоких дозах (HD) дополнительно улучшает эти показатели смертности. При внутривенном введении ацикловира на HD (60 мг / кг / день в 3 приема в течение 21 дня) уровень смертности в течение одного года составил 29% и 4% от диссеминированных заболеваний и заболеваний ЦНС, соответственно [12].В то время как HD ацикловир снижал заболеваемость младенцев с диссеминированным заболеванием (83% выживших имели нормальные исходы нервного развития), у младенцев с заболеванием ЦНС не наблюдалось значительного улучшения заболеваемости (31% выживших имели нормальные исходы неврологического развития).
Младенцы с поражением SEM имеют наилучший прогноз и, как указано ниже, им требуется всего 14 дней внутривенной терапии ацикловиром на HD.
В последнее время супрессивная терапия ацикловиром для младенцев с ЦНС после завершения внутривенного лечения значительно улучшила неврологический исход, измеренный по шкале Bailey Developmental Scores [13].Этот режим привел к тому, что примерно 60% (по сравнению с 31%) детей с заболеванием ЦНС развились нормально или с легкими нарушениями. Лечение проводилось в дозе 300 / мг / м 2 за три раза в день в течение шести месяцев.
Терапия неонатальных инфекций, вызванных вирусом ветряной оспы
У женщин, перенесших первичную инфекцию вируса ветряной оспы (VZV) в течение 48 часов после родов, рождаются дети с риском развития ветряной оспы в течение первых трех недель жизни. Новорожденным этим женщинам традиционно вводят иммуноглобулин против опоясывающего лишая (ZIG), чтобы предотвратить заболевание.Однако при спорадической нехватке ZIG у некоторых новорожденных могут развиться неонатальные заболевания. Никакие контролируемые клинические испытания не оценивали терапию этого заболевания ацикловиром; однако специалисты рекомендуют этот препарат для лечения болезней новорожденных.
Доступные методы лечения инфекций HSV и VZV
Ацикловир (Ациклогуанозин, Зовиракс, ACV)
Ацикловир является наиболее часто назначаемым противовирусным средством для лечения инфекций HSV новорожденных и младенцев.Он был доступен для клинического использования в течение почти трех десятилетий и продемонстрировал замечательную безопасность и эффективность против легких и тяжелых инфекций, вызванных HSV и VZV, как у здоровых пациентов, так и у пациентов с ослабленным иммунитетом, включая новорожденных.
Химия и механизм действия
Ацикловир – аналог дезоксигуанозина. После преимущественного поглощения инфицированными вирусом клетками ацикловир фосфорилируется кодируемой вирусом тимидинкиназой (ТК). Последующее ди- и трифосфорилирование катализируется ферментами клетки-хозяина.Ацикловиртрифосфат предотвращает синтез вирусной ДНК, как ингибируя вирусную ДНК-полимеразу, так и являясь терминатором цепи.
Спектр и устойчивость
Ацикловир наиболее активен против ВПГ; активность против VZV также значительна, но примерно в 10 раз меньше. Ацикловир считается препаратом выбора как при неонатальных инфекциях HSV, так и при VZV-инфекциях. Активность против ЦМВ низкая, поскольку ЦМВ не обладает активностью тимидинкиназы, а ДНК-полимераза ЦМВ слабо ингибируется ацикловиртрифосфатом.
Резистентность HSV и VZV к ацикловиру стала важной клинической проблемой среди пациентов с ослабленным иммунитетом, получающих длительную терапию [14]. Устойчивость вирусов к ацикловиру обычно является результатом мутаций в вирусном гене TK, хотя мутации в гене вирусной ДНК-полимеразы также встречаются редко. Резистентные изоляты могут вызывать тяжелые, прогрессирующие, изнурительные заболевания слизистой оболочки у взрослых и, в редких случаях, висцеральное распространение [15, 16]. Изоляты ВПГ, устойчивые к ацикловиру, также были зарегистрированы у здоровых хозяев, чаще всего у пациентов с часто рецидивирующими генитальными инфекциями, которые лечились хроническим ацикловиром [17].
Показания
Ацикловир эффективен для лечения инфекций, вызванных HSV и VZV, у иммунокомпетентных и иммунодефицитных хозяев, включая новорожденных. Для лечения неонатальных инфекций HSV рекомендуемая доза составляет 20 мг / кг / каждые 8 часов. Продолжительность терапии SEM-заболевания составляет 14 дней, в то время как для детей с ЦНС или диссеминированным заболеванием терапию следует продлить на 21 день.
Ацикловир для перорального применения – это экспериментальный подход к супрессивной терапии, который в настоящее время не одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов.
Фармакокинетика
После внутривенного введения доз от 2,5 до 15 мг / кг стабильные концентрации ацикловира колеблются от 6,7 до 20,6 мкг / мл. Ацикловир широко распространен; высокие концентрации достигаются в почках, легких, печени, сердце и кожных пузырьках; концентрации в спинномозговой жидкости (CSF) составляют около 50% от концентрации в плазме [18]. Ацикловир проникает через плаценту и накапливается в грудном молоке. Связывание с белками составляет от 9% до 33%, и менее 20% препарата метаболизируется до биологически неактивных метаболитов.Фармакокинетические данные для новорожденных при применении 20 мг / кг / доза отсутствуют.
При отсутствии нарушения функции почек период полувыведения ацикловира составляет от 2 до 3 часов у детей старшего возраста и взрослых и от 2,5 до 5 часов у новорожденных с нормальным клиренсом креатинина. Более 60% введенного препарата выводится с мочой [18]. Выведение продлевается у пациентов с нарушением функции почек; Период полувыведения составляет приблизительно 20 часов у лиц с терминальной стадией почечной недостаточности, что требует изменения дозы для пациентов с клиренсом креатинина менее 50 мл / мин / л.73 м 2 [19]. Ацикловир эффективно удаляется гемодиализом, но не постоянным амбулаторным перитонеальным диализом [20, 21].
Побочные эффекты
Ацикловир, как правило, является безопасным лекарством. Почечная дисфункция возникает в результате обструктивной нефропатии, вызванной образованием кристаллов ацикловира, осаждающихся в почечных канальцах. Иногда внутривенное введение ацикловира вызывает сыпь, потливость, тошноту, головную боль, гематурию и гипотонию. Высокие дозы внутривенного введения ацикловира (60 мг / кг / день) новорожденным были связаны с нейтропенией [22, 23].
Нейротоксичность может возникать у субъектов с нарушенной функцией почек, которые достигают высоких концентраций препарата в сыворотке [24]. Нейротоксичность проявляется в виде летаргии, спутанности сознания, галлюцинаций, тремора, миоклонуса, судорог, экстрапирамидных признаков и изменений состояния сознания, развивающихся в течение первых нескольких дней после начала терапии. Эти признаки и симптомы обычно проходят спонтанно в течение нескольких дней после прекращения приема ацикловира.
Хотя ацикловир обладает мутагенным действием при высоких концентрациях в некоторых анализах in vitro , он не обладает тератогенным действием на животных.Ограниченные данные о людях позволяют предположить, что использование ацикловира беременными женщинами не связано с врожденными дефектами или другими неблагоприятными исходами беременности.
Лекарственные взаимодействия
Вероятность почечной токсичности ацикловира увеличивается при приеме нефротоксических препаратов, таких как циклоспорин или амфотерицин B.
Терапия врожденной цитомегаловирусной инфекции
Цитомегаловирус (ЦМВ) обычно вызывает у людей серозную инфекцию во всем мире. 40% у подростков и приближается к 90% у взрослых с плохим социально-экономическим статусом [25, 26].Врожденная ЦМВ-инфекция – наиболее распространенная врожденная инфекция в развитых странах, обнаруживаемая примерно у 1% живорожденных младенцев в Соединенных Штатах [27]. Врожденные ЦМВ-инфекции чаще всего возникают при внутриутробной передаче, но, поскольку вирус распространяется с жидкостями организма, передача также может передаваться перинатально во время родов или постнатально через грудное молоко.
Из всех младенцев, рожденных с врожденной ЦМВ-инфекцией, примерно 7–10% имеют клинически очевидное заболевание при рождении [28].Клинические характеристики внутриутробной инфекции включают ограничение внутриутробного развития, гепатоспленомегалию, желтуху, тромбоцитопению, микроцефалию, перивентрикулярные кальцификации и хориоретинит. Согласно обзору Dollard, истинные показатели смертности трудно получить, и, как сообщается, они достигают 30% для младенцев с симптомами [29], но, скорее всего, в среднем составляют около 5–10% [30]. Смерть обычно происходит из-за проявлений инфекции, не связанных с ЦНС, таких как нарушение функции печени или кровотечение. По оценкам, 40–58% младенцев с симптоматической врожденной ЦМВ-инфекцией имеют необратимые последствия, в то время как младенцы, у которых нет симптомов при рождении, страдают необратимыми последствиями почти в 14% случаев [29].Сенсорно-невральная тугоухость (SNHL), умственная отсталость, судороги, задержка психомоторной и речевой активности, нарушение обучаемости, хориоретинит, атрофия зрительного нерва и дефекты зубных рядов являются наиболее частыми долгосрочными последствиями [31]. В отличие от внутриутробных инфекций, перинатально приобретенные ЦМВ-инфекции обычно не связаны с долгосрочными последствиями, хотя сообщалось об острых заболеваниях у недоношенных детей с очень низкой массой тела при рождении [32]. У доношенных детей перинатальные инфекции обычно протекают бессимптомно, но могут проявляться пневмонитом в течение первых нескольких месяцев жизни [33].
Врожденная ЦМВ-инфекция является следствием инфицирования матери и плода, причем большинство симптоматических врожденных случаев возникает из-за бессимптомной материнской инфекции. При материнской первичной инфекции, по-видимому, происходит нарушение плацентарного кровотока после инфицирования плацентарных вилок [34]. Патогенез вовлечения ЦНС в врожденную ЦМВ-инфекцию начинается с диссеминированного распространения виремии, включая эндотелиальные клетки головного мозга и эпителиальные клетки сосудистого сплетения.Из эндотелиальных клеток головного мозга вирус распространяется на смежные астроциты. Из сосудистого сплетения вирус затем перемещается к эпендимным поверхностям через спинномозговую жидкость (CSF). После инфицирования этих клеток вирус подвергается непрерывной репликации, что приводит к характерным внутриядерным тельцам включения и гибели клеток. Поскольку антитела вырабатываются в условиях непрерывной репликации вируса, также образуются иммунные комплексы, что приводит к дальнейшему иммуноопосредованному повреждению [31]. Хотя специфический патогенез SNHL, опосредованного CMV, не выяснен, гистология показала доказательства инфекции в клетках как улиткового, так и вестибулярного эндолабиринта [35].ЦМВ также был выделен из перилимфы улитки при вскрытии новорожденных с врожденной ЦМВ-инфекцией [36].
Недавние исследования лечения ганцикловиром врожденных ЦМВ-инфекций с поражением ЦНС были многообещающими. Введение ганцикловира в дозах 12 мг / кг / день, разделенных каждые 12 часов в течение 6 недель, улучшило исходы слуха у новорожденных с симптоматической врожденной ЦМВ-инфекцией с поражением ЦНС (о чем свидетельствуют микроцефалия, внутричерепные кальцификации, аномалии спинномозговой жидкости для возраста, хориоретинит и др.) / или нарушения слуха) [37].Первичной конечной точкой был улучшенный ответ, вызванный стволом мозга (BSER) между исходным уровнем и 6-месячным периодом наблюдения (или отсутствие ухудшения в течение 6-месячного периода наблюдения, если исходный BSER был нормальным). Что касается общего количества ушей, подлежащих оценке, 69% пациентов, получавших ганцикловир, достигли первичной конечной точки по сравнению с 39% в контрольной группе. Ни у одного пациента, получавшего ганцикловир, не было ухудшения слуха между исходным уровнем и 6 мес. У реципиентов ганцикловира также отмечалось более быстрое разрешение нарушений АЛТ, чем в контрольной группе, хотя вероятность развития нейтропении у них была значительно выше.Дополнительный анализ этого рандомизированного контролируемого исследования позволяет предположить, что ганцикловир может также уменьшать задержки в развитии нервной системы [38]. Улучшение смертности при терапии ганцикловиром пока не показано.
Лечение ЦМВ-инфекций
Ганцикловир (Цитовен)
Ганцикловир был первым противовирусным препаратом, доступным для терапии и профилактики инфекций, вызванных ЦМВ. Доказано, что это очень ценный препарат для пациентов с ослабленным иммунитетом, особенно для пациентов с рецептами трансплантации гемопоэтических стволовых клеток, которые страдают от значительной заболеваемости и смертности от ЦМВ-инфекций, а в последнее время – для детей с врожденной ЦМВ-инфекцией, хотя и не одобрено Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США. Администрация (FDA) в настоящее время.
Химия и механизм действия
Ганцикловир структурно похож на ацикловир, за исключением гидроксиметильной группы на его ациклической боковой цепи. Первоначальный этап фосфорилирования осуществляется pUL97, вирусной протеинкиназой. Затем клеточные киназы фосфорилируют агент еще два раза, чтобы преобразовать его в его трифосфатное производное, которое способно ингибировать ДНК-полимеразу ЦМВ, кодируемую UL97 , а также встраиваться в вирусную ДНК и обрывать ее.
Ганцикловир трифосфат – конкурентный ингибитор герпесвирусных ДНК-полимераз, приводящий к прекращению удлинения цепи ДНК [1, 20].
Спектр и устойчивость
Ганцикловир имеет сходную с ацикловиром активность против HSV-1, HSV-2 и VZV, но, в отличие от ацикловира, его наибольшая активность против CMV. Устойчивость изолятов ЦМВ обычно возникает в результате мутаций в гене UL97 [39]. Мутации в гене ДНК-полимеразы ЦМВ встречаются реже. Показания .Ганцикловир лицензирован по нескольким показаниям за пределами новорожденных. В нескольких обзорах резюмируются эти клинические исходы [2]. Для лечения новорожденных, врожденно инфицированных ЦМВ, было проведено контролируемое исследование [40]. Как отмечалось выше, по сравнению с отсутствием лечения терапия ганцикловиром предотвращала ухудшение слуха через два года, хотя примерно у двух третей пролеченных младенцев развилась нейтропения, часто требующая изменения дозы.
Фармакокинетика
Биодоступность ганцикловира при пероральном приеме низкая, при пероральном приеме всасывается менее 10% препарата [41, 42].Пероральный препарат ганцикловира больше не продается. Пиковые концентрации ганцикловира в сыворотке после введения 6 мг / кг (доза для новорожденных) внутривенно вводимого лекарственного средства колеблются от 8 до 11 мкг / мл с концентрациями, достаточными для подавления чувствительных штаммов ЦМВ в водянистой влаге, субретинальной жидкости, спинномозговой жидкости и ткани мозга [ 1]. Период полувыведения ганцикловира составляет от 2 до 3 часов, и большая часть препарата выводится в неизмененном виде с мочой. Фармакокинетика ганцикловира в популяции новорожденных аналогична таковой у взрослых [43, 44].Снижение дозы, пропорциональное степени снижения клиренса креатинина, необходимо лицам с нарушением функции почек. Дополнительная доза рекомендуется после диализа, поскольку она эффективно удаляется гемодиализом [45].
Побочные эффекты
Миелосупрессия – наиболее частое побочное действие ганцикловира; Дозозависимая нейтропения (менее 1000 лейкоцитов / мкл) является наиболее стойким гематологическим отклонением с частотой около 40% [42]. Нейтропения ограничивает дозу примерно в одном из семи курсов и исчезает после прекращения приема препарата.При пероральном приеме ганцикловира нейтропения возникает реже. Тромбоцитопения (менее 50 000 тромбоцитов / мкл) встречается примерно у 20%, а анемия – примерно у 2% реципиентов ганцикловира. От 2 до 5% реципиентов ганцикловира испытывают головную боль, спутанность сознания, изменение психического статуса, галлюцинации, кошмары, беспокойство, атаксию, тремор, судороги. лихорадка, сыпь и аномальные уровни сывороточных печеночных ферментов по отдельности или в некоторой комбинации.
Дозировка
Доза ганцикловира для лечения симптоматической врожденной ЦМВ-инфекции составляет 12 мг / кг / день внутривенно дважды в день в течение 6 недель.
Исследуемый препарат
Валганцикловир (Valcyte)
Валганцикловир был одобрен FDA в марте 2001 г. для лечения ЦМВ-ретинита. Поскольку он хорошо всасывается после перорального приема, он может представлять собой благоприятный вариант по сравнению с внутривенным введением ганцикловира для лечения врожденной ЦМВ-инфекции. В настоящее время он лицензирован для лечения ЦМВ-инфекций в отдельных популяциях трансплантатов и ЦМВ-ретинита у пациентов с ВИЧ / СПИДом.
Химия, механизм действия, спектр и устойчивость
Валганцикловир является пролекарством ганцикловира на основе эфира L-валина и, как таковой, имеет тот же механизм действия, противовирусный спектр и потенциал развития устойчивости, что и ганцикловир [1, 20] .
Показания
Валганцикловир имеет аналогичные показания к ганцикловиру. Однако, основываясь на опубликованных на сегодняшний день ограниченных контролируемых исследованиях, в настоящее время он одобрен для индукционной и поддерживающей терапии ЦМВ-ретинита и для отдельных популяций трансплантатов [46].В настоящее время исследуется возможность лечения врожденной ЦМВ-инфекции. В этом рандомизированном контролируемом исследовании, проводимом Группой по совместным антивирусным исследованиям (CASG) Национального института аллергии и инфекционных заболеваний (NIAID), в качестве основной конечной точки используется SNHL.
Фармакокинетика
Валганцикловир быстро превращается в ганцикловир со средним периодом полувыведения из плазмы около 30 минут [46]. Абсолютная биодоступность валганцикловира превышает 60% и фактически увеличивается примерно на 30% при одновременном приеме пищи [47].Площадь под кривой ганцикловира после перорального приема валганцикловира составляет от одной трети до половины площади, полученной после внутривенного введения ганцикловира. Пациентам с нарушением функции почек требуется снижение дозировки, примерно пропорциональное снижению клиренса креатинина.
Побочные эффекты
Наиболее частые побочные эффекты, связанные с терапией валганцикловиром у взрослых, включают диарею (41%), тошноту (30%), нейтропению (27%), анемию (26%) и головную боль (22%) [ 46].Лишь ограниченное число новорожденных получали терапию валганцикловиром. Единственным значимым открытием была нейтропения у 15% пациентов.
Дозировка
Доза валганцикловира зависит от возраста пациента и функции почек. В настоящее время препарат не разрешен к применению у новорожденных с врожденной ЦМВ-инфекцией.
Непроверенные и непроверенные методы лечения неонатальных инфекций HSV, VZV и врожденных CMV-инфекций
Следующие два препарата используются для лечения HSV, VZV и CMV инфекций у детей старшего возраста и взрослых.Данные об этих препаратах предоставляются, если у новорожденных возникает устойчивость к противовирусным препаратам при инфекциях ВПГ или ЦМВ. Ни один из препаратов не был оценен в рамках доказательных исследований на новорожденных, и оба связаны со значительной токсичностью. Кроме того, валацикловир может стать доступным для педиатрического применения, особенно для младенцев с инфекцией HSV, ограниченной кожей, глазами и ртом
Цидофовир (HPMPC, Vistide)
Цидофовир был впервые одобрен для использования в США для лечения СПИДа -ассоциированный ретинит, вызванный ЦМВ.Это остается основным показанием к применению этого противовирусного препарата.
Химия и механизм действия
Цидофовир – это новый аналог ациклических фосфонатных нуклеозидов с механизмом действия, аналогичным другим аналогам нуклеозидов. В отличие от ацикловира, вирусные ферменты не требуются для начального фосфорилирования, поскольку нативный цидофовир уже имеет одну присоединенную фосфатную группу. После дифосфорализации клеточными киназами цидофовир конкурентно ингибирует ДНК-полимеразу [48].Активная форма цидофовира проявляет в 25-50 раз большее сродство к вирусной ДНК-полимеразе по сравнению с клеточной ДНК-полимеразой.
Спектр и устойчивость
Цидофовир активен против ВПГ и ЦМВ, включая устойчивые к ацикловиру и фоскарнету изоляты ВПГ и мутанты ЦМВ, устойчивые к ганцикловиру и фоскарнету [49]. Он также активен in vitro против VZV, EBV, вируса герпеса человека-6, вируса герпеса человека-8, полиомавирусов, аденовируса и ВПЧ человека.
Было описано небольшое количество устойчивых к цидофовиру изолятов ЦМВ, которые также устойчивы к ганцикловиру на основе мутаций в гене ДНК-полимеразы [50].Сообщалось также о мутанте ЦМВ, устойчивом к ганцикловиру, фоскарнету и цидофовиру [51].
Показания
Цидофовир замедляет прогрессирование заболевания сетчатки у пациентов со СПИДом [52, 53]. Цидофовир также был полезен при лечении заболеваний, вызванных устойчивыми к ацикловиру изолятами ВПГ [54]. Были опубликованы отдельные сообщения об улучшении папилломатоза гортани после инъекции цидофовира в очаг поражения, но на основании этого ограниченного опыта невозможно сделать окончательные выводы об эффективности [55, 56].
Фармакокинетика
Только 2–26% цидофовира всасывается после перорального приема, поэтому его вводят внутривенно. Период полувыведения цидофовира из плазмы составляет 2,6 часа, но период полураспада активных внутриклеточных метаболитов цидофовира составляет от 17 до 48 часов [ 57]. Девяносто процентов препарата выводится с мочой, в основном с секрецией почечных канальцев [58]. Важно отметить, что препарат не проникает через гематоэнцефалический барьер и, следовательно, не должен использоваться для лечения инфекций ЦНС.
Побочные эффекты
Поскольку цидофовир концентрируется в почечных клетках в количествах в 100 раз больше, чем в других тканях, нефротоксичность является основным побочным эффектом, особенно если гидратация не поддерживается [57, 58].Проявления почечной токсичности включают протеинурию и глюкозурию. Агрессивная внутривенная прегидратация, одновременное введение пробенецида и избегание других нефротоксических агентов снижают вероятность токсичности. Цидофовир противопоказан пациентам с креатинином сыворотки> 1,5 мг / дл, расчетным клиренсом креатинина ≤ 55 мл / мин или белком мочи ≥ 100 мг / дл, и препарат следует отменить, если креатинин сыворотки повышается на ≥ 0,5 мг / дл выше исходного уровня. .
Дозировка
Цидофовир вводят внутривенно детям старшего возраста и взрослым в дозе 5 мг / кг один раз в неделю с пробенецидом.Пациенты с нарушением функции почек (расчетный клиренс креатинина <55 мл / мин) проходят лечение каждые 2 недели. Дозу следует уменьшить с 5 мг / кг до 3 мг / кг, если креатинин сыворотки повышается на> 0,3 мг / дл выше исходного уровня. Данных о дозировании цидофовира новорожденным нет.
Фоскарнет (PFA, Foscavir)
Фоскарнет – единственный противогерпетический препарат, не являющийся аналогом нуклеозидов. Это не препарат первой линии, но он полезен для лечения инфекций, вызванных устойчивыми вирусами герпеса.
Химия и механизм действия
Фоскарнет – неорганический аналог пирофосфата, который напрямую ингибирует ДНК-полимеразу, блокируя сайт связывания пирофосфата [20, 59].
Спектр и устойчивость
Фоскарнет ингибирует все известные герпесвирусы человека, включая большинство устойчивых к ганцикловиру изолятов ЦМВ и устойчивые к ацикловиру штаммы ВПГ и ВЗВ. Он также активен против ВИЧ. Устойчивость возникает в результате мутаций ДНК-полимеразы. Сообщалось о штаммах CMV, HSV и VZV с пониженной чувствительностью к фоскарнету [59, 60].
Показания
Фоскарнет так же эффективен, как и ганцикловир, для лечения угрожающего зрению хориоретинита, вызванного ЦМВ, у взрослых пациентов со СПИДом [61]. Из-за присущей ему активности против ВИЧ, он может даже обеспечить преимущество в выживаемости для пролеченных пациентов [62]. Рефрактерные случаи хориоретинита могут поддаваться лечению комбинацией фоскарнета и ганцикловира. Фоскарнет также эффективен при терапии ЦМВ-инфекций, вызванных ганцикловир-резистентными штаммами вируса [62]. Ограниченные данные также предполагают, что фоскарнет может быть полезным при назначении пациентам со СПИДом, у которых есть желудочно-кишечные и легочные инфекции, вызванные ЦМВ.
Инфекции, вызванные устойчивыми к ацикловиру штаммами HSV и VZV, успешно контролируются с помощью фоскарнета [63, 64].
Фармакокинетика
Только около 20% фоскарнета абсорбируется после перорального приема. Максимальная концентрация в сыворотке, достигаемая после внутривенного введения 60 мг / кг, составляет примерно 500 мкмоль / л [59]. Концентрация в спинномозговой жидкости составляет около двух третей от концентрации в сыворотке. Период полувыведения фоскарнета составляет около 48 часов, и 80% введенной дозы выводится в неизмененном виде с мочой.Необходимо снижение дозы пропорционально уменьшению клиренса креатинина. Гемодиализ эффективно устраняет фоскарнет, поэтому после диализа рекомендуется дополнительная доза [65]. Данных о применении фоскарнета новорожденным нет.
Побочные эффекты
Наиболее частыми побочными эффектами фоскарнета являются нефротоксичность и метаболические нарушения. Доказательства нефротоксичности включают азотемию, протеинурию, острый некроз канальцев, кристаллурию и интерстициальный нефрит.Концентрация креатинина в сыворотке увеличивается до 50% пациентов. К счастью, функция почек приходит в норму в течение 2–4 недель после прекращения терапии. Существующее ранее заболевание почек, одновременный прием других нефротоксических препаратов, обезвоживание, быстрое введение или непрерывное внутривенное вливание препарата являются факторами риска развития почечной дисфункции [66]. Метаболические нарушения, связанные с терапией фоскарнетом, включают гипо- и гиперкальциемию, а также гипо- и гиперфосфатемию [67]. Гипокальциемия может быть связана с парестезиями, тетанией, судорогами и аритмиями.Метаболические нарушения сводятся к минимуму, если вводить фоскарнет медленной инфузией. Симптомы со стороны ЦНС, связанные с терапией фоскарнетом, включают головную боль, тремор, раздражительность, судороги и галлюцинации. Сообщалось также о лихорадке, тошноте, рвоте, аномальных ферментах сыворотки крови, анемии, гранулоцитопении и генитальных изъязвлениях.
Лекарственные взаимодействия
Одновременное применение амфотерицина B, циклоспорина, гентамицина и других нефротоксических препаратов увеличивает вероятность нарушения функции почек.Одновременный прием пентамидина увеличивает риск гипокальциемии. Анемия и нейтропения чаще встречаются, когда пациенты также получают зидовудин.
Дозировка
Обычная доза фоскарнета при ЦМВ-инфекции составляет 180 мг / кг / день в три приема в течение 14–21 дней, после чего следует ежедневная поддерживающая доза от 90 до 120 мг / кг. Дозировка фоскарнета, используемого при инфекциях, вызванных устойчивыми к ацикловиру HSV и VZV, составляет 120 мг / кг / день в три приема.
Резюме
Несмотря на то, что в лечении врожденных ЦМВ и неонатальных инфекций ВПГ достигнут значительный прогресс, дальнейшие достижения являются обязательными.С появлением новых противовирусных препаратов, обладающих другим механизмом действия, появляется возможность для комбинированной терапии, если можно доказать, что лекарства безопасны.
Выражение признательности
Этот проект полностью или частично финансируется за счет федеральных средств Национального института аллергии и инфекционных заболеваний, Национальных институтов здравоохранения, Министерства здравоохранения и социальных служб, по контракту № N01-AI-30025.
Сноски
Заявление издателя: Это PDF-файл неотредактированной рукописи, принятой к публикации.В качестве услуги для наших клиентов мы предоставляем эту раннюю версию рукописи. Рукопись будет подвергнута копированию, верстке и рассмотрению полученного доказательства, прежде чем она будет опубликована в окончательной форме для цитирования. Обратите внимание, что во время производственного процесса могут быть обнаружены ошибки, которые могут повлиять на содержание, и все юридические оговорки, относящиеся к журналу, имеют отношение.
Список литературы
1. Кимберлин Д. Противовирусные агенты. В: Лонг С., Пикеринг Л., Пробер С., редакторы. Принципы и практика детских инфекционных болезней.3-е изд. Нью-Йорк: Эльзевир; 2008. С. 1470–1488. [Google Scholar] 2. Ра Б., Кимберлин Д. В., Уитли Р. Противовирусные препараты. В: Джером К., редактор. Лабораторная диагностика вирусных инфекций. 3-е изд. Нью-Йорк: Informa Healthcare; 2009. [Google Scholar] 3. Brown ZA, Wald A, Morrow RA, Selke S, Zeh J, Corey L. Влияние серологического статуса и кесарева сечения на скорость передачи вируса простого герпеса от матери к ребенку. ДЖАМА. 2003. 289 (2): 203–209. [PubMed] [Google Scholar] 4. Уитли Р.Дж. Вирус простого герпеса.В: Scheld MW, Whitley RJ, Marra CM, редакторы. Инфекции центральной нервной системы. 3-е изд. Филадельфия: Липпинкотт Уильямс и Уилкинс; 2004. С. 123–144. [Google Scholar] 5. Kimberlin DW, Lin CY, Jacobs RF, Powell DA, Frenkel LM, Gruber WC, et al. Естественная история инфекций, вызванных вирусом простого герпеса новорожденных, в эпоху ацикловира. Педиатрия. 2001. 108 (2): 223–229. [PubMed] [Google Scholar] 6. Kimberlin DW. Ведение энцефалита, вызванного вирусом простого герпеса, у взрослых и новорожденных: диагностика, прогноз и лечение.Герпес. 2007 июн; 14 (1): 11–16. [PubMed] [Google Scholar] 7. Хатто С., Арвин А., Джейкобс Р., Стил Р., Стагно С., Лайрин Р. и др. Внутриутробные инфекции, вызванные вирусом простого герпеса. Журнал педиатрии. 1987. 110 (1): 97–101. [PubMed] [Google Scholar] 8. Уитли Р.Дж. Инфекции, вызванные вирусом простого герпеса. В: Remington JS, Klein JO, редакторы. Инфекционные болезни плода и новорожденных. 3-е изд. Филадельфия: W.B. Компания Сондерс; 1990. С. 282–305. [Google Scholar] 9. Уитли Р.Дж., Кори Л., Арвин А., Лейкман Ф.Д., Сумая К.В., Райт П.Ф. и др.Изменение представления инфекции вируса простого герпеса у новорожденных. Журнал инфекционных болезней. 1988. 158 (1): 109–116. [PubMed] [Google Scholar] 10. Уитли Р.Дж., Ройзман Б. Вирусы простого герпеса. В: Ричман Д.Д., Уитли Р.Дж., Хайден Ф.Г., редакторы. Клиническая вирусология. 2-е изд. Вашингтон, округ Колумбия: ASM Press; 2004. С. 375–401. [Google Scholar] 11. Уитли Р., Арвин А., Пробер С., Берчетт С., Кори Л., Пауэлл Д. и др. Контролируемое испытание по сравнению видарабина с ацикловиром при неонатальной инфекции вирусом простого герпеса.Медицинский журнал Новой Англии. 1991. 324 (7): 444–449. [PubMed] [Google Scholar] 12. Kimberlin DW, Lin CY, Jacobs RF, Powell DA, Corey L, Gruber WC, et al. Безопасность и эффективность высоких доз внутривенного ацикловира при лечении инфекций, вызванных вирусом простого герпеса у новорожденных. Педиатрия. 2001. 108 (2): 230–238. [PubMed] [Google Scholar] 13. Кимберлин Д., Уитли Р., Ван В., Пауэлл Д., Сторч Г., Ахмед А. и др. Влияние перорального подавления ацикловира на исходы развития нервной системы и рецидивы кожи после неонатальной болезни, вызванной вирусом простого герпеса.NEJM. 2011 В печати. [Google Scholar] 14. Englund JA, Zimmerman ME, Swierkosz EU, Goodman JL, Scholl D, Balfour HH. Вирус простого герпеса устойчив к ацикловиру. Исследование в центре третичной медицинской помощи. Ann Intern Med. 1990; 112: 416–422. [PubMed] [Google Scholar] 15. Полевой АК, Бирон К.К. Возвращение к «концу невинности»: устойчивость герпесвирусов к противовирусным препаратам. Clin Microbiol Rev.1994, январь; 7 (1): 1–13. [Бесплатная статья PMC] [PubMed] [Google Scholar] 16. Лайалл Э.Г., Огилви М.М., Смит Н.М., Бернс С. Устойчивость к ацикловиру ветряной оспы и ВИЧ-инфекция.Arch Dis Child. 1994 Февраль; 70 (2): 133–135. [Бесплатная статья PMC] [PubMed] [Google Scholar] 17. Морфин Ф, Тувено Д. Устойчивость вируса простого герпеса к противовирусным препаратам. J Clin Virol. 2003 Янв; 26 (1): 29–37. [PubMed] [Google Scholar] 18. Wagstaff AJ, Faulds D, Goa Kl. Ацикловир. Переоценка его противовирусной активности, фармакокинетических свойств и терапевтической эффективности. Наркотики. 1994; 47: 153–205. [PubMed] [Google Scholar] 19. Ласкин О.Л., Лонгстрет Дж. А., Велтон А., Красный Х. С., Кини Р. Э., Рокко Л. и др. Влияние почечной недостаточности на фармакокинетику ацикловира.Am J Med. 20 июля 1982 г.; 73 (1A): 197–201. [PubMed] [Google Scholar] 20. Инь М., Браст Дж., Тиеу Х., Хаммер С. Антигепатитные и противодыхательные вирусные агенты. В: Ричман Д., Уитли Р., Хайден Ф., редакторы. Клиническая вирусология. Вашингтон, округ Колумбия: ASM Press; 2009. С. 217–264. [Google Scholar] 21. Красный ХК, Ляо С.Х., де Миранда П., Ласкин О.Л., Велтон А., Литман П.С. Влияние гемодиализа на фармакокинетику ацикловира у пациентов с хронической почечной недостаточностью. Am J Med. 20 июля 1982 г.; 73 (1A): 202–204. [PubMed] [Google Scholar] 22.Кимберлин Д., Пауэлл Д., Грубер В., Диаз П., Арвин А., Кумар М. и др. Назначение пероральной супрессивной терапии ацикловиром после неонатальной болезни, вызванной вирусом простого герпеса, с поражением кожи, глаз и рта: результаты тирала фазы I / II. Pediatr Infect Dis J. 1996; 15: 247–254. [PubMed] [Google Scholar] 23. Kimberlin DW, Lin CY, Jacobs RF, Powell DA, Corey L, Gruber WC, et al. Безопасность и эффективность высоких доз внутривенного ацикловира при лечении инфекций, вызванных вирусом простого герпеса у новорожденных. Педиатрия.2001 август; 108 (2): 230–238. [PubMed] [Google Scholar] 24. Реванкар С.Г., Эпплгейт А.Л., Марковиц Д.М. Делирий, связанный с лечением ацикловиром у пациента с почечной недостаточностью. Clin Infect Dis. 1995 августа; 21 (2): 435–436. [PubMed] [Google Scholar] 25. Гриффитс П.Д., Эмери В.К. Цитомегаловирус. В: Ричман Д.Д., Уитли Р.Дж., Хайден Ф.Г., редакторы. Клиническая вирусология. 2-е изд. Вашингтон, округ Колумбия: ASM Press; 2002. С. 433–461. [Google Scholar] 26. Старас С.А., Доллард СК, Рэдфорд К.В., Фландрия В.Д., Пасс РФ, Кэннон М.Дж. Распространенность цитомегаловирусной инфекции в США: 1988–1994 гг.Clin Infect Dis. 2006 г., 1 ноября; 43 (9): 1143–1151. [PubMed] [Google Scholar] 27. Demmler GJ. Американское общество инфекционных болезней и Центры по контролю за заболеваниями. Резюме семинара по надзору за врожденными цитомегаловирусными заболеваниями. Обзоры инфекционных болезней. 1991. 13 (2): 315–329. [PubMed] [Google Scholar] 28. Conboy TJ, Pass RF, Stagno S, Alford CA, Myers GJ, Britt WJ и др. Ранние клинические проявления и интеллектуальный исход у детей с симптоматической врожденной цитомегаловирусной инфекцией.Журнал педиатрии. 1987. 111 (3): 343–348. [PubMed] [Google Scholar] 29. Доллард СК, Гроссе С.Д., Росс Д.С. Новые оценки распространенности неврологических и сенсорных последствий и смертности, связанных с врожденной цитомегаловирусной инфекцией. Rev Med Virol. 1 июня 2007 г .; [PubMed] [Google Scholar] 30. Росс С.А., Боппана С.Б. Врожденная цитомегаловирусная инфекция: исход и диагноз. Semin Pediatr Infect Dis. 2005 Янв; 16 (1): 44–49. [PubMed] [Google Scholar] 31. Гриффитс PD, Маклафлин JE. Цитомегаловирус.В: Scheld WM, Whitley RJ, Marra CM, редакторы. Инфекции центральной нервной системы. Филадельфия: Липпинкотт Уильямс и Уилкинс; 2004. С. 159–173. [Google Scholar] 32. Машманн Дж., Хампрехт К., Дитц К., Ян Дж., Шпеер С.П. Цитомегаловирусная инфекция младенцев с крайне низкой массой тела при рождении через грудное молоко. Клинические инфекционные болезни. 2001; 33 (12): 1998–2003. [PubMed] [Google Scholar] 33. Brasfield DM, Stagno S, Whitley RJ, Cloud G, Cassell G, Tiller RE. Детский пневмонит, связанный с цитомегаловирусом, хламидиозом, пневмоцистом и уреаплазмой.Педиатрия. 1987. 79: 76–83. [PubMed] [Google Scholar] 34. Перейра Л., Майджи Э. Цитомегаловирусная инфекция в плаценте человека: материнский иммунитет и рецепторы, регулируемые развитием трофобластов, сходятся. Актуальные темы микробиологии и иммунологии. 2008. 325: 383–395. [PubMed] [Google Scholar] 35. Штраус М. Цитомегаловирусный лабиринтит человека. Am J Otolaryngol. Сентябрь – октябрь 1990 г., 11 (5): 292–298. [PubMed] [Google Scholar] 36. Дэвис Л.Е., Джонссон Л.Г., Корнфельд М. Цитомегаловирусный лабиринтит у младенцев: морфологические, вирусологические и иммунофлуоресцентные исследования.J Neuropathol Exp Neurol. 1981, январь; 40 (1): 9–19. [PubMed] [Google Scholar] 37. Kimberlin DW, Lin CY, Sanchez PJ, Demmler GJ, Dankner W, Shelton M и др. Влияние терапии ганцикловиром на слух при симптоматическом врожденном цитомегаловирусном заболевании с поражением центральной нервной системы: рандомизированное контролируемое исследование. Журнал педиатрии. 2003. 143 (1): 16–25. [PubMed] [Google Scholar] 38. Оливер С., Клауд Дж., Санчес П., Деммлер Дж., Данкнер В., Шелтон М. и др. Влияние терапии ганцикловиром (GCV) на исходы нервного развития при симптоматических врожденных цитомегаловирусных (CMV) инфекциях с поражением центральной нервной системы (ЦНС): рандомизированное контролируемое исследование.Ежегодное собрание Общества педиатрических исследований (SPR); 2006 29 апреля; Сан-Франциско, Калифорния. 2006. с. Реферат № 752908. [Google Scholar] 39. Маркхам А., Фолдс Д. Ганцикловир: обновление его терапевтического использования при цитомегаловирусной инфекции. Наркотики. 1994; 48: 455. [PubMed] [Google Scholar] 40. Kimberlin DW, Lin C-Y, Sanchez PJ, Demmler GJ, Dankner W, Shelton MD, et al. Влияние ганцикловира на слух при симптоматическом врожденном цитомегаловирусном заболевании с поражением центральной нервной системы: рандомизированное контролируемое исследование.J Pediatr. 2003. 143: 16–25. [PubMed] [Google Scholar] 41. Редди В., Хао Ю., Липтон Дж., Мехарчанд Дж., Минден М., Мацзулли Т. и др. Ведение реципиентов аллогенного трансплантата костного мозга с риском цитомегаловирусной болезни с использованием контрольной бронхоскопии и длительной упреждающей терапии ганцикловиром. J Clin Virol. 1999, август; 13 (3): 149–159. [PubMed] [Google Scholar] 42. Jacobson MA, Gambertoglio JG, Aweeka FT, Causey DM, Portale AA. Гипокальциемия, вызванная фоскарнетом, и влияние фоскарнета на метаболизм кальция.J Clin Endocrinol Metab. 1991 Май; 72 (5): 1130–1135. [PubMed] [Google Scholar] 43. Френкель Л.М., Каппарелли Е.В., Данкнер В.М., Сюй Дж., Смит И.Л., Баллоу А. и др. Ганцикловир для приема внутрь у детей: фармакокинетика, безопасность, переносимость и противовирусное действие. Группа педиатрических клинических испытаний СПИДа. Журнал инфекционных болезней. 2000 декабрь; 182 (6): 1616–1624. [PubMed] [Google Scholar] 44. Транг Дж. М., Кидд Л., Грубер В., Сторч Дж., Деммлер Дж., Джейкобс Р. и др. Линейная фармакокинетика однократной дозы ганцикловира у новорожденных с врожденными цитомегаловирусными инфекциями.Clin Pharmacol Ther. 1993; 53: 15–21. [PubMed] [Google Scholar] 45. Свон С.К., Мунар М.Ю., Виггер М.А., Беннетт В.М. Фармакокинетика ганцикловира у пациента, находящегося на гемодиализе. Am J Kidney Dis. 1991, январь; 17 (1): 69–72. [PubMed] [Google Scholar] 46. Cocohoba JM, McNicholl IR. Валганцикловир: прогресс в лечении цитомегаловирусов. Энн Фармакотер. 2002 июн; 36 (6): 1075–1079. [PubMed] [Google Scholar] 47. Юнг Д., Дорр А. Фармакокинетика однократной дозы валганцикловира у ВИЧ- и ЦМВ-серопозитивных субъектов.J Clin Pharmacol. 1999, август; 39 (8): 800–804. [PubMed] [Google Scholar] 48. Хо Х.Т., Вудс К.Л., Бронсон Дж. Дж., Де Бок Х., Мартин Дж. К., Хичкок МД. Внутриклеточный метаболизм антигерпетических средств -1- {3-гидрокси-2- (фосфонилметокси) пропил} цитозин. Mol Pharmacol. 1992; 41: 197–202. [PubMed] [Google Scholar] 49. Сафрин С, Черрингтон Дж, Джаффе Х.С. Клиническое использование цидофовира. Rev Med Virol. 1997 сентябрь; 7 (3): 145–156. [PubMed] [Google Scholar] 50. Lurain N, Spafford LE, Thompson KD. Мутация в открытой рамке считывания UL97 штаммов цитомегаловируса человека, устойчивых к ганцикловиру.Журнал вирусологии. 1994b; 68: 4427–4431. [Бесплатная статья PMC] [PubMed] [Google Scholar] 51. Черрингтон Дж. М., Майнер Р., Аллен С. Дж. У. и др. Сенситивы клинических изолятов цитомегаловируса человека (HCMV) к цидофовиру. Восьмая международная конференция по противовирусным исследованиям; 1995 г. 23–28 апреля; Санта-Фе, Нью-Мексико. 1995. [Google Scholar] 52. Исследования глазных осложнений Группы исследований СПИДа в сотрудничестве с Группой клинических испытаний СПИДа. Цидофовир (HPMPC) для лечения цитомегаловирусного ретинита у пациентов со СПИДом: исследование периферического цитомегаловирусного ретинита HPMPC.Ann Intern Med. 1997. 126: 264–274. [PubMed] [Google Scholar] 53. Lalezari JP, Staagg RJ, Kuppermann BD, Holland GN, Kramer F, Ives DV, et al. Внутривенное введение цидофовира при периферическом цитомегаловирусном ретините у пациентов со СПИДом: рандомизированное контролируемое исследование. Ann Intern Med. 1997. 126: 257–263. [PubMed] [Google Scholar] 54. Лалезари Дж. П., Дрю В. Л., Глутцер Э., Майнер Д., Сафрин С., Оуэн В. Ф., младший и др. Лечение внутривенным (S) -1- [3-гидрокси-2- (фосфонилметокси) пропил) -цитозином ацикловир-резистентной кожно-слизистой инфекции вирусом простого герпеса у пациента со СПИДом.Журнал инфекционных болезней. 1994; 170: 570–572. [PubMed] [Google Scholar] 55. Кимберлин DW, Малис DJ. Рецидивирующий респираторный папилломатоз с юношеским началом: возможности успешной противовирусной терапии. Antiviral Res. 2000 Февраль; 45 (2): 83–93. [PubMed] [Google Scholar] 56. Прански С.М., Магит А.Е., Кернс Д.Б., Канг Д.Р., Дункан Н.О. Цидофовир внутриочаговый при рецидивирующем респираторном папилломатозе у детей. Arch Otolaryngol Head Neck Surg. 1999 Октябрь; 125 (10): 1143–1148. [PubMed] [Google Scholar] 57. Канди К.С., Петти Б.Г., Флаэрти Дж., Фишер П.Е., Полис М.А., Ваксман М. и др.Клиническая фармакокинетика цидофовира у пациентов, инфицированных вирусом иммунодефицита человека. Противомикробные агенты Chemother. 1995; 39: 1247–1252. [Бесплатная статья PMC] [PubMed] [Google Scholar] 58. Лалезари Дж. П., Дрю В. Л., Глутцер Э., Джеймс С., Майнер Д., Флаэрти Дж. И др. (S) -1 {3-гидрокси-2- (фосфонилметокси) пропил} цитозин (цидофовиир): результаты исследования фазы I / II нового противовирусного аналога нуцелотида. Журнал инфекционных болезней. 1995; 171: 788–796. [PubMed] [Google Scholar] 59. Wagstaff AJ, Bryson HM.Фоскарнет: переоценка его противовирусной активности, фармакокинетических свойств и терапевтического использования у пациентов с ослабленным иммунитетом и вирусной инфекцией. Наркотики. 1994. 48: 199–226. [PubMed] [Google Scholar] 60. Сафрин С., Кеммерли С., Плоткин Б., Смит Т., Вайсбах Н., Де Веранес Д. и др. Инфекция, вызванная устойчивым к фоскарнету вирусом простого герпеса, у больных СПИДом. Журнал инфекционных болезней. 1994; 169: 193–196. [PubMed] [Google Scholar] 61. Снок Р., Андрей Г., Джерард М., Сильверман А., Хеддерман А., Бальзарини Дж. И др.Успешное лечение прогрессирующей кожно-слизистой инфекции, вызванной устойчивым к ацикловиру и фоскарнету вирусом простого герпеса, с помощью (S) -1- (3-гидрокси-2-фосфонилметоксипропил) цитозина (HPMPC) Clin Infect Dis. 1994 Апрель; 18 (4): 570–578. [PubMed] [Google Scholar] 62. Якобсон М.А., Дрю В.Л., Файнберг Дж., О’Доннелл Дж. Дж., Уитмор П.В., Майнер Р.Д. и др. Терапия фоскарнетом при ганцикловиррезистентном цитомегаловирусном ретините у больных СПИДом. Журнал инфекционных болезней. 1991; 163: 1348–1351. [PubMed] [Google Scholar] 63.Сафрин С., Бергер Т.Г., Гилсон И. Терапия фоскарнетом у пяти пациентов со СПИДом и инфекцией вируса ветряной оспы, устойчивой к ацикловиру. Ann Intern Med. 1991; 115: 19–21. [PubMed] [Google Scholar] 64. Исследования глазных осложнений исследовательской группы СПИДа. Смертность у пациентов с синдромом приобретенного иммунодефицита, получавших фоскарнет или ганцикловир от цитомегаловируса ретинита. N Engl J Med. 1992; 326: 213–220. [PubMed] [Google Scholar] 65. Сафрин С., Крампакер С., Чатис П., Дэвис Р., Хафнер Р., Раш Дж. И др.Контролируемое исследование по сравнению фоскарнета и видарабина при лечении ацикловир-резистентного кожно-слизистого простого герпеса при синдроме приобретенного иммунодефицита. N Engl J Med. 1991; 325: 551–555. [PubMed] [Google Scholar] 66. МакГрегор Р. Р., Грациани А. Л., Вайс Р., Грюнвальд Дж. Э., Гамбертольо Дж. Г.. Успешная терапия фоскарнетом при цитомегаловирусном ретините у пациента со СПИДом, находящегося на гемодиализе: обоснование эмпирического дозирования и мониторинга уровня в плазме. Журнал инфекционных болезней. 1991 Октябрь; 164 (4): 785–787.[PubMed] [Google Scholar] 67. Дерай Дж., Мартинес Ф., Катлама С., Левальтье Б., Бофилс Н., Данис М. и др. Нефротоксичность фоскарнета: механизм, частота возникновения и профилактика. Am J Nephrol. 1989. 9 (4): 316–321. [PubMed] [Google Scholar]Использование противовирусных препаратов в неонатальном периоде
Clin Perinatol. Авторская рукопись; доступно в PMC 1 марта 2013 г.
Опубликован в окончательной отредактированной форме как:
PMCID: PMC32
NIHMSID: NIHMS351802
Richard J.Whitley
Заслуженный профессор, стипендиат Лоеба в области педиатрии, профессор педиатрии, микробиологии, медицины и нейрохирургии, Университет Алабамы в Бирмингеме, Бирмингем, AL
Ричард Дж. Уитли, заслуженный профессор, стипендиат Лоеба в педиатрии, профессор педиатрии, Микробиология, медицина и нейрохирургия, Университет Алабамы в Бирмингеме, Бирмингем, Алабама;
Окончательная отредактированная версия этой статьи издателем доступна в Clin Perinatol. См. Другие статьи в PMC, в которых цитируется опубликованная статья.Введение
Парентеральная терапия вирусных инфекций новорожденных и младенцев стала реальностью с появлением в начале 1980-х годов видарабина (аденин арабинозида) для лечения инфекций, вызванных вирусом простого герпеса (ВПГ) новорожденных. С тех пор ацикловир стал препаратом выбора для лечения неонатальных инфекций HSV, а также множества других герпесвирусных инфекций. Аналогичным образом было установлено, что ганцикловир полезен для лечения врожденных цитомегаловирусных (ЦМВ) инфекций, поражающих центральную нервную систему (ЦНС).В этой главе будут рассмотрены уроки, извлеченные из лечения неонатального ВПГ и врожденных ЦМВ-инфекций в связи с применением ацикловира и ганцикловира. Хотя естественная история этих заболеваний рассматривается в другом месте в этом тексте, краткое изложение будет предшествовать подробному обсуждению имеющихся установленных и альтернативных методов лечения. Отсылаем читателя к более обширным обзорам противовирусной терапии у детей и взрослых [1, 2].
Терапия инфекций, вызванных вирусом простого герпеса
Неонатальные инфекции ВПГ встречаются примерно у 1 из 3200 родов в США [3], и примерно у двух третей из них развивается какая-либо форма заболевания ЦНС [4].Большинство случаев вызвано ВПГ-2 [5]. Риск передачи увеличивается при первичной материнской инфекции в третьем триместре, составляя 30–50%, и может быть снижен путем кесарева сечения, если HSV был изолирован из шейки матки или наружных половых органов незадолго до родов [3]. Согласно обзору Кимберлина, 85% случаев неонатальной передачи вируса простого герпеса возникают в результате послеродовой передачи, в то время как 10% происходят в результате послеродовой передачи и только 5% связаны с передачей внутриутробно [6].
Младенцы с внутриутробной инфекцией ВПГ характеризуются триадой кожных проявлений (активные поражения, рубцы), неврологических признаков (микроцефалия, гидранэнцефалия) и глазных патологий (хориоретинит, микрофтальмия), присутствующих при рождении.Было обнаружено, что внутриутробная инфекция ВПГ возникает как при первичной, так и при рецидивирующей материнской инфекции ВПГ [7], хотя риск повторной инфекции меньше.
Инфекция HSV, приобретенная в послеродовом или послеродовом периоде, может быть классифицирована как заболевание кожи, глаз и / или рта (SEM), заболевание ЦНС или диссеминированное заболевание. По определению, болезнь SEM не затрагивает ЦНС. Распространенное заболевание может поражать ЦНС (75% случаев) вместе с множеством других систем органов, включая печень, надпочечники, желудочно-кишечный тракт, кожу, глаза или рот [8].Заболевание ЦНС также может иметь компонент вовлечения SEM, но не затрагивает другие системы органов. Из всех младенцев с неонатальной инфекцией ВПГ около 33% имеют заболевание ЦНС, а около 25% имеют диссеминированное заболевание [9]. Таким образом, около 50% младенцев с неонатальной инфекцией ВПГ имеют заболевание ЦНС.
Патогенез поражения ЦНС при неонатальных инфекциях ВПГ различается в зависимости от того, является ли инфекция диссеминированной. Энцефалит, связанный с диссеминацией, происходит из-за гематогенного распространения, тогда как изолированный энцефалит или энцефалит, связанный только с вовлечением SEM, вероятно, возникает из-за ретроградного внутринейронального транспорта HSV [4].Это различие соответствует клиническим проявлениям диссеминированного заболевания по сравнению с заболеванием ЦНС в том смысле, что распространение диссеминированного заболевания через кровь проявляется раньше (в среднем от 9 до 11 дней жизни) и вызывает более диффузное поражение мозга с множественными участками геморрагического некроза, в то время как заболевание ЦНС происходящий через более медленный аксональный транспорт, проявляется позже (примерно от 16 до 17 дней жизни) и обычно вызывает более очаговое поражение ЦНС [10].
Ранняя эра противовирусной терапии неонатальной инфекции ВПГ была отмечена повышением смертности при внутривенном введении видарабина, а также при внутривенном введении стандартной дозы (SD) ацикловира (30 мг / кг / день в 3 приема).Годовая смертность от диссеминированного заболевания снизилась с 85% при отсутствии терапии до 50% при использовании видарабина и 61% при использовании ацикловира SD, в то время как смертность за 1 год от заболевания ЦНС снизилась с 35% без лечения до 14% как для видарабина, так и для ацикловира SD. [11]. Совсем недавно было показано, что ацикловир в высоких дозах (HD) дополнительно улучшает эти показатели смертности. При внутривенном введении ацикловира на HD (60 мг / кг / день в 3 приема в течение 21 дня) уровень смертности в течение одного года составил 29% и 4% от диссеминированных заболеваний и заболеваний ЦНС, соответственно [12].В то время как HD ацикловир снижал заболеваемость младенцев с диссеминированным заболеванием (83% выживших имели нормальные исходы нервного развития), у младенцев с заболеванием ЦНС не наблюдалось значительного улучшения заболеваемости (31% выживших имели нормальные исходы неврологического развития).
Младенцы с поражением SEM имеют наилучший прогноз и, как указано ниже, им требуется всего 14 дней внутривенной терапии ацикловиром на HD.
В последнее время супрессивная терапия ацикловиром для младенцев с ЦНС после завершения внутривенного лечения значительно улучшила неврологический исход, измеренный по шкале Bailey Developmental Scores [13].Этот режим привел к тому, что примерно 60% (по сравнению с 31%) детей с заболеванием ЦНС развились нормально или с легкими нарушениями. Лечение проводилось в дозе 300 / мг / м 2 за три раза в день в течение шести месяцев.
Терапия неонатальных инфекций, вызванных вирусом ветряной оспы
У женщин, перенесших первичную инфекцию вируса ветряной оспы (VZV) в течение 48 часов после родов, рождаются дети с риском развития ветряной оспы в течение первых трех недель жизни. Новорожденным этим женщинам традиционно вводят иммуноглобулин против опоясывающего лишая (ZIG), чтобы предотвратить заболевание.Однако при спорадической нехватке ZIG у некоторых новорожденных могут развиться неонатальные заболевания. Никакие контролируемые клинические испытания не оценивали терапию этого заболевания ацикловиром; однако специалисты рекомендуют этот препарат для лечения болезней новорожденных.
Доступные методы лечения инфекций HSV и VZV
Ацикловир (Ациклогуанозин, Зовиракс, ACV)
Ацикловир является наиболее часто назначаемым противовирусным средством для лечения инфекций HSV новорожденных и младенцев.Он был доступен для клинического использования в течение почти трех десятилетий и продемонстрировал замечательную безопасность и эффективность против легких и тяжелых инфекций, вызванных HSV и VZV, как у здоровых пациентов, так и у пациентов с ослабленным иммунитетом, включая новорожденных.
Химия и механизм действия
Ацикловир – аналог дезоксигуанозина. После преимущественного поглощения инфицированными вирусом клетками ацикловир фосфорилируется кодируемой вирусом тимидинкиназой (ТК). Последующее ди- и трифосфорилирование катализируется ферментами клетки-хозяина.Ацикловиртрифосфат предотвращает синтез вирусной ДНК, как ингибируя вирусную ДНК-полимеразу, так и являясь терминатором цепи.
Спектр и устойчивость
Ацикловир наиболее активен против ВПГ; активность против VZV также значительна, но примерно в 10 раз меньше. Ацикловир считается препаратом выбора как при неонатальных инфекциях HSV, так и при VZV-инфекциях. Активность против ЦМВ низкая, поскольку ЦМВ не обладает активностью тимидинкиназы, а ДНК-полимераза ЦМВ слабо ингибируется ацикловиртрифосфатом.
Резистентность HSV и VZV к ацикловиру стала важной клинической проблемой среди пациентов с ослабленным иммунитетом, получающих длительную терапию [14]. Устойчивость вирусов к ацикловиру обычно является результатом мутаций в вирусном гене TK, хотя мутации в гене вирусной ДНК-полимеразы также встречаются редко. Резистентные изоляты могут вызывать тяжелые, прогрессирующие, изнурительные заболевания слизистой оболочки у взрослых и, в редких случаях, висцеральное распространение [15, 16]. Изоляты ВПГ, устойчивые к ацикловиру, также были зарегистрированы у здоровых хозяев, чаще всего у пациентов с часто рецидивирующими генитальными инфекциями, которые лечились хроническим ацикловиром [17].
Показания
Ацикловир эффективен для лечения инфекций, вызванных HSV и VZV, у иммунокомпетентных и иммунодефицитных хозяев, включая новорожденных. Для лечения неонатальных инфекций HSV рекомендуемая доза составляет 20 мг / кг / каждые 8 часов. Продолжительность терапии SEM-заболевания составляет 14 дней, в то время как для детей с ЦНС или диссеминированным заболеванием терапию следует продлить на 21 день.
Ацикловир для перорального применения – это экспериментальный подход к супрессивной терапии, который в настоящее время не одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов.
Фармакокинетика
После внутривенного введения доз от 2,5 до 15 мг / кг стабильные концентрации ацикловира колеблются от 6,7 до 20,6 мкг / мл. Ацикловир широко распространен; высокие концентрации достигаются в почках, легких, печени, сердце и кожных пузырьках; концентрации в спинномозговой жидкости (CSF) составляют около 50% от концентрации в плазме [18]. Ацикловир проникает через плаценту и накапливается в грудном молоке. Связывание с белками составляет от 9% до 33%, и менее 20% препарата метаболизируется до биологически неактивных метаболитов.Фармакокинетические данные для новорожденных при применении 20 мг / кг / доза отсутствуют.
При отсутствии нарушения функции почек период полувыведения ацикловира составляет от 2 до 3 часов у детей старшего возраста и взрослых и от 2,5 до 5 часов у новорожденных с нормальным клиренсом креатинина. Более 60% введенного препарата выводится с мочой [18]. Выведение продлевается у пациентов с нарушением функции почек; Период полувыведения составляет приблизительно 20 часов у лиц с терминальной стадией почечной недостаточности, что требует изменения дозы для пациентов с клиренсом креатинина менее 50 мл / мин / л.73 м 2 [19]. Ацикловир эффективно удаляется гемодиализом, но не постоянным амбулаторным перитонеальным диализом [20, 21].
Побочные эффекты
Ацикловир, как правило, является безопасным лекарством. Почечная дисфункция возникает в результате обструктивной нефропатии, вызванной образованием кристаллов ацикловира, осаждающихся в почечных канальцах. Иногда внутривенное введение ацикловира вызывает сыпь, потливость, тошноту, головную боль, гематурию и гипотонию. Высокие дозы внутривенного введения ацикловира (60 мг / кг / день) новорожденным были связаны с нейтропенией [22, 23].
Нейротоксичность может возникать у субъектов с нарушенной функцией почек, которые достигают высоких концентраций препарата в сыворотке [24]. Нейротоксичность проявляется в виде летаргии, спутанности сознания, галлюцинаций, тремора, миоклонуса, судорог, экстрапирамидных признаков и изменений состояния сознания, развивающихся в течение первых нескольких дней после начала терапии. Эти признаки и симптомы обычно проходят спонтанно в течение нескольких дней после прекращения приема ацикловира.
Хотя ацикловир обладает мутагенным действием при высоких концентрациях в некоторых анализах in vitro , он не обладает тератогенным действием на животных.Ограниченные данные о людях позволяют предположить, что использование ацикловира беременными женщинами не связано с врожденными дефектами или другими неблагоприятными исходами беременности.
Лекарственные взаимодействия
Вероятность почечной токсичности ацикловира увеличивается при приеме нефротоксических препаратов, таких как циклоспорин или амфотерицин B.
Терапия врожденной цитомегаловирусной инфекции
Цитомегаловирус (ЦМВ) обычно вызывает у людей серозную инфекцию во всем мире. 40% у подростков и приближается к 90% у взрослых с плохим социально-экономическим статусом [25, 26].Врожденная ЦМВ-инфекция – наиболее распространенная врожденная инфекция в развитых странах, обнаруживаемая примерно у 1% живорожденных младенцев в Соединенных Штатах [27]. Врожденные ЦМВ-инфекции чаще всего возникают при внутриутробной передаче, но, поскольку вирус распространяется с жидкостями организма, передача также может передаваться перинатально во время родов или постнатально через грудное молоко.
Из всех младенцев, рожденных с врожденной ЦМВ-инфекцией, примерно 7–10% имеют клинически очевидное заболевание при рождении [28].Клинические характеристики внутриутробной инфекции включают ограничение внутриутробного развития, гепатоспленомегалию, желтуху, тромбоцитопению, микроцефалию, перивентрикулярные кальцификации и хориоретинит. Согласно обзору Dollard, истинные показатели смертности трудно получить, и, как сообщается, они достигают 30% для младенцев с симптомами [29], но, скорее всего, в среднем составляют около 5–10% [30]. Смерть обычно происходит из-за проявлений инфекции, не связанных с ЦНС, таких как нарушение функции печени или кровотечение. По оценкам, 40–58% младенцев с симптоматической врожденной ЦМВ-инфекцией имеют необратимые последствия, в то время как младенцы, у которых нет симптомов при рождении, страдают необратимыми последствиями почти в 14% случаев [29].Сенсорно-невральная тугоухость (SNHL), умственная отсталость, судороги, задержка психомоторной и речевой активности, нарушение обучаемости, хориоретинит, атрофия зрительного нерва и дефекты зубных рядов являются наиболее частыми долгосрочными последствиями [31]. В отличие от внутриутробных инфекций, перинатально приобретенные ЦМВ-инфекции обычно не связаны с долгосрочными последствиями, хотя сообщалось об острых заболеваниях у недоношенных детей с очень низкой массой тела при рождении [32]. У доношенных детей перинатальные инфекции обычно протекают бессимптомно, но могут проявляться пневмонитом в течение первых нескольких месяцев жизни [33].
Врожденная ЦМВ-инфекция является следствием инфицирования матери и плода, причем большинство симптоматических врожденных случаев возникает из-за бессимптомной материнской инфекции. При материнской первичной инфекции, по-видимому, происходит нарушение плацентарного кровотока после инфицирования плацентарных вилок [34]. Патогенез вовлечения ЦНС в врожденную ЦМВ-инфекцию начинается с диссеминированного распространения виремии, включая эндотелиальные клетки головного мозга и эпителиальные клетки сосудистого сплетения.Из эндотелиальных клеток головного мозга вирус распространяется на смежные астроциты. Из сосудистого сплетения вирус затем перемещается к эпендимным поверхностям через спинномозговую жидкость (CSF). После инфицирования этих клеток вирус подвергается непрерывной репликации, что приводит к характерным внутриядерным тельцам включения и гибели клеток. Поскольку антитела вырабатываются в условиях непрерывной репликации вируса, также образуются иммунные комплексы, что приводит к дальнейшему иммуноопосредованному повреждению [31]. Хотя специфический патогенез SNHL, опосредованного CMV, не выяснен, гистология показала доказательства инфекции в клетках как улиткового, так и вестибулярного эндолабиринта [35].ЦМВ также был выделен из перилимфы улитки при вскрытии новорожденных с врожденной ЦМВ-инфекцией [36].
Недавние исследования лечения ганцикловиром врожденных ЦМВ-инфекций с поражением ЦНС были многообещающими. Введение ганцикловира в дозах 12 мг / кг / день, разделенных каждые 12 часов в течение 6 недель, улучшило исходы слуха у новорожденных с симптоматической врожденной ЦМВ-инфекцией с поражением ЦНС (о чем свидетельствуют микроцефалия, внутричерепные кальцификации, аномалии спинномозговой жидкости для возраста, хориоретинит и др.) / или нарушения слуха) [37].Первичной конечной точкой был улучшенный ответ, вызванный стволом мозга (BSER) между исходным уровнем и 6-месячным периодом наблюдения (или отсутствие ухудшения в течение 6-месячного периода наблюдения, если исходный BSER был нормальным). Что касается общего количества ушей, подлежащих оценке, 69% пациентов, получавших ганцикловир, достигли первичной конечной точки по сравнению с 39% в контрольной группе. Ни у одного пациента, получавшего ганцикловир, не было ухудшения слуха между исходным уровнем и 6 мес. У реципиентов ганцикловира также отмечалось более быстрое разрешение нарушений АЛТ, чем в контрольной группе, хотя вероятность развития нейтропении у них была значительно выше.Дополнительный анализ этого рандомизированного контролируемого исследования позволяет предположить, что ганцикловир может также уменьшать задержки в развитии нервной системы [38]. Улучшение смертности при терапии ганцикловиром пока не показано.
Лечение ЦМВ-инфекций
Ганцикловир (Цитовен)
Ганцикловир был первым противовирусным препаратом, доступным для терапии и профилактики инфекций, вызванных ЦМВ. Доказано, что это очень ценный препарат для пациентов с ослабленным иммунитетом, особенно для пациентов с рецептами трансплантации гемопоэтических стволовых клеток, которые страдают от значительной заболеваемости и смертности от ЦМВ-инфекций, а в последнее время – для детей с врожденной ЦМВ-инфекцией, хотя и не одобрено Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США. Администрация (FDA) в настоящее время.
Химия и механизм действия
Ганцикловир структурно похож на ацикловир, за исключением гидроксиметильной группы на его ациклической боковой цепи. Первоначальный этап фосфорилирования осуществляется pUL97, вирусной протеинкиназой. Затем клеточные киназы фосфорилируют агент еще два раза, чтобы преобразовать его в его трифосфатное производное, которое способно ингибировать ДНК-полимеразу ЦМВ, кодируемую UL97 , а также встраиваться в вирусную ДНК и обрывать ее.
Ганцикловир трифосфат – конкурентный ингибитор герпесвирусных ДНК-полимераз, приводящий к прекращению удлинения цепи ДНК [1, 20].
Спектр и устойчивость
Ганцикловир имеет сходную с ацикловиром активность против HSV-1, HSV-2 и VZV, но, в отличие от ацикловира, его наибольшая активность против CMV. Устойчивость изолятов ЦМВ обычно возникает в результате мутаций в гене UL97 [39]. Мутации в гене ДНК-полимеразы ЦМВ встречаются реже. Показания .Ганцикловир лицензирован по нескольким показаниям за пределами новорожденных. В нескольких обзорах резюмируются эти клинические исходы [2]. Для лечения новорожденных, врожденно инфицированных ЦМВ, было проведено контролируемое исследование [40]. Как отмечалось выше, по сравнению с отсутствием лечения терапия ганцикловиром предотвращала ухудшение слуха через два года, хотя примерно у двух третей пролеченных младенцев развилась нейтропения, часто требующая изменения дозы.
Фармакокинетика
Биодоступность ганцикловира при пероральном приеме низкая, при пероральном приеме всасывается менее 10% препарата [41, 42].Пероральный препарат ганцикловира больше не продается. Пиковые концентрации ганцикловира в сыворотке после введения 6 мг / кг (доза для новорожденных) внутривенно вводимого лекарственного средства колеблются от 8 до 11 мкг / мл с концентрациями, достаточными для подавления чувствительных штаммов ЦМВ в водянистой влаге, субретинальной жидкости, спинномозговой жидкости и ткани мозга [ 1]. Период полувыведения ганцикловира составляет от 2 до 3 часов, и большая часть препарата выводится в неизмененном виде с мочой. Фармакокинетика ганцикловира в популяции новорожденных аналогична таковой у взрослых [43, 44].Снижение дозы, пропорциональное степени снижения клиренса креатинина, необходимо лицам с нарушением функции почек. Дополнительная доза рекомендуется после диализа, поскольку она эффективно удаляется гемодиализом [45].
Побочные эффекты
Миелосупрессия – наиболее частое побочное действие ганцикловира; Дозозависимая нейтропения (менее 1000 лейкоцитов / мкл) является наиболее стойким гематологическим отклонением с частотой около 40% [42]. Нейтропения ограничивает дозу примерно в одном из семи курсов и исчезает после прекращения приема препарата.При пероральном приеме ганцикловира нейтропения возникает реже. Тромбоцитопения (менее 50 000 тромбоцитов / мкл) встречается примерно у 20%, а анемия – примерно у 2% реципиентов ганцикловира. От 2 до 5% реципиентов ганцикловира испытывают головную боль, спутанность сознания, изменение психического статуса, галлюцинации, кошмары, беспокойство, атаксию, тремор, судороги. лихорадка, сыпь и аномальные уровни сывороточных печеночных ферментов по отдельности или в некоторой комбинации.
Дозировка
Доза ганцикловира для лечения симптоматической врожденной ЦМВ-инфекции составляет 12 мг / кг / день внутривенно дважды в день в течение 6 недель.
Исследуемый препарат
Валганцикловир (Valcyte)
Валганцикловир был одобрен FDA в марте 2001 г. для лечения ЦМВ-ретинита. Поскольку он хорошо всасывается после перорального приема, он может представлять собой благоприятный вариант по сравнению с внутривенным введением ганцикловира для лечения врожденной ЦМВ-инфекции. В настоящее время он лицензирован для лечения ЦМВ-инфекций в отдельных популяциях трансплантатов и ЦМВ-ретинита у пациентов с ВИЧ / СПИДом.
Химия, механизм действия, спектр и устойчивость
Валганцикловир является пролекарством ганцикловира на основе эфира L-валина и, как таковой, имеет тот же механизм действия, противовирусный спектр и потенциал развития устойчивости, что и ганцикловир [1, 20] .
Показания
Валганцикловир имеет аналогичные показания к ганцикловиру. Однако, основываясь на опубликованных на сегодняшний день ограниченных контролируемых исследованиях, в настоящее время он одобрен для индукционной и поддерживающей терапии ЦМВ-ретинита и для отдельных популяций трансплантатов [46].В настоящее время исследуется возможность лечения врожденной ЦМВ-инфекции. В этом рандомизированном контролируемом исследовании, проводимом Группой по совместным антивирусным исследованиям (CASG) Национального института аллергии и инфекционных заболеваний (NIAID), в качестве основной конечной точки используется SNHL.
Фармакокинетика
Валганцикловир быстро превращается в ганцикловир со средним периодом полувыведения из плазмы около 30 минут [46]. Абсолютная биодоступность валганцикловира превышает 60% и фактически увеличивается примерно на 30% при одновременном приеме пищи [47].Площадь под кривой ганцикловира после перорального приема валганцикловира составляет от одной трети до половины площади, полученной после внутривенного введения ганцикловира. Пациентам с нарушением функции почек требуется снижение дозировки, примерно пропорциональное снижению клиренса креатинина.
Побочные эффекты
Наиболее частые побочные эффекты, связанные с терапией валганцикловиром у взрослых, включают диарею (41%), тошноту (30%), нейтропению (27%), анемию (26%) и головную боль (22%) [ 46].Лишь ограниченное число новорожденных получали терапию валганцикловиром. Единственным значимым открытием была нейтропения у 15% пациентов.
Дозировка
Доза валганцикловира зависит от возраста пациента и функции почек. В настоящее время препарат не разрешен к применению у новорожденных с врожденной ЦМВ-инфекцией.
Непроверенные и непроверенные методы лечения неонатальных инфекций HSV, VZV и врожденных CMV-инфекций
Следующие два препарата используются для лечения HSV, VZV и CMV инфекций у детей старшего возраста и взрослых.Данные об этих препаратах предоставляются, если у новорожденных возникает устойчивость к противовирусным препаратам при инфекциях ВПГ или ЦМВ. Ни один из препаратов не был оценен в рамках доказательных исследований на новорожденных, и оба связаны со значительной токсичностью. Кроме того, валацикловир может стать доступным для педиатрического применения, особенно для младенцев с инфекцией HSV, ограниченной кожей, глазами и ртом
Цидофовир (HPMPC, Vistide)
Цидофовир был впервые одобрен для использования в США для лечения СПИДа -ассоциированный ретинит, вызванный ЦМВ.Это остается основным показанием к применению этого противовирусного препарата.
Химия и механизм действия
Цидофовир – это новый аналог ациклических фосфонатных нуклеозидов с механизмом действия, аналогичным другим аналогам нуклеозидов. В отличие от ацикловира, вирусные ферменты не требуются для начального фосфорилирования, поскольку нативный цидофовир уже имеет одну присоединенную фосфатную группу. После дифосфорализации клеточными киназами цидофовир конкурентно ингибирует ДНК-полимеразу [48].Активная форма цидофовира проявляет в 25-50 раз большее сродство к вирусной ДНК-полимеразе по сравнению с клеточной ДНК-полимеразой.
Спектр и устойчивость
Цидофовир активен против ВПГ и ЦМВ, включая устойчивые к ацикловиру и фоскарнету изоляты ВПГ и мутанты ЦМВ, устойчивые к ганцикловиру и фоскарнету [49]. Он также активен in vitro против VZV, EBV, вируса герпеса человека-6, вируса герпеса человека-8, полиомавирусов, аденовируса и ВПЧ человека.
Было описано небольшое количество устойчивых к цидофовиру изолятов ЦМВ, которые также устойчивы к ганцикловиру на основе мутаций в гене ДНК-полимеразы [50].Сообщалось также о мутанте ЦМВ, устойчивом к ганцикловиру, фоскарнету и цидофовиру [51].
Показания
Цидофовир замедляет прогрессирование заболевания сетчатки у пациентов со СПИДом [52, 53]. Цидофовир также был полезен при лечении заболеваний, вызванных устойчивыми к ацикловиру изолятами ВПГ [54]. Были опубликованы отдельные сообщения об улучшении папилломатоза гортани после инъекции цидофовира в очаг поражения, но на основании этого ограниченного опыта невозможно сделать окончательные выводы об эффективности [55, 56].
Фармакокинетика
Только 2–26% цидофовира всасывается после перорального приема, поэтому его вводят внутривенно. Период полувыведения цидофовира из плазмы составляет 2,6 часа, но период полураспада активных внутриклеточных метаболитов цидофовира составляет от 17 до 48 часов [ 57]. Девяносто процентов препарата выводится с мочой, в основном с секрецией почечных канальцев [58]. Важно отметить, что препарат не проникает через гематоэнцефалический барьер и, следовательно, не должен использоваться для лечения инфекций ЦНС.
Побочные эффекты
Поскольку цидофовир концентрируется в почечных клетках в количествах в 100 раз больше, чем в других тканях, нефротоксичность является основным побочным эффектом, особенно если гидратация не поддерживается [57, 58].Проявления почечной токсичности включают протеинурию и глюкозурию. Агрессивная внутривенная прегидратация, одновременное введение пробенецида и избегание других нефротоксических агентов снижают вероятность токсичности. Цидофовир противопоказан пациентам с креатинином сыворотки> 1,5 мг / дл, расчетным клиренсом креатинина ≤ 55 мл / мин или белком мочи ≥ 100 мг / дл, и препарат следует отменить, если креатинин сыворотки повышается на ≥ 0,5 мг / дл выше исходного уровня. .
Дозировка
Цидофовир вводят внутривенно детям старшего возраста и взрослым в дозе 5 мг / кг один раз в неделю с пробенецидом.Пациенты с нарушением функции почек (расчетный клиренс креатинина <55 мл / мин) проходят лечение каждые 2 недели. Дозу следует уменьшить с 5 мг / кг до 3 мг / кг, если креатинин сыворотки повышается на> 0,3 мг / дл выше исходного уровня. Данных о дозировании цидофовира новорожденным нет.
Фоскарнет (PFA, Foscavir)
Фоскарнет – единственный противогерпетический препарат, не являющийся аналогом нуклеозидов. Это не препарат первой линии, но он полезен для лечения инфекций, вызванных устойчивыми вирусами герпеса.
Химия и механизм действия
Фоскарнет – неорганический аналог пирофосфата, который напрямую ингибирует ДНК-полимеразу, блокируя сайт связывания пирофосфата [20, 59].
Спектр и устойчивость
Фоскарнет ингибирует все известные герпесвирусы человека, включая большинство устойчивых к ганцикловиру изолятов ЦМВ и устойчивые к ацикловиру штаммы ВПГ и ВЗВ. Он также активен против ВИЧ. Устойчивость возникает в результате мутаций ДНК-полимеразы. Сообщалось о штаммах CMV, HSV и VZV с пониженной чувствительностью к фоскарнету [59, 60].
Показания
Фоскарнет так же эффективен, как и ганцикловир, для лечения угрожающего зрению хориоретинита, вызванного ЦМВ, у взрослых пациентов со СПИДом [61]. Из-за присущей ему активности против ВИЧ, он может даже обеспечить преимущество в выживаемости для пролеченных пациентов [62]. Рефрактерные случаи хориоретинита могут поддаваться лечению комбинацией фоскарнета и ганцикловира. Фоскарнет также эффективен при терапии ЦМВ-инфекций, вызванных ганцикловир-резистентными штаммами вируса [62]. Ограниченные данные также предполагают, что фоскарнет может быть полезным при назначении пациентам со СПИДом, у которых есть желудочно-кишечные и легочные инфекции, вызванные ЦМВ.
Инфекции, вызванные устойчивыми к ацикловиру штаммами HSV и VZV, успешно контролируются с помощью фоскарнета [63, 64].
Фармакокинетика
Только около 20% фоскарнета абсорбируется после перорального приема. Максимальная концентрация в сыворотке, достигаемая после внутривенного введения 60 мг / кг, составляет примерно 500 мкмоль / л [59]. Концентрация в спинномозговой жидкости составляет около двух третей от концентрации в сыворотке. Период полувыведения фоскарнета составляет около 48 часов, и 80% введенной дозы выводится в неизмененном виде с мочой.Необходимо снижение дозы пропорционально уменьшению клиренса креатинина. Гемодиализ эффективно устраняет фоскарнет, поэтому после диализа рекомендуется дополнительная доза [65]. Данных о применении фоскарнета новорожденным нет.
Побочные эффекты
Наиболее частыми побочными эффектами фоскарнета являются нефротоксичность и метаболические нарушения. Доказательства нефротоксичности включают азотемию, протеинурию, острый некроз канальцев, кристаллурию и интерстициальный нефрит.Концентрация креатинина в сыворотке увеличивается до 50% пациентов. К счастью, функция почек приходит в норму в течение 2–4 недель после прекращения терапии. Существующее ранее заболевание почек, одновременный прием других нефротоксических препаратов, обезвоживание, быстрое введение или непрерывное внутривенное вливание препарата являются факторами риска развития почечной дисфункции [66]. Метаболические нарушения, связанные с терапией фоскарнетом, включают гипо- и гиперкальциемию, а также гипо- и гиперфосфатемию [67]. Гипокальциемия может быть связана с парестезиями, тетанией, судорогами и аритмиями.Метаболические нарушения сводятся к минимуму, если вводить фоскарнет медленной инфузией. Симптомы со стороны ЦНС, связанные с терапией фоскарнетом, включают головную боль, тремор, раздражительность, судороги и галлюцинации. Сообщалось также о лихорадке, тошноте, рвоте, аномальных ферментах сыворотки крови, анемии, гранулоцитопении и генитальных изъязвлениях.
Лекарственные взаимодействия
Одновременное применение амфотерицина B, циклоспорина, гентамицина и других нефротоксических препаратов увеличивает вероятность нарушения функции почек.Одновременный прием пентамидина увеличивает риск гипокальциемии. Анемия и нейтропения чаще встречаются, когда пациенты также получают зидовудин.
Дозировка
Обычная доза фоскарнета при ЦМВ-инфекции составляет 180 мг / кг / день в три приема в течение 14–21 дней, после чего следует ежедневная поддерживающая доза от 90 до 120 мг / кг. Дозировка фоскарнета, используемого при инфекциях, вызванных устойчивыми к ацикловиру HSV и VZV, составляет 120 мг / кг / день в три приема.
Резюме
Несмотря на то, что в лечении врожденных ЦМВ и неонатальных инфекций ВПГ достигнут значительный прогресс, дальнейшие достижения являются обязательными.С появлением новых противовирусных препаратов, обладающих другим механизмом действия, появляется возможность для комбинированной терапии, если можно доказать, что лекарства безопасны.
Выражение признательности
Этот проект полностью или частично финансируется за счет федеральных средств Национального института аллергии и инфекционных заболеваний, Национальных институтов здравоохранения, Министерства здравоохранения и социальных служб, по контракту № N01-AI-30025.
Сноски
Заявление издателя: Это PDF-файл неотредактированной рукописи, принятой к публикации.В качестве услуги для наших клиентов мы предоставляем эту раннюю версию рукописи. Рукопись будет подвергнута копированию, верстке и рассмотрению полученного доказательства, прежде чем она будет опубликована в окончательной форме для цитирования. Обратите внимание, что во время производственного процесса могут быть обнаружены ошибки, которые могут повлиять на содержание, и все юридические оговорки, относящиеся к журналу, имеют отношение.
Список литературы
1. Кимберлин Д. Противовирусные агенты. В: Лонг С., Пикеринг Л., Пробер С., редакторы. Принципы и практика детских инфекционных болезней.3-е изд. Нью-Йорк: Эльзевир; 2008. С. 1470–1488. [Google Scholar] 2. Ра Б., Кимберлин Д. В., Уитли Р. Противовирусные препараты. В: Джером К., редактор. Лабораторная диагностика вирусных инфекций. 3-е изд. Нью-Йорк: Informa Healthcare; 2009. [Google Scholar] 3. Brown ZA, Wald A, Morrow RA, Selke S, Zeh J, Corey L. Влияние серологического статуса и кесарева сечения на скорость передачи вируса простого герпеса от матери к ребенку. ДЖАМА. 2003. 289 (2): 203–209. [PubMed] [Google Scholar] 4. Уитли Р.Дж. Вирус простого герпеса.В: Scheld MW, Whitley RJ, Marra CM, редакторы. Инфекции центральной нервной системы. 3-е изд. Филадельфия: Липпинкотт Уильямс и Уилкинс; 2004. С. 123–144. [Google Scholar] 5. Kimberlin DW, Lin CY, Jacobs RF, Powell DA, Frenkel LM, Gruber WC, et al. Естественная история инфекций, вызванных вирусом простого герпеса новорожденных, в эпоху ацикловира. Педиатрия. 2001. 108 (2): 223–229. [PubMed] [Google Scholar] 6. Kimberlin DW. Ведение энцефалита, вызванного вирусом простого герпеса, у взрослых и новорожденных: диагностика, прогноз и лечение.Герпес. 2007 июн; 14 (1): 11–16. [PubMed] [Google Scholar] 7. Хатто С., Арвин А., Джейкобс Р., Стил Р., Стагно С., Лайрин Р. и др. Внутриутробные инфекции, вызванные вирусом простого герпеса. Журнал педиатрии. 1987. 110 (1): 97–101. [PubMed] [Google Scholar] 8. Уитли Р.Дж. Инфекции, вызванные вирусом простого герпеса. В: Remington JS, Klein JO, редакторы. Инфекционные болезни плода и новорожденных. 3-е изд. Филадельфия: W.B. Компания Сондерс; 1990. С. 282–305. [Google Scholar] 9. Уитли Р.Дж., Кори Л., Арвин А., Лейкман Ф.Д., Сумая К.В., Райт П.Ф. и др.Изменение представления инфекции вируса простого герпеса у новорожденных. Журнал инфекционных болезней. 1988. 158 (1): 109–116. [PubMed] [Google Scholar] 10. Уитли Р.Дж., Ройзман Б. Вирусы простого герпеса. В: Ричман Д.Д., Уитли Р.Дж., Хайден Ф.Г., редакторы. Клиническая вирусология. 2-е изд. Вашингтон, округ Колумбия: ASM Press; 2004. С. 375–401. [Google Scholar] 11. Уитли Р., Арвин А., Пробер С., Берчетт С., Кори Л., Пауэлл Д. и др. Контролируемое испытание по сравнению видарабина с ацикловиром при неонатальной инфекции вирусом простого герпеса.Медицинский журнал Новой Англии. 1991. 324 (7): 444–449. [PubMed] [Google Scholar] 12. Kimberlin DW, Lin CY, Jacobs RF, Powell DA, Corey L, Gruber WC, et al. Безопасность и эффективность высоких доз внутривенного ацикловира при лечении инфекций, вызванных вирусом простого герпеса у новорожденных. Педиатрия. 2001. 108 (2): 230–238. [PubMed] [Google Scholar] 13. Кимберлин Д., Уитли Р., Ван В., Пауэлл Д., Сторч Г., Ахмед А. и др. Влияние перорального подавления ацикловира на исходы развития нервной системы и рецидивы кожи после неонатальной болезни, вызванной вирусом простого герпеса.NEJM. 2011 В печати. [Google Scholar] 14. Englund JA, Zimmerman ME, Swierkosz EU, Goodman JL, Scholl D, Balfour HH. Вирус простого герпеса устойчив к ацикловиру. Исследование в центре третичной медицинской помощи. Ann Intern Med. 1990; 112: 416–422. [PubMed] [Google Scholar] 15. Полевой АК, Бирон К.К. Возвращение к «концу невинности»: устойчивость герпесвирусов к противовирусным препаратам. Clin Microbiol Rev.1994, январь; 7 (1): 1–13. [Бесплатная статья PMC] [PubMed] [Google Scholar] 16. Лайалл Э.Г., Огилви М.М., Смит Н.М., Бернс С. Устойчивость к ацикловиру ветряной оспы и ВИЧ-инфекция.Arch Dis Child. 1994 Февраль; 70 (2): 133–135. [Бесплатная статья PMC] [PubMed] [Google Scholar] 17. Морфин Ф, Тувено Д. Устойчивость вируса простого герпеса к противовирусным препаратам. J Clin Virol. 2003 Янв; 26 (1): 29–37. [PubMed] [Google Scholar] 18. Wagstaff AJ, Faulds D, Goa Kl. Ацикловир. Переоценка его противовирусной активности, фармакокинетических свойств и терапевтической эффективности. Наркотики. 1994; 47: 153–205. [PubMed] [Google Scholar] 19. Ласкин О.Л., Лонгстрет Дж. А., Велтон А., Красный Х. С., Кини Р. Э., Рокко Л. и др. Влияние почечной недостаточности на фармакокинетику ацикловира.Am J Med. 20 июля 1982 г.; 73 (1A): 197–201. [PubMed] [Google Scholar] 20. Инь М., Браст Дж., Тиеу Х., Хаммер С. Антигепатитные и противодыхательные вирусные агенты. В: Ричман Д., Уитли Р., Хайден Ф., редакторы. Клиническая вирусология. Вашингтон, округ Колумбия: ASM Press; 2009. С. 217–264. [Google Scholar] 21. Красный ХК, Ляо С.Х., де Миранда П., Ласкин О.Л., Велтон А., Литман П.С. Влияние гемодиализа на фармакокинетику ацикловира у пациентов с хронической почечной недостаточностью. Am J Med. 20 июля 1982 г.; 73 (1A): 202–204. [PubMed] [Google Scholar] 22.Кимберлин Д., Пауэлл Д., Грубер В., Диаз П., Арвин А., Кумар М. и др. Назначение пероральной супрессивной терапии ацикловиром после неонатальной болезни, вызванной вирусом простого герпеса, с поражением кожи, глаз и рта: результаты тирала фазы I / II. Pediatr Infect Dis J. 1996; 15: 247–254. [PubMed] [Google Scholar] 23. Kimberlin DW, Lin CY, Jacobs RF, Powell DA, Corey L, Gruber WC, et al. Безопасность и эффективность высоких доз внутривенного ацикловира при лечении инфекций, вызванных вирусом простого герпеса у новорожденных. Педиатрия.2001 август; 108 (2): 230–238. [PubMed] [Google Scholar] 24. Реванкар С.Г., Эпплгейт А.Л., Марковиц Д.М. Делирий, связанный с лечением ацикловиром у пациента с почечной недостаточностью. Clin Infect Dis. 1995 августа; 21 (2): 435–436. [PubMed] [Google Scholar] 25. Гриффитс П.Д., Эмери В.К. Цитомегаловирус. В: Ричман Д.Д., Уитли Р.Дж., Хайден Ф.Г., редакторы. Клиническая вирусология. 2-е изд. Вашингтон, округ Колумбия: ASM Press; 2002. С. 433–461. [Google Scholar] 26. Старас С.А., Доллард СК, Рэдфорд К.В., Фландрия В.Д., Пасс РФ, Кэннон М.Дж. Распространенность цитомегаловирусной инфекции в США: 1988–1994 гг.Clin Infect Dis. 2006 г., 1 ноября; 43 (9): 1143–1151. [PubMed] [Google Scholar] 27. Demmler GJ. Американское общество инфекционных болезней и Центры по контролю за заболеваниями. Резюме семинара по надзору за врожденными цитомегаловирусными заболеваниями. Обзоры инфекционных болезней. 1991. 13 (2): 315–329. [PubMed] [Google Scholar] 28. Conboy TJ, Pass RF, Stagno S, Alford CA, Myers GJ, Britt WJ и др. Ранние клинические проявления и интеллектуальный исход у детей с симптоматической врожденной цитомегаловирусной инфекцией.Журнал педиатрии. 1987. 111 (3): 343–348. [PubMed] [Google Scholar] 29. Доллард СК, Гроссе С.Д., Росс Д.С. Новые оценки распространенности неврологических и сенсорных последствий и смертности, связанных с врожденной цитомегаловирусной инфекцией. Rev Med Virol. 1 июня 2007 г .; [PubMed] [Google Scholar] 30. Росс С.А., Боппана С.Б. Врожденная цитомегаловирусная инфекция: исход и диагноз. Semin Pediatr Infect Dis. 2005 Янв; 16 (1): 44–49. [PubMed] [Google Scholar] 31. Гриффитс PD, Маклафлин JE. Цитомегаловирус.В: Scheld WM, Whitley RJ, Marra CM, редакторы. Инфекции центральной нервной системы. Филадельфия: Липпинкотт Уильямс и Уилкинс; 2004. С. 159–173. [Google Scholar] 32. Машманн Дж., Хампрехт К., Дитц К., Ян Дж., Шпеер С.П. Цитомегаловирусная инфекция младенцев с крайне низкой массой тела при рождении через грудное молоко. Клинические инфекционные болезни. 2001; 33 (12): 1998–2003. [PubMed] [Google Scholar] 33. Brasfield DM, Stagno S, Whitley RJ, Cloud G, Cassell G, Tiller RE. Детский пневмонит, связанный с цитомегаловирусом, хламидиозом, пневмоцистом и уреаплазмой.Педиатрия. 1987. 79: 76–83. [PubMed] [Google Scholar] 34. Перейра Л., Майджи Э. Цитомегаловирусная инфекция в плаценте человека: материнский иммунитет и рецепторы, регулируемые развитием трофобластов, сходятся. Актуальные темы микробиологии и иммунологии. 2008. 325: 383–395. [PubMed] [Google Scholar] 35. Штраус М. Цитомегаловирусный лабиринтит человека. Am J Otolaryngol. Сентябрь – октябрь 1990 г., 11 (5): 292–298. [PubMed] [Google Scholar] 36. Дэвис Л.Е., Джонссон Л.Г., Корнфельд М. Цитомегаловирусный лабиринтит у младенцев: морфологические, вирусологические и иммунофлуоресцентные исследования.J Neuropathol Exp Neurol. 1981, январь; 40 (1): 9–19. [PubMed] [Google Scholar] 37. Kimberlin DW, Lin CY, Sanchez PJ, Demmler GJ, Dankner W, Shelton M и др. Влияние терапии ганцикловиром на слух при симптоматическом врожденном цитомегаловирусном заболевании с поражением центральной нервной системы: рандомизированное контролируемое исследование. Журнал педиатрии. 2003. 143 (1): 16–25. [PubMed] [Google Scholar] 38. Оливер С., Клауд Дж., Санчес П., Деммлер Дж., Данкнер В., Шелтон М. и др. Влияние терапии ганцикловиром (GCV) на исходы нервного развития при симптоматических врожденных цитомегаловирусных (CMV) инфекциях с поражением центральной нервной системы (ЦНС): рандомизированное контролируемое исследование.Ежегодное собрание Общества педиатрических исследований (SPR); 2006 29 апреля; Сан-Франциско, Калифорния. 2006. с. Реферат № 752908. [Google Scholar] 39. Маркхам А., Фолдс Д. Ганцикловир: обновление его терапевтического использования при цитомегаловирусной инфекции. Наркотики. 1994; 48: 455. [PubMed] [Google Scholar] 40. Kimberlin DW, Lin C-Y, Sanchez PJ, Demmler GJ, Dankner W, Shelton MD, et al. Влияние ганцикловира на слух при симптоматическом врожденном цитомегаловирусном заболевании с поражением центральной нервной системы: рандомизированное контролируемое исследование.J Pediatr. 2003. 143: 16–25. [PubMed] [Google Scholar] 41. Редди В., Хао Ю., Липтон Дж., Мехарчанд Дж., Минден М., Мацзулли Т. и др. Ведение реципиентов аллогенного трансплантата костного мозга с риском цитомегаловирусной болезни с использованием контрольной бронхоскопии и длительной упреждающей терапии ганцикловиром. J Clin Virol. 1999, август; 13 (3): 149–159. [PubMed] [Google Scholar] 42. Jacobson MA, Gambertoglio JG, Aweeka FT, Causey DM, Portale AA. Гипокальциемия, вызванная фоскарнетом, и влияние фоскарнета на метаболизм кальция.J Clin Endocrinol Metab. 1991 Май; 72 (5): 1130–1135. [PubMed] [Google Scholar] 43. Френкель Л.М., Каппарелли Е.В., Данкнер В.М., Сюй Дж., Смит И.Л., Баллоу А. и др. Ганцикловир для приема внутрь у детей: фармакокинетика, безопасность, переносимость и противовирусное действие. Группа педиатрических клинических испытаний СПИДа. Журнал инфекционных болезней. 2000 декабрь; 182 (6): 1616–1624. [PubMed] [Google Scholar] 44. Транг Дж. М., Кидд Л., Грубер В., Сторч Дж., Деммлер Дж., Джейкобс Р. и др. Линейная фармакокинетика однократной дозы ганцикловира у новорожденных с врожденными цитомегаловирусными инфекциями.Clin Pharmacol Ther. 1993; 53: 15–21. [PubMed] [Google Scholar] 45. Свон С.К., Мунар М.Ю., Виггер М.А., Беннетт В.М. Фармакокинетика ганцикловира у пациента, находящегося на гемодиализе. Am J Kidney Dis. 1991, январь; 17 (1): 69–72. [PubMed] [Google Scholar] 46. Cocohoba JM, McNicholl IR. Валганцикловир: прогресс в лечении цитомегаловирусов. Энн Фармакотер. 2002 июн; 36 (6): 1075–1079. [PubMed] [Google Scholar] 47. Юнг Д., Дорр А. Фармакокинетика однократной дозы валганцикловира у ВИЧ- и ЦМВ-серопозитивных субъектов.J Clin Pharmacol. 1999, август; 39 (8): 800–804. [PubMed] [Google Scholar] 48. Хо Х.Т., Вудс К.Л., Бронсон Дж. Дж., Де Бок Х., Мартин Дж. К., Хичкок МД. Внутриклеточный метаболизм антигерпетических средств -1- {3-гидрокси-2- (фосфонилметокси) пропил} цитозин. Mol Pharmacol. 1992; 41: 197–202. [PubMed] [Google Scholar] 49. Сафрин С, Черрингтон Дж, Джаффе Х.С. Клиническое использование цидофовира. Rev Med Virol. 1997 сентябрь; 7 (3): 145–156. [PubMed] [Google Scholar] 50. Lurain N, Spafford LE, Thompson KD. Мутация в открытой рамке считывания UL97 штаммов цитомегаловируса человека, устойчивых к ганцикловиру.Журнал вирусологии. 1994b; 68: 4427–4431. [Бесплатная статья PMC] [PubMed] [Google Scholar] 51. Черрингтон Дж. М., Майнер Р., Аллен С. Дж. У. и др. Сенситивы клинических изолятов цитомегаловируса человека (HCMV) к цидофовиру. Восьмая международная конференция по противовирусным исследованиям; 1995 г. 23–28 апреля; Санта-Фе, Нью-Мексико. 1995. [Google Scholar] 52. Исследования глазных осложнений Группы исследований СПИДа в сотрудничестве с Группой клинических испытаний СПИДа. Цидофовир (HPMPC) для лечения цитомегаловирусного ретинита у пациентов со СПИДом: исследование периферического цитомегаловирусного ретинита HPMPC.Ann Intern Med. 1997. 126: 264–274. [PubMed] [Google Scholar] 53. Lalezari JP, Staagg RJ, Kuppermann BD, Holland GN, Kramer F, Ives DV, et al. Внутривенное введение цидофовира при периферическом цитомегаловирусном ретините у пациентов со СПИДом: рандомизированное контролируемое исследование. Ann Intern Med. 1997. 126: 257–263. [PubMed] [Google Scholar] 54. Лалезари Дж. П., Дрю В. Л., Глутцер Э., Майнер Д., Сафрин С., Оуэн В. Ф., младший и др. Лечение внутривенным (S) -1- [3-гидрокси-2- (фосфонилметокси) пропил) -цитозином ацикловир-резистентной кожно-слизистой инфекции вирусом простого герпеса у пациента со СПИДом.Журнал инфекционных болезней. 1994; 170: 570–572. [PubMed] [Google Scholar] 55. Кимберлин DW, Малис DJ. Рецидивирующий респираторный папилломатоз с юношеским началом: возможности успешной противовирусной терапии. Antiviral Res. 2000 Февраль; 45 (2): 83–93. [PubMed] [Google Scholar] 56. Прански С.М., Магит А.Е., Кернс Д.Б., Канг Д.Р., Дункан Н.О. Цидофовир внутриочаговый при рецидивирующем респираторном папилломатозе у детей. Arch Otolaryngol Head Neck Surg. 1999 Октябрь; 125 (10): 1143–1148. [PubMed] [Google Scholar] 57. Канди К.С., Петти Б.Г., Флаэрти Дж., Фишер П.Е., Полис М.А., Ваксман М. и др.Клиническая фармакокинетика цидофовира у пациентов, инфицированных вирусом иммунодефицита человека. Противомикробные агенты Chemother. 1995; 39: 1247–1252. [Бесплатная статья PMC] [PubMed] [Google Scholar] 58. Лалезари Дж. П., Дрю В. Л., Глутцер Э., Джеймс С., Майнер Д., Флаэрти Дж. И др. (S) -1 {3-гидрокси-2- (фосфонилметокси) пропил} цитозин (цидофовиир): результаты исследования фазы I / II нового противовирусного аналога нуцелотида. Журнал инфекционных болезней. 1995; 171: 788–796. [PubMed] [Google Scholar] 59. Wagstaff AJ, Bryson HM.Фоскарнет: переоценка его противовирусной активности, фармакокинетических свойств и терапевтического использования у пациентов с ослабленным иммунитетом и вирусной инфекцией. Наркотики. 1994. 48: 199–226. [PubMed] [Google Scholar] 60. Сафрин С., Кеммерли С., Плоткин Б., Смит Т., Вайсбах Н., Де Веранес Д. и др. Инфекция, вызванная устойчивым к фоскарнету вирусом простого герпеса, у больных СПИДом. Журнал инфекционных болезней. 1994; 169: 193–196. [PubMed] [Google Scholar] 61. Снок Р., Андрей Г., Джерард М., Сильверман А., Хеддерман А., Бальзарини Дж. И др.Успешное лечение прогрессирующей кожно-слизистой инфекции, вызванной устойчивым к ацикловиру и фоскарнету вирусом простого герпеса, с помощью (S) -1- (3-гидрокси-2-фосфонилметоксипропил) цитозина (HPMPC) Clin Infect Dis. 1994 Апрель; 18 (4): 570–578. [PubMed] [Google Scholar] 62. Якобсон М.А., Дрю В.Л., Файнберг Дж., О’Доннелл Дж. Дж., Уитмор П.В., Майнер Р.Д. и др. Терапия фоскарнетом при ганцикловиррезистентном цитомегаловирусном ретините у больных СПИДом. Журнал инфекционных болезней. 1991; 163: 1348–1351. [PubMed] [Google Scholar] 63.Сафрин С., Бергер Т.Г., Гилсон И. Терапия фоскарнетом у пяти пациентов со СПИДом и инфекцией вируса ветряной оспы, устойчивой к ацикловиру. Ann Intern Med. 1991; 115: 19–21. [PubMed] [Google Scholar] 64. Исследования глазных осложнений исследовательской группы СПИДа. Смертность у пациентов с синдромом приобретенного иммунодефицита, получавших фоскарнет или ганцикловир от цитомегаловируса ретинита. N Engl J Med. 1992; 326: 213–220. [PubMed] [Google Scholar] 65. Сафрин С., Крампакер С., Чатис П., Дэвис Р., Хафнер Р., Раш Дж. И др.Контролируемое исследование по сравнению фоскарнета и видарабина при лечении ацикловир-резистентного кожно-слизистого простого герпеса при синдроме приобретенного иммунодефицита. N Engl J Med. 1991; 325: 551–555. [PubMed] [Google Scholar] 66. МакГрегор Р. Р., Грациани А. Л., Вайс Р., Грюнвальд Дж. Э., Гамбертольо Дж. Г.. Успешная терапия фоскарнетом при цитомегаловирусном ретините у пациента со СПИДом, находящегося на гемодиализе: обоснование эмпирического дозирования и мониторинга уровня в плазме. Журнал инфекционных болезней. 1991 Октябрь; 164 (4): 785–787.[PubMed] [Google Scholar] 67. Дерай Дж., Мартинес Ф., Катлама С., Левальтье Б., Бофилс Н., Данис М. и др. Нефротоксичность фоскарнета: механизм, частота возникновения и профилактика. Am J Nephrol. 1989. 9 (4): 316–321. [PubMed] [Google Scholar]Использование противовирусных препаратов в неонатальном периоде
Clin Perinatol. Авторская рукопись; доступно в PMC 1 марта 2013 г.
Опубликован в окончательной отредактированной форме как:
PMCID: PMC32
NIHMSID: NIHMS351802
Richard J.Whitley
Заслуженный профессор, стипендиат Лоеба в области педиатрии, профессор педиатрии, микробиологии, медицины и нейрохирургии, Университет Алабамы в Бирмингеме, Бирмингем, AL
Ричард Дж. Уитли, заслуженный профессор, стипендиат Лоеба в педиатрии, профессор педиатрии, Микробиология, медицина и нейрохирургия, Университет Алабамы в Бирмингеме, Бирмингем, Алабама;
Окончательная отредактированная версия этой статьи издателем доступна в Clin Perinatol. См. Другие статьи в PMC, в которых цитируется опубликованная статья.Введение
Парентеральная терапия вирусных инфекций новорожденных и младенцев стала реальностью с появлением в начале 1980-х годов видарабина (аденин арабинозида) для лечения инфекций, вызванных вирусом простого герпеса (ВПГ) новорожденных. С тех пор ацикловир стал препаратом выбора для лечения неонатальных инфекций HSV, а также множества других герпесвирусных инфекций. Аналогичным образом было установлено, что ганцикловир полезен для лечения врожденных цитомегаловирусных (ЦМВ) инфекций, поражающих центральную нервную систему (ЦНС).В этой главе будут рассмотрены уроки, извлеченные из лечения неонатального ВПГ и врожденных ЦМВ-инфекций в связи с применением ацикловира и ганцикловира. Хотя естественная история этих заболеваний рассматривается в другом месте в этом тексте, краткое изложение будет предшествовать подробному обсуждению имеющихся установленных и альтернативных методов лечения. Отсылаем читателя к более обширным обзорам противовирусной терапии у детей и взрослых [1, 2].
Терапия инфекций, вызванных вирусом простого герпеса
Неонатальные инфекции ВПГ встречаются примерно у 1 из 3200 родов в США [3], и примерно у двух третей из них развивается какая-либо форма заболевания ЦНС [4].Большинство случаев вызвано ВПГ-2 [5]. Риск передачи увеличивается при первичной материнской инфекции в третьем триместре, составляя 30–50%, и может быть снижен путем кесарева сечения, если HSV был изолирован из шейки матки или наружных половых органов незадолго до родов [3]. Согласно обзору Кимберлина, 85% случаев неонатальной передачи вируса простого герпеса возникают в результате послеродовой передачи, в то время как 10% происходят в результате послеродовой передачи и только 5% связаны с передачей внутриутробно [6].
Младенцы с внутриутробной инфекцией ВПГ характеризуются триадой кожных проявлений (активные поражения, рубцы), неврологических признаков (микроцефалия, гидранэнцефалия) и глазных патологий (хориоретинит, микрофтальмия), присутствующих при рождении.Было обнаружено, что внутриутробная инфекция ВПГ возникает как при первичной, так и при рецидивирующей материнской инфекции ВПГ [7], хотя риск повторной инфекции меньше.
Инфекция HSV, приобретенная в послеродовом или послеродовом периоде, может быть классифицирована как заболевание кожи, глаз и / или рта (SEM), заболевание ЦНС или диссеминированное заболевание. По определению, болезнь SEM не затрагивает ЦНС. Распространенное заболевание может поражать ЦНС (75% случаев) вместе с множеством других систем органов, включая печень, надпочечники, желудочно-кишечный тракт, кожу, глаза или рот [8].Заболевание ЦНС также может иметь компонент вовлечения SEM, но не затрагивает другие системы органов. Из всех младенцев с неонатальной инфекцией ВПГ около 33% имеют заболевание ЦНС, а около 25% имеют диссеминированное заболевание [9]. Таким образом, около 50% младенцев с неонатальной инфекцией ВПГ имеют заболевание ЦНС.
Патогенез поражения ЦНС при неонатальных инфекциях ВПГ различается в зависимости от того, является ли инфекция диссеминированной. Энцефалит, связанный с диссеминацией, происходит из-за гематогенного распространения, тогда как изолированный энцефалит или энцефалит, связанный только с вовлечением SEM, вероятно, возникает из-за ретроградного внутринейронального транспорта HSV [4].Это различие соответствует клиническим проявлениям диссеминированного заболевания по сравнению с заболеванием ЦНС в том смысле, что распространение диссеминированного заболевания через кровь проявляется раньше (в среднем от 9 до 11 дней жизни) и вызывает более диффузное поражение мозга с множественными участками геморрагического некроза, в то время как заболевание ЦНС происходящий через более медленный аксональный транспорт, проявляется позже (примерно от 16 до 17 дней жизни) и обычно вызывает более очаговое поражение ЦНС [10].
Ранняя эра противовирусной терапии неонатальной инфекции ВПГ была отмечена повышением смертности при внутривенном введении видарабина, а также при внутривенном введении стандартной дозы (SD) ацикловира (30 мг / кг / день в 3 приема).Годовая смертность от диссеминированного заболевания снизилась с 85% при отсутствии терапии до 50% при использовании видарабина и 61% при использовании ацикловира SD, в то время как смертность за 1 год от заболевания ЦНС снизилась с 35% без лечения до 14% как для видарабина, так и для ацикловира SD. [11]. Совсем недавно было показано, что ацикловир в высоких дозах (HD) дополнительно улучшает эти показатели смертности. При внутривенном введении ацикловира на HD (60 мг / кг / день в 3 приема в течение 21 дня) уровень смертности в течение одного года составил 29% и 4% от диссеминированных заболеваний и заболеваний ЦНС, соответственно [12].В то время как HD ацикловир снижал заболеваемость младенцев с диссеминированным заболеванием (83% выживших имели нормальные исходы нервного развития), у младенцев с заболеванием ЦНС не наблюдалось значительного улучшения заболеваемости (31% выживших имели нормальные исходы неврологического развития).
Младенцы с поражением SEM имеют наилучший прогноз и, как указано ниже, им требуется всего 14 дней внутривенной терапии ацикловиром на HD.
В последнее время супрессивная терапия ацикловиром для младенцев с ЦНС после завершения внутривенного лечения значительно улучшила неврологический исход, измеренный по шкале Bailey Developmental Scores [13].Этот режим привел к тому, что примерно 60% (по сравнению с 31%) детей с заболеванием ЦНС развились нормально или с легкими нарушениями. Лечение проводилось в дозе 300 / мг / м 2 за три раза в день в течение шести месяцев.
Терапия неонатальных инфекций, вызванных вирусом ветряной оспы
У женщин, перенесших первичную инфекцию вируса ветряной оспы (VZV) в течение 48 часов после родов, рождаются дети с риском развития ветряной оспы в течение первых трех недель жизни. Новорожденным этим женщинам традиционно вводят иммуноглобулин против опоясывающего лишая (ZIG), чтобы предотвратить заболевание.Однако при спорадической нехватке ZIG у некоторых новорожденных могут развиться неонатальные заболевания. Никакие контролируемые клинические испытания не оценивали терапию этого заболевания ацикловиром; однако специалисты рекомендуют этот препарат для лечения болезней новорожденных.
Доступные методы лечения инфекций HSV и VZV
Ацикловир (Ациклогуанозин, Зовиракс, ACV)
Ацикловир является наиболее часто назначаемым противовирусным средством для лечения инфекций HSV новорожденных и младенцев.Он был доступен для клинического использования в течение почти трех десятилетий и продемонстрировал замечательную безопасность и эффективность против легких и тяжелых инфекций, вызванных HSV и VZV, как у здоровых пациентов, так и у пациентов с ослабленным иммунитетом, включая новорожденных.
Химия и механизм действия
Ацикловир – аналог дезоксигуанозина. После преимущественного поглощения инфицированными вирусом клетками ацикловир фосфорилируется кодируемой вирусом тимидинкиназой (ТК). Последующее ди- и трифосфорилирование катализируется ферментами клетки-хозяина.Ацикловиртрифосфат предотвращает синтез вирусной ДНК, как ингибируя вирусную ДНК-полимеразу, так и являясь терминатором цепи.
Спектр и устойчивость
Ацикловир наиболее активен против ВПГ; активность против VZV также значительна, но примерно в 10 раз меньше. Ацикловир считается препаратом выбора как при неонатальных инфекциях HSV, так и при VZV-инфекциях. Активность против ЦМВ низкая, поскольку ЦМВ не обладает активностью тимидинкиназы, а ДНК-полимераза ЦМВ слабо ингибируется ацикловиртрифосфатом.
Резистентность HSV и VZV к ацикловиру стала важной клинической проблемой среди пациентов с ослабленным иммунитетом, получающих длительную терапию [14]. Устойчивость вирусов к ацикловиру обычно является результатом мутаций в вирусном гене TK, хотя мутации в гене вирусной ДНК-полимеразы также встречаются редко. Резистентные изоляты могут вызывать тяжелые, прогрессирующие, изнурительные заболевания слизистой оболочки у взрослых и, в редких случаях, висцеральное распространение [15, 16]. Изоляты ВПГ, устойчивые к ацикловиру, также были зарегистрированы у здоровых хозяев, чаще всего у пациентов с часто рецидивирующими генитальными инфекциями, которые лечились хроническим ацикловиром [17].
Показания
Ацикловир эффективен для лечения инфекций, вызванных HSV и VZV, у иммунокомпетентных и иммунодефицитных хозяев, включая новорожденных. Для лечения неонатальных инфекций HSV рекомендуемая доза составляет 20 мг / кг / каждые 8 часов. Продолжительность терапии SEM-заболевания составляет 14 дней, в то время как для детей с ЦНС или диссеминированным заболеванием терапию следует продлить на 21 день.
Ацикловир для перорального применения – это экспериментальный подход к супрессивной терапии, который в настоящее время не одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов.
Фармакокинетика
После внутривенного введения доз от 2,5 до 15 мг / кг стабильные концентрации ацикловира колеблются от 6,7 до 20,6 мкг / мл. Ацикловир широко распространен; высокие концентрации достигаются в почках, легких, печени, сердце и кожных пузырьках; концентрации в спинномозговой жидкости (CSF) составляют около 50% от концентрации в плазме [18]. Ацикловир проникает через плаценту и накапливается в грудном молоке. Связывание с белками составляет от 9% до 33%, и менее 20% препарата метаболизируется до биологически неактивных метаболитов.Фармакокинетические данные для новорожденных при применении 20 мг / кг / доза отсутствуют.
При отсутствии нарушения функции почек период полувыведения ацикловира составляет от 2 до 3 часов у детей старшего возраста и взрослых и от 2,5 до 5 часов у новорожденных с нормальным клиренсом креатинина. Более 60% введенного препарата выводится с мочой [18]. Выведение продлевается у пациентов с нарушением функции почек; Период полувыведения составляет приблизительно 20 часов у лиц с терминальной стадией почечной недостаточности, что требует изменения дозы для пациентов с клиренсом креатинина менее 50 мл / мин / л.73 м 2 [19]. Ацикловир эффективно удаляется гемодиализом, но не постоянным амбулаторным перитонеальным диализом [20, 21].
Побочные эффекты
Ацикловир, как правило, является безопасным лекарством. Почечная дисфункция возникает в результате обструктивной нефропатии, вызванной образованием кристаллов ацикловира, осаждающихся в почечных канальцах. Иногда внутривенное введение ацикловира вызывает сыпь, потливость, тошноту, головную боль, гематурию и гипотонию. Высокие дозы внутривенного введения ацикловира (60 мг / кг / день) новорожденным были связаны с нейтропенией [22, 23].
Нейротоксичность может возникать у субъектов с нарушенной функцией почек, которые достигают высоких концентраций препарата в сыворотке [24]. Нейротоксичность проявляется в виде летаргии, спутанности сознания, галлюцинаций, тремора, миоклонуса, судорог, экстрапирамидных признаков и изменений состояния сознания, развивающихся в течение первых нескольких дней после начала терапии. Эти признаки и симптомы обычно проходят спонтанно в течение нескольких дней после прекращения приема ацикловира.
Хотя ацикловир обладает мутагенным действием при высоких концентрациях в некоторых анализах in vitro , он не обладает тератогенным действием на животных.Ограниченные данные о людях позволяют предположить, что использование ацикловира беременными женщинами не связано с врожденными дефектами или другими неблагоприятными исходами беременности.
Лекарственные взаимодействия
Вероятность почечной токсичности ацикловира увеличивается при приеме нефротоксических препаратов, таких как циклоспорин или амфотерицин B.
Терапия врожденной цитомегаловирусной инфекции
Цитомегаловирус (ЦМВ) обычно вызывает у людей серозную инфекцию во всем мире. 40% у подростков и приближается к 90% у взрослых с плохим социально-экономическим статусом [25, 26].Врожденная ЦМВ-инфекция – наиболее распространенная врожденная инфекция в развитых странах, обнаруживаемая примерно у 1% живорожденных младенцев в Соединенных Штатах [27]. Врожденные ЦМВ-инфекции чаще всего возникают при внутриутробной передаче, но, поскольку вирус распространяется с жидкостями организма, передача также может передаваться перинатально во время родов или постнатально через грудное молоко.
Из всех младенцев, рожденных с врожденной ЦМВ-инфекцией, примерно 7–10% имеют клинически очевидное заболевание при рождении [28].Клинические характеристики внутриутробной инфекции включают ограничение внутриутробного развития, гепатоспленомегалию, желтуху, тромбоцитопению, микроцефалию, перивентрикулярные кальцификации и хориоретинит. Согласно обзору Dollard, истинные показатели смертности трудно получить, и, как сообщается, они достигают 30% для младенцев с симптомами [29], но, скорее всего, в среднем составляют около 5–10% [30]. Смерть обычно происходит из-за проявлений инфекции, не связанных с ЦНС, таких как нарушение функции печени или кровотечение. По оценкам, 40–58% младенцев с симптоматической врожденной ЦМВ-инфекцией имеют необратимые последствия, в то время как младенцы, у которых нет симптомов при рождении, страдают необратимыми последствиями почти в 14% случаев [29].Сенсорно-невральная тугоухость (SNHL), умственная отсталость, судороги, задержка психомоторной и речевой активности, нарушение обучаемости, хориоретинит, атрофия зрительного нерва и дефекты зубных рядов являются наиболее частыми долгосрочными последствиями [31]. В отличие от внутриутробных инфекций, перинатально приобретенные ЦМВ-инфекции обычно не связаны с долгосрочными последствиями, хотя сообщалось об острых заболеваниях у недоношенных детей с очень низкой массой тела при рождении [32]. У доношенных детей перинатальные инфекции обычно протекают бессимптомно, но могут проявляться пневмонитом в течение первых нескольких месяцев жизни [33].
Врожденная ЦМВ-инфекция является следствием инфицирования матери и плода, причем большинство симптоматических врожденных случаев возникает из-за бессимптомной материнской инфекции. При материнской первичной инфекции, по-видимому, происходит нарушение плацентарного кровотока после инфицирования плацентарных вилок [34]. Патогенез вовлечения ЦНС в врожденную ЦМВ-инфекцию начинается с диссеминированного распространения виремии, включая эндотелиальные клетки головного мозга и эпителиальные клетки сосудистого сплетения.Из эндотелиальных клеток головного мозга вирус распространяется на смежные астроциты. Из сосудистого сплетения вирус затем перемещается к эпендимным поверхностям через спинномозговую жидкость (CSF). После инфицирования этих клеток вирус подвергается непрерывной репликации, что приводит к характерным внутриядерным тельцам включения и гибели клеток. Поскольку антитела вырабатываются в условиях непрерывной репликации вируса, также образуются иммунные комплексы, что приводит к дальнейшему иммуноопосредованному повреждению [31]. Хотя специфический патогенез SNHL, опосредованного CMV, не выяснен, гистология показала доказательства инфекции в клетках как улиткового, так и вестибулярного эндолабиринта [35].ЦМВ также был выделен из перилимфы улитки при вскрытии новорожденных с врожденной ЦМВ-инфекцией [36].
Недавние исследования лечения ганцикловиром врожденных ЦМВ-инфекций с поражением ЦНС были многообещающими. Введение ганцикловира в дозах 12 мг / кг / день, разделенных каждые 12 часов в течение 6 недель, улучшило исходы слуха у новорожденных с симптоматической врожденной ЦМВ-инфекцией с поражением ЦНС (о чем свидетельствуют микроцефалия, внутричерепные кальцификации, аномалии спинномозговой жидкости для возраста, хориоретинит и др.) / или нарушения слуха) [37].Первичной конечной точкой был улучшенный ответ, вызванный стволом мозга (BSER) между исходным уровнем и 6-месячным периодом наблюдения (или отсутствие ухудшения в течение 6-месячного периода наблюдения, если исходный BSER был нормальным). Что касается общего количества ушей, подлежащих оценке, 69% пациентов, получавших ганцикловир, достигли первичной конечной точки по сравнению с 39% в контрольной группе. Ни у одного пациента, получавшего ганцикловир, не было ухудшения слуха между исходным уровнем и 6 мес. У реципиентов ганцикловира также отмечалось более быстрое разрешение нарушений АЛТ, чем в контрольной группе, хотя вероятность развития нейтропении у них была значительно выше.Дополнительный анализ этого рандомизированного контролируемого исследования позволяет предположить, что ганцикловир может также уменьшать задержки в развитии нервной системы [38]. Улучшение смертности при терапии ганцикловиром пока не показано.
Лечение ЦМВ-инфекций
Ганцикловир (Цитовен)
Ганцикловир был первым противовирусным препаратом, доступным для терапии и профилактики инфекций, вызванных ЦМВ. Доказано, что это очень ценный препарат для пациентов с ослабленным иммунитетом, особенно для пациентов с рецептами трансплантации гемопоэтических стволовых клеток, которые страдают от значительной заболеваемости и смертности от ЦМВ-инфекций, а в последнее время – для детей с врожденной ЦМВ-инфекцией, хотя и не одобрено Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США. Администрация (FDA) в настоящее время.
Химия и механизм действия
Ганцикловир структурно похож на ацикловир, за исключением гидроксиметильной группы на его ациклической боковой цепи. Первоначальный этап фосфорилирования осуществляется pUL97, вирусной протеинкиназой. Затем клеточные киназы фосфорилируют агент еще два раза, чтобы преобразовать его в его трифосфатное производное, которое способно ингибировать ДНК-полимеразу ЦМВ, кодируемую UL97 , а также встраиваться в вирусную ДНК и обрывать ее.
Ганцикловир трифосфат – конкурентный ингибитор герпесвирусных ДНК-полимераз, приводящий к прекращению удлинения цепи ДНК [1, 20].
Спектр и устойчивость
Ганцикловир имеет сходную с ацикловиром активность против HSV-1, HSV-2 и VZV, но, в отличие от ацикловира, его наибольшая активность против CMV. Устойчивость изолятов ЦМВ обычно возникает в результате мутаций в гене UL97 [39]. Мутации в гене ДНК-полимеразы ЦМВ встречаются реже. Показания .Ганцикловир лицензирован по нескольким показаниям за пределами новорожденных. В нескольких обзорах резюмируются эти клинические исходы [2]. Для лечения новорожденных, врожденно инфицированных ЦМВ, было проведено контролируемое исследование [40]. Как отмечалось выше, по сравнению с отсутствием лечения терапия ганцикловиром предотвращала ухудшение слуха через два года, хотя примерно у двух третей пролеченных младенцев развилась нейтропения, часто требующая изменения дозы.
Фармакокинетика
Биодоступность ганцикловира при пероральном приеме низкая, при пероральном приеме всасывается менее 10% препарата [41, 42].Пероральный препарат ганцикловира больше не продается. Пиковые концентрации ганцикловира в сыворотке после введения 6 мг / кг (доза для новорожденных) внутривенно вводимого лекарственного средства колеблются от 8 до 11 мкг / мл с концентрациями, достаточными для подавления чувствительных штаммов ЦМВ в водянистой влаге, субретинальной жидкости, спинномозговой жидкости и ткани мозга [ 1]. Период полувыведения ганцикловира составляет от 2 до 3 часов, и большая часть препарата выводится в неизмененном виде с мочой. Фармакокинетика ганцикловира в популяции новорожденных аналогична таковой у взрослых [43, 44].Снижение дозы, пропорциональное степени снижения клиренса креатинина, необходимо лицам с нарушением функции почек. Дополнительная доза рекомендуется после диализа, поскольку она эффективно удаляется гемодиализом [45].
Побочные эффекты
Миелосупрессия – наиболее частое побочное действие ганцикловира; Дозозависимая нейтропения (менее 1000 лейкоцитов / мкл) является наиболее стойким гематологическим отклонением с частотой около 40% [42]. Нейтропения ограничивает дозу примерно в одном из семи курсов и исчезает после прекращения приема препарата.При пероральном приеме ганцикловира нейтропения возникает реже. Тромбоцитопения (менее 50 000 тромбоцитов / мкл) встречается примерно у 20%, а анемия – примерно у 2% реципиентов ганцикловира. От 2 до 5% реципиентов ганцикловира испытывают головную боль, спутанность сознания, изменение психического статуса, галлюцинации, кошмары, беспокойство, атаксию, тремор, судороги. лихорадка, сыпь и аномальные уровни сывороточных печеночных ферментов по отдельности или в некоторой комбинации.
Дозировка
Доза ганцикловира для лечения симптоматической врожденной ЦМВ-инфекции составляет 12 мг / кг / день внутривенно дважды в день в течение 6 недель.
Исследуемый препарат
Валганцикловир (Valcyte)
Валганцикловир был одобрен FDA в марте 2001 г. для лечения ЦМВ-ретинита. Поскольку он хорошо всасывается после перорального приема, он может представлять собой благоприятный вариант по сравнению с внутривенным введением ганцикловира для лечения врожденной ЦМВ-инфекции. В настоящее время он лицензирован для лечения ЦМВ-инфекций в отдельных популяциях трансплантатов и ЦМВ-ретинита у пациентов с ВИЧ / СПИДом.
Химия, механизм действия, спектр и устойчивость
Валганцикловир является пролекарством ганцикловира на основе эфира L-валина и, как таковой, имеет тот же механизм действия, противовирусный спектр и потенциал развития устойчивости, что и ганцикловир [1, 20] .
Показания
Валганцикловир имеет аналогичные показания к ганцикловиру. Однако, основываясь на опубликованных на сегодняшний день ограниченных контролируемых исследованиях, в настоящее время он одобрен для индукционной и поддерживающей терапии ЦМВ-ретинита и для отдельных популяций трансплантатов [46].В настоящее время исследуется возможность лечения врожденной ЦМВ-инфекции. В этом рандомизированном контролируемом исследовании, проводимом Группой по совместным антивирусным исследованиям (CASG) Национального института аллергии и инфекционных заболеваний (NIAID), в качестве основной конечной точки используется SNHL.
Фармакокинетика
Валганцикловир быстро превращается в ганцикловир со средним периодом полувыведения из плазмы около 30 минут [46]. Абсолютная биодоступность валганцикловира превышает 60% и фактически увеличивается примерно на 30% при одновременном приеме пищи [47].Площадь под кривой ганцикловира после перорального приема валганцикловира составляет от одной трети до половины площади, полученной после внутривенного введения ганцикловира. Пациентам с нарушением функции почек требуется снижение дозировки, примерно пропорциональное снижению клиренса креатинина.
Побочные эффекты
Наиболее частые побочные эффекты, связанные с терапией валганцикловиром у взрослых, включают диарею (41%), тошноту (30%), нейтропению (27%), анемию (26%) и головную боль (22%) [ 46].Лишь ограниченное число новорожденных получали терапию валганцикловиром. Единственным значимым открытием была нейтропения у 15% пациентов.
Дозировка
Доза валганцикловира зависит от возраста пациента и функции почек. В настоящее время препарат не разрешен к применению у новорожденных с врожденной ЦМВ-инфекцией.
Непроверенные и непроверенные методы лечения неонатальных инфекций HSV, VZV и врожденных CMV-инфекций
Следующие два препарата используются для лечения HSV, VZV и CMV инфекций у детей старшего возраста и взрослых.Данные об этих препаратах предоставляются, если у новорожденных возникает устойчивость к противовирусным препаратам при инфекциях ВПГ или ЦМВ. Ни один из препаратов не был оценен в рамках доказательных исследований на новорожденных, и оба связаны со значительной токсичностью. Кроме того, валацикловир может стать доступным для педиатрического применения, особенно для младенцев с инфекцией HSV, ограниченной кожей, глазами и ртом
Цидофовир (HPMPC, Vistide)
Цидофовир был впервые одобрен для использования в США для лечения СПИДа -ассоциированный ретинит, вызванный ЦМВ.Это остается основным показанием к применению этого противовирусного препарата.
Химия и механизм действия
Цидофовир – это новый аналог ациклических фосфонатных нуклеозидов с механизмом действия, аналогичным другим аналогам нуклеозидов. В отличие от ацикловира, вирусные ферменты не требуются для начального фосфорилирования, поскольку нативный цидофовир уже имеет одну присоединенную фосфатную группу. После дифосфорализации клеточными киназами цидофовир конкурентно ингибирует ДНК-полимеразу [48].Активная форма цидофовира проявляет в 25-50 раз большее сродство к вирусной ДНК-полимеразе по сравнению с клеточной ДНК-полимеразой.
Спектр и устойчивость
Цидофовир активен против ВПГ и ЦМВ, включая устойчивые к ацикловиру и фоскарнету изоляты ВПГ и мутанты ЦМВ, устойчивые к ганцикловиру и фоскарнету [49]. Он также активен in vitro против VZV, EBV, вируса герпеса человека-6, вируса герпеса человека-8, полиомавирусов, аденовируса и ВПЧ человека.
Было описано небольшое количество устойчивых к цидофовиру изолятов ЦМВ, которые также устойчивы к ганцикловиру на основе мутаций в гене ДНК-полимеразы [50].Сообщалось также о мутанте ЦМВ, устойчивом к ганцикловиру, фоскарнету и цидофовиру [51].
Показания
Цидофовир замедляет прогрессирование заболевания сетчатки у пациентов со СПИДом [52, 53]. Цидофовир также был полезен при лечении заболеваний, вызванных устойчивыми к ацикловиру изолятами ВПГ [54]. Были опубликованы отдельные сообщения об улучшении папилломатоза гортани после инъекции цидофовира в очаг поражения, но на основании этого ограниченного опыта невозможно сделать окончательные выводы об эффективности [55, 56].
Фармакокинетика
Только 2–26% цидофовира всасывается после перорального приема, поэтому его вводят внутривенно. Период полувыведения цидофовира из плазмы составляет 2,6 часа, но период полураспада активных внутриклеточных метаболитов цидофовира составляет от 17 до 48 часов [ 57]. Девяносто процентов препарата выводится с мочой, в основном с секрецией почечных канальцев [58]. Важно отметить, что препарат не проникает через гематоэнцефалический барьер и, следовательно, не должен использоваться для лечения инфекций ЦНС.
Побочные эффекты
Поскольку цидофовир концентрируется в почечных клетках в количествах в 100 раз больше, чем в других тканях, нефротоксичность является основным побочным эффектом, особенно если гидратация не поддерживается [57, 58].Проявления почечной токсичности включают протеинурию и глюкозурию. Агрессивная внутривенная прегидратация, одновременное введение пробенецида и избегание других нефротоксических агентов снижают вероятность токсичности. Цидофовир противопоказан пациентам с креатинином сыворотки> 1,5 мг / дл, расчетным клиренсом креатинина ≤ 55 мл / мин или белком мочи ≥ 100 мг / дл, и препарат следует отменить, если креатинин сыворотки повышается на ≥ 0,5 мг / дл выше исходного уровня. .
Дозировка
Цидофовир вводят внутривенно детям старшего возраста и взрослым в дозе 5 мг / кг один раз в неделю с пробенецидом.Пациенты с нарушением функции почек (расчетный клиренс креатинина <55 мл / мин) проходят лечение каждые 2 недели. Дозу следует уменьшить с 5 мг / кг до 3 мг / кг, если креатинин сыворотки повышается на> 0,3 мг / дл выше исходного уровня. Данных о дозировании цидофовира новорожденным нет.
Фоскарнет (PFA, Foscavir)
Фоскарнет – единственный противогерпетический препарат, не являющийся аналогом нуклеозидов. Это не препарат первой линии, но он полезен для лечения инфекций, вызванных устойчивыми вирусами герпеса.
Химия и механизм действия
Фоскарнет – неорганический аналог пирофосфата, который напрямую ингибирует ДНК-полимеразу, блокируя сайт связывания пирофосфата [20, 59].
Спектр и устойчивость
Фоскарнет ингибирует все известные герпесвирусы человека, включая большинство устойчивых к ганцикловиру изолятов ЦМВ и устойчивые к ацикловиру штаммы ВПГ и ВЗВ. Он также активен против ВИЧ. Устойчивость возникает в результате мутаций ДНК-полимеразы. Сообщалось о штаммах CMV, HSV и VZV с пониженной чувствительностью к фоскарнету [59, 60].
Показания
Фоскарнет так же эффективен, как и ганцикловир, для лечения угрожающего зрению хориоретинита, вызванного ЦМВ, у взрослых пациентов со СПИДом [61]. Из-за присущей ему активности против ВИЧ, он может даже обеспечить преимущество в выживаемости для пролеченных пациентов [62]. Рефрактерные случаи хориоретинита могут поддаваться лечению комбинацией фоскарнета и ганцикловира. Фоскарнет также эффективен при терапии ЦМВ-инфекций, вызванных ганцикловир-резистентными штаммами вируса [62]. Ограниченные данные также предполагают, что фоскарнет может быть полезным при назначении пациентам со СПИДом, у которых есть желудочно-кишечные и легочные инфекции, вызванные ЦМВ.
Инфекции, вызванные устойчивыми к ацикловиру штаммами HSV и VZV, успешно контролируются с помощью фоскарнета [63, 64].
Фармакокинетика
Только около 20% фоскарнета абсорбируется после перорального приема. Максимальная концентрация в сыворотке, достигаемая после внутривенного введения 60 мг / кг, составляет примерно 500 мкмоль / л [59]. Концентрация в спинномозговой жидкости составляет около двух третей от концентрации в сыворотке. Период полувыведения фоскарнета составляет около 48 часов, и 80% введенной дозы выводится в неизмененном виде с мочой.Необходимо снижение дозы пропорционально уменьшению клиренса креатинина. Гемодиализ эффективно устраняет фоскарнет, поэтому после диализа рекомендуется дополнительная доза [65]. Данных о применении фоскарнета новорожденным нет.
Побочные эффекты
Наиболее частыми побочными эффектами фоскарнета являются нефротоксичность и метаболические нарушения. Доказательства нефротоксичности включают азотемию, протеинурию, острый некроз канальцев, кристаллурию и интерстициальный нефрит.Концентрация креатинина в сыворотке увеличивается до 50% пациентов. К счастью, функция почек приходит в норму в течение 2–4 недель после прекращения терапии. Существующее ранее заболевание почек, одновременный прием других нефротоксических препаратов, обезвоживание, быстрое введение или непрерывное внутривенное вливание препарата являются факторами риска развития почечной дисфункции [66]. Метаболические нарушения, связанные с терапией фоскарнетом, включают гипо- и гиперкальциемию, а также гипо- и гиперфосфатемию [67]. Гипокальциемия может быть связана с парестезиями, тетанией, судорогами и аритмиями.Метаболические нарушения сводятся к минимуму, если вводить фоскарнет медленной инфузией. Симптомы со стороны ЦНС, связанные с терапией фоскарнетом, включают головную боль, тремор, раздражительность, судороги и галлюцинации. Сообщалось также о лихорадке, тошноте, рвоте, аномальных ферментах сыворотки крови, анемии, гранулоцитопении и генитальных изъязвлениях.
Лекарственные взаимодействия
Одновременное применение амфотерицина B, циклоспорина, гентамицина и других нефротоксических препаратов увеличивает вероятность нарушения функции почек.Одновременный прием пентамидина увеличивает риск гипокальциемии. Анемия и нейтропения чаще встречаются, когда пациенты также получают зидовудин.
Дозировка
Обычная доза фоскарнета при ЦМВ-инфекции составляет 180 мг / кг / день в три приема в течение 14–21 дней, после чего следует ежедневная поддерживающая доза от 90 до 120 мг / кг. Дозировка фоскарнета, используемого при инфекциях, вызванных устойчивыми к ацикловиру HSV и VZV, составляет 120 мг / кг / день в три приема.
Резюме
Несмотря на то, что в лечении врожденных ЦМВ и неонатальных инфекций ВПГ достигнут значительный прогресс, дальнейшие достижения являются обязательными.С появлением новых противовирусных препаратов, обладающих другим механизмом действия, появляется возможность для комбинированной терапии, если можно доказать, что лекарства безопасны.
Выражение признательности
Этот проект полностью или частично финансируется за счет федеральных средств Национального института аллергии и инфекционных заболеваний, Национальных институтов здравоохранения, Министерства здравоохранения и социальных служб, по контракту № N01-AI-30025.
Сноски
Заявление издателя: Это PDF-файл неотредактированной рукописи, принятой к публикации.В качестве услуги для наших клиентов мы предоставляем эту раннюю версию рукописи. Рукопись будет подвергнута копированию, верстке и рассмотрению полученного доказательства, прежде чем она будет опубликована в окончательной форме для цитирования. Обратите внимание, что во время производственного процесса могут быть обнаружены ошибки, которые могут повлиять на содержание, и все юридические оговорки, относящиеся к журналу, имеют отношение.
Список литературы
1. Кимберлин Д. Противовирусные агенты. В: Лонг С., Пикеринг Л., Пробер С., редакторы. Принципы и практика детских инфекционных болезней.3-е изд. Нью-Йорк: Эльзевир; 2008. С. 1470–1488. [Google Scholar] 2. Ра Б., Кимберлин Д. В., Уитли Р. Противовирусные препараты. В: Джером К., редактор. Лабораторная диагностика вирусных инфекций. 3-е изд. Нью-Йорк: Informa Healthcare; 2009. [Google Scholar] 3. Brown ZA, Wald A, Morrow RA, Selke S, Zeh J, Corey L. Влияние серологического статуса и кесарева сечения на скорость передачи вируса простого герпеса от матери к ребенку. ДЖАМА. 2003. 289 (2): 203–209. [PubMed] [Google Scholar] 4. Уитли Р.Дж. Вирус простого герпеса.В: Scheld MW, Whitley RJ, Marra CM, редакторы. Инфекции центральной нервной системы. 3-е изд. Филадельфия: Липпинкотт Уильямс и Уилкинс; 2004. С. 123–144. [Google Scholar] 5. Kimberlin DW, Lin CY, Jacobs RF, Powell DA, Frenkel LM, Gruber WC, et al. Естественная история инфекций, вызванных вирусом простого герпеса новорожденных, в эпоху ацикловира. Педиатрия. 2001. 108 (2): 223–229. [PubMed] [Google Scholar] 6. Kimberlin DW. Ведение энцефалита, вызванного вирусом простого герпеса, у взрослых и новорожденных: диагностика, прогноз и лечение.Герпес. 2007 июн; 14 (1): 11–16. [PubMed] [Google Scholar] 7. Хатто С., Арвин А., Джейкобс Р., Стил Р., Стагно С., Лайрин Р. и др. Внутриутробные инфекции, вызванные вирусом простого герпеса. Журнал педиатрии. 1987. 110 (1): 97–101. [PubMed] [Google Scholar] 8. Уитли Р.Дж. Инфекции, вызванные вирусом простого герпеса. В: Remington JS, Klein JO, редакторы. Инфекционные болезни плода и новорожденных. 3-е изд. Филадельфия: W.B. Компания Сондерс; 1990. С. 282–305. [Google Scholar] 9. Уитли Р.Дж., Кори Л., Арвин А., Лейкман Ф.Д., Сумая К.В., Райт П.Ф. и др.Изменение представления инфекции вируса простого герпеса у новорожденных. Журнал инфекционных болезней. 1988. 158 (1): 109–116. [PubMed] [Google Scholar] 10. Уитли Р.Дж., Ройзман Б. Вирусы простого герпеса. В: Ричман Д.Д., Уитли Р.Дж., Хайден Ф.Г., редакторы. Клиническая вирусология. 2-е изд. Вашингтон, округ Колумбия: ASM Press; 2004. С. 375–401. [Google Scholar] 11. Уитли Р., Арвин А., Пробер С., Берчетт С., Кори Л., Пауэлл Д. и др. Контролируемое испытание по сравнению видарабина с ацикловиром при неонатальной инфекции вирусом простого герпеса.Медицинский журнал Новой Англии. 1991. 324 (7): 444–449. [PubMed] [Google Scholar] 12. Kimberlin DW, Lin CY, Jacobs RF, Powell DA, Corey L, Gruber WC, et al. Безопасность и эффективность высоких доз внутривенного ацикловира при лечении инфекций, вызванных вирусом простого герпеса у новорожденных. Педиатрия. 2001. 108 (2): 230–238. [PubMed] [Google Scholar] 13. Кимберлин Д., Уитли Р., Ван В., Пауэлл Д., Сторч Г., Ахмед А. и др. Влияние перорального подавления ацикловира на исходы развития нервной системы и рецидивы кожи после неонатальной болезни, вызванной вирусом простого герпеса.NEJM. 2011 В печати. [Google Scholar] 14. Englund JA, Zimmerman ME, Swierkosz EU, Goodman JL, Scholl D, Balfour HH. Вирус простого герпеса устойчив к ацикловиру. Исследование в центре третичной медицинской помощи. Ann Intern Med. 1990; 112: 416–422. [PubMed] [Google Scholar] 15. Полевой АК, Бирон К.К. Возвращение к «концу невинности»: устойчивость герпесвирусов к противовирусным препаратам. Clin Microbiol Rev.1994, январь; 7 (1): 1–13. [Бесплатная статья PMC] [PubMed] [Google Scholar] 16. Лайалл Э.Г., Огилви М.М., Смит Н.М., Бернс С. Устойчивость к ацикловиру ветряной оспы и ВИЧ-инфекция.Arch Dis Child. 1994 Февраль; 70 (2): 133–135. [Бесплатная статья PMC] [PubMed] [Google Scholar] 17. Морфин Ф, Тувено Д. Устойчивость вируса простого герпеса к противовирусным препаратам. J Clin Virol. 2003 Янв; 26 (1): 29–37. [PubMed] [Google Scholar] 18. Wagstaff AJ, Faulds D, Goa Kl. Ацикловир. Переоценка его противовирусной активности, фармакокинетических свойств и терапевтической эффективности. Наркотики. 1994; 47: 153–205. [PubMed] [Google Scholar] 19. Ласкин О.Л., Лонгстрет Дж. А., Велтон А., Красный Х. С., Кини Р. Э., Рокко Л. и др. Влияние почечной недостаточности на фармакокинетику ацикловира.Am J Med. 20 июля 1982 г.; 73 (1A): 197–201. [PubMed] [Google Scholar] 20. Инь М., Браст Дж., Тиеу Х., Хаммер С. Антигепатитные и противодыхательные вирусные агенты. В: Ричман Д., Уитли Р., Хайден Ф., редакторы. Клиническая вирусология. Вашингтон, округ Колумбия: ASM Press; 2009. С. 217–264. [Google Scholar] 21. Красный ХК, Ляо С.Х., де Миранда П., Ласкин О.Л., Велтон А., Литман П.С. Влияние гемодиализа на фармакокинетику ацикловира у пациентов с хронической почечной недостаточностью. Am J Med. 20 июля 1982 г.; 73 (1A): 202–204. [PubMed] [Google Scholar] 22.Кимберлин Д., Пауэлл Д., Грубер В., Диаз П., Арвин А., Кумар М. и др. Назначение пероральной супрессивной терапии ацикловиром после неонатальной болезни, вызванной вирусом простого герпеса, с поражением кожи, глаз и рта: результаты тирала фазы I / II. Pediatr Infect Dis J. 1996; 15: 247–254. [PubMed] [Google Scholar] 23. Kimberlin DW, Lin CY, Jacobs RF, Powell DA, Corey L, Gruber WC, et al. Безопасность и эффективность высоких доз внутривенного ацикловира при лечении инфекций, вызванных вирусом простого герпеса у новорожденных. Педиатрия.2001 август; 108 (2): 230–238. [PubMed] [Google Scholar] 24. Реванкар С.Г., Эпплгейт А.Л., Марковиц Д.М. Делирий, связанный с лечением ацикловиром у пациента с почечной недостаточностью. Clin Infect Dis. 1995 августа; 21 (2): 435–436. [PubMed] [Google Scholar] 25. Гриффитс П.Д., Эмери В.К. Цитомегаловирус. В: Ричман Д.Д., Уитли Р.Дж., Хайден Ф.Г., редакторы. Клиническая вирусология. 2-е изд. Вашингтон, округ Колумбия: ASM Press; 2002. С. 433–461. [Google Scholar] 26. Старас С.А., Доллард СК, Рэдфорд К.В., Фландрия В.Д., Пасс РФ, Кэннон М.Дж. Распространенность цитомегаловирусной инфекции в США: 1988–1994 гг.Clin Infect Dis. 2006 г., 1 ноября; 43 (9): 1143–1151. [PubMed] [Google Scholar] 27. Demmler GJ. Американское общество инфекционных болезней и Центры по контролю за заболеваниями. Резюме семинара по надзору за врожденными цитомегаловирусными заболеваниями. Обзоры инфекционных болезней. 1991. 13 (2): 315–329. [PubMed] [Google Scholar] 28. Conboy TJ, Pass RF, Stagno S, Alford CA, Myers GJ, Britt WJ и др. Ранние клинические проявления и интеллектуальный исход у детей с симптоматической врожденной цитомегаловирусной инфекцией.Журнал педиатрии. 1987. 111 (3): 343–348. [PubMed] [Google Scholar] 29. Доллард СК, Гроссе С.Д., Росс Д.С. Новые оценки распространенности неврологических и сенсорных последствий и смертности, связанных с врожденной цитомегаловирусной инфекцией. Rev Med Virol. 1 июня 2007 г .; [PubMed] [Google Scholar] 30. Росс С.А., Боппана С.Б. Врожденная цитомегаловирусная инфекция: исход и диагноз. Semin Pediatr Infect Dis. 2005 Янв; 16 (1): 44–49. [PubMed] [Google Scholar] 31. Гриффитс PD, Маклафлин JE. Цитомегаловирус.В: Scheld WM, Whitley RJ, Marra CM, редакторы. Инфекции центральной нервной системы. Филадельфия: Липпинкотт Уильямс и Уилкинс; 2004. С. 159–173. [Google Scholar] 32. Машманн Дж., Хампрехт К., Дитц К., Ян Дж., Шпеер С.П. Цитомегаловирусная инфекция младенцев с крайне низкой массой тела при рождении через грудное молоко. Клинические инфекционные болезни. 2001; 33 (12): 1998–2003. [PubMed] [Google Scholar] 33. Brasfield DM, Stagno S, Whitley RJ, Cloud G, Cassell G, Tiller RE. Детский пневмонит, связанный с цитомегаловирусом, хламидиозом, пневмоцистом и уреаплазмой.Педиатрия. 1987. 79: 76–83. [PubMed] [Google Scholar] 34. Перейра Л., Майджи Э. Цитомегаловирусная инфекция в плаценте человека: материнский иммунитет и рецепторы, регулируемые развитием трофобластов, сходятся. Актуальные темы микробиологии и иммунологии. 2008. 325: 383–395. [PubMed] [Google Scholar] 35. Штраус М. Цитомегаловирусный лабиринтит человека. Am J Otolaryngol. Сентябрь – октябрь 1990 г., 11 (5): 292–298. [PubMed] [Google Scholar] 36. Дэвис Л.Е., Джонссон Л.Г., Корнфельд М. Цитомегаловирусный лабиринтит у младенцев: морфологические, вирусологические и иммунофлуоресцентные исследования.J Neuropathol Exp Neurol. 1981, январь; 40 (1): 9–19. [PubMed] [Google Scholar] 37. Kimberlin DW, Lin CY, Sanchez PJ, Demmler GJ, Dankner W, Shelton M и др. Влияние терапии ганцикловиром на слух при симптоматическом врожденном цитомегаловирусном заболевании с поражением центральной нервной системы: рандомизированное контролируемое исследование. Журнал педиатрии. 2003. 143 (1): 16–25. [PubMed] [Google Scholar] 38. Оливер С., Клауд Дж., Санчес П., Деммлер Дж., Данкнер В., Шелтон М. и др. Влияние терапии ганцикловиром (GCV) на исходы нервного развития при симптоматических врожденных цитомегаловирусных (CMV) инфекциях с поражением центральной нервной системы (ЦНС): рандомизированное контролируемое исследование.Ежегодное собрание Общества педиатрических исследований (SPR); 2006 29 апреля; Сан-Франциско, Калифорния. 2006. с. Реферат № 752908. [Google Scholar] 39. Маркхам А., Фолдс Д. Ганцикловир: обновление его терапевтического использования при цитомегаловирусной инфекции. Наркотики. 1994; 48: 455. [PubMed] [Google Scholar] 40. Kimberlin DW, Lin C-Y, Sanchez PJ, Demmler GJ, Dankner W, Shelton MD, et al. Влияние ганцикловира на слух при симптоматическом врожденном цитомегаловирусном заболевании с поражением центральной нервной системы: рандомизированное контролируемое исследование.J Pediatr. 2003. 143: 16–25. [PubMed] [Google Scholar] 41. Редди В., Хао Ю., Липтон Дж., Мехарчанд Дж., Минден М., Мацзулли Т. и др. Ведение реципиентов аллогенного трансплантата костного мозга с риском цитомегаловирусной болезни с использованием контрольной бронхоскопии и длительной упреждающей терапии ганцикловиром. J Clin Virol. 1999, август; 13 (3): 149–159. [PubMed] [Google Scholar] 42. Jacobson MA, Gambertoglio JG, Aweeka FT, Causey DM, Portale AA. Гипокальциемия, вызванная фоскарнетом, и влияние фоскарнета на метаболизм кальция.J Clin Endocrinol Metab. 1991 Май; 72 (5): 1130–1135. [PubMed] [Google Scholar] 43. Френкель Л.М., Каппарелли Е.В., Данкнер В.М., Сюй Дж., Смит И.Л., Баллоу А. и др. Ганцикловир для приема внутрь у детей: фармакокинетика, безопасность, переносимость и противовирусное действие. Группа педиатрических клинических испытаний СПИДа. Журнал инфекционных болезней. 2000 декабрь; 182 (6): 1616–1624. [PubMed] [Google Scholar] 44. Транг Дж. М., Кидд Л., Грубер В., Сторч Дж., Деммлер Дж., Джейкобс Р. и др. Линейная фармакокинетика однократной дозы ганцикловира у новорожденных с врожденными цитомегаловирусными инфекциями.Clin Pharmacol Ther. 1993; 53: 15–21. [PubMed] [Google Scholar] 45. Свон С.К., Мунар М.Ю., Виггер М.А., Беннетт В.М. Фармакокинетика ганцикловира у пациента, находящегося на гемодиализе. Am J Kidney Dis. 1991, январь; 17 (1): 69–72. [PubMed] [Google Scholar] 46. Cocohoba JM, McNicholl IR. Валганцикловир: прогресс в лечении цитомегаловирусов. Энн Фармакотер. 2002 июн; 36 (6): 1075–1079. [PubMed] [Google Scholar] 47. Юнг Д., Дорр А. Фармакокинетика однократной дозы валганцикловира у ВИЧ- и ЦМВ-серопозитивных субъектов.J Clin Pharmacol. 1999, август; 39 (8): 800–804. [PubMed] [Google Scholar] 48. Хо Х.Т., Вудс К.Л., Бронсон Дж. Дж., Де Бок Х., Мартин Дж. К., Хичкок МД. Внутриклеточный метаболизм антигерпетических средств -1- {3-гидрокси-2- (фосфонилметокси) пропил} цитозин. Mol Pharmacol. 1992; 41: 197–202. [PubMed] [Google Scholar] 49. Сафрин С, Черрингтон Дж, Джаффе Х.С. Клиническое использование цидофовира. Rev Med Virol. 1997 сентябрь; 7 (3): 145–156. [PubMed] [Google Scholar] 50. Lurain N, Spafford LE, Thompson KD. Мутация в открытой рамке считывания UL97 штаммов цитомегаловируса человека, устойчивых к ганцикловиру.Журнал вирусологии. 1994b; 68: 4427–4431. [Бесплатная статья PMC] [PubMed] [Google Scholar] 51. Черрингтон Дж. М., Майнер Р., Аллен С. Дж. У. и др. Сенситивы клинических изолятов цитомегаловируса человека (HCMV) к цидофовиру. Восьмая международная конференция по противовирусным исследованиям; 1995 г. 23–28 апреля; Санта-Фе, Нью-Мексико. 1995. [Google Scholar] 52. Исследования глазных осложнений Группы исследований СПИДа в сотрудничестве с Группой клинических испытаний СПИДа. Цидофовир (HPMPC) для лечения цитомегаловирусного ретинита у пациентов со СПИДом: исследование периферического цитомегаловирусного ретинита HPMPC.Ann Intern Med. 1997. 126: 264–274. [PubMed] [Google Scholar] 53. Lalezari JP, Staagg RJ, Kuppermann BD, Holland GN, Kramer F, Ives DV, et al. Внутривенное введение цидофовира при периферическом цитомегаловирусном ретините у пациентов со СПИДом: рандомизированное контролируемое исследование. Ann Intern Med. 1997. 126: 257–263. [PubMed] [Google Scholar] 54. Лалезари Дж. П., Дрю В. Л., Глутцер Э., Майнер Д., Сафрин С., Оуэн В. Ф., младший и др. Лечение внутривенным (S) -1- [3-гидрокси-2- (фосфонилметокси) пропил) -цитозином ацикловир-резистентной кожно-слизистой инфекции вирусом простого герпеса у пациента со СПИДом.Журнал инфекционных болезней. 1994; 170: 570–572. [PubMed] [Google Scholar] 55. Кимберлин DW, Малис DJ. Рецидивирующий респираторный папилломатоз с юношеским началом: возможности успешной противовирусной терапии. Antiviral Res. 2000 Февраль; 45 (2): 83–93. [PubMed] [Google Scholar] 56. Прански С.М., Магит А.Е., Кернс Д.Б., Канг Д.Р., Дункан Н.О. Цидофовир внутриочаговый при рецидивирующем респираторном папилломатозе у детей. Arch Otolaryngol Head Neck Surg. 1999 Октябрь; 125 (10): 1143–1148. [PubMed] [Google Scholar] 57. Канди К.С., Петти Б.Г., Флаэрти Дж., Фишер П.Е., Полис М.А., Ваксман М. и др.Клиническая фармакокинетика цидофовира у пациентов, инфицированных вирусом иммунодефицита человека. Противомикробные агенты Chemother. 1995; 39: 1247–1252. [Бесплатная статья PMC] [PubMed] [Google Scholar] 58. Лалезари Дж. П., Дрю В. Л., Глутцер Э., Джеймс С., Майнер Д., Флаэрти Дж. И др. (S) -1 {3-гидрокси-2- (фосфонилметокси) пропил} цитозин (цидофовиир): результаты исследования фазы I / II нового противовирусного аналога нуцелотида. Журнал инфекционных болезней. 1995; 171: 788–796. [PubMed] [Google Scholar] 59. Wagstaff AJ, Bryson HM.Фоскарнет: переоценка его противовирусной активности, фармакокинетических свойств и терапевтического использования у пациентов с ослабленным иммунитетом и вирусной инфекцией. Наркотики. 1994. 48: 199–226. [PubMed] [Google Scholar] 60. Сафрин С., Кеммерли С., Плоткин Б., Смит Т., Вайсбах Н., Де Веранес Д. и др. Инфекция, вызванная устойчивым к фоскарнету вирусом простого герпеса, у больных СПИДом. Журнал инфекционных болезней. 1994; 169: 193–196. [PubMed] [Google Scholar] 61. Снок Р., Андрей Г., Джерард М., Сильверман А., Хеддерман А., Бальзарини Дж. И др.Успешное лечение прогрессирующей кожно-слизистой инфекции, вызванной устойчивым к ацикловиру и фоскарнету вирусом простого герпеса, с помощью (S) -1- (3-гидрокси-2-фосфонилметоксипропил) цитозина (HPMPC) Clin Infect Dis. 1994 Апрель; 18 (4): 570–578. [PubMed] [Google Scholar] 62. Якобсон М.А., Дрю В.Л., Файнберг Дж., О’Доннелл Дж. Дж., Уитмор П.В., Майнер Р.Д. и др. Терапия фоскарнетом при ганцикловиррезистентном цитомегаловирусном ретините у больных СПИДом. Журнал инфекционных болезней. 1991; 163: 1348–1351. [PubMed] [Google Scholar] 63.Сафрин С., Бергер Т.Г., Гилсон И. Терапия фоскарнетом у пяти пациентов со СПИДом и инфекцией вируса ветряной оспы, устойчивой к ацикловиру. Ann Intern Med. 1991; 115: 19–21. [PubMed] [Google Scholar] 64. Исследования глазных осложнений исследовательской группы СПИДа. Смертность у пациентов с синдромом приобретенного иммунодефицита, получавших фоскарнет или ганцикловир от цитомегаловируса ретинита. N Engl J Med. 1992; 326: 213–220. [PubMed] [Google Scholar] 65. Сафрин С., Крампакер С., Чатис П., Дэвис Р., Хафнер Р., Раш Дж. И др.Контролируемое исследование по сравнению фоскарнета и видарабина при лечении ацикловир-резистентного кожно-слизистого простого герпеса при синдроме приобретенного иммунодефицита. N Engl J Med. 1991; 325: 551–555. [PubMed] [Google Scholar] 66. МакГрегор Р. Р., Грациани А. Л., Вайс Р., Грюнвальд Дж. Э., Гамбертольо Дж. Г.. Успешная терапия фоскарнетом при цитомегаловирусном ретините у пациента со СПИДом, находящегося на гемодиализе: обоснование эмпирического дозирования и мониторинга уровня в плазме. Журнал инфекционных болезней. 1991 Октябрь; 164 (4): 785–787.[PubMed] [Google Scholar] 67. Дерай Дж., Мартинес Ф., Катлама С., Левальтье Б., Бофилс Н., Данис М. и др. Нефротоксичность фоскарнета: механизм, частота возникновения и профилактика. Am J Nephrol. 1989. 9 (4): 316–321. [PubMed] [Google Scholar]Грипп и ваш ребенок
Что такое грипп?
Грипп (также называемый гриппом) – это вирус, который может вызывать серьезные заболевания. Это больше, чем просто насморк и боль в горле. Очень важно защитить младенцев и детей младшего возраста от гриппа, потому что они могут серьезно заболеть.В редких случаях грипп может стать причиной смерти. В 2017 году грипп стал причиной рекордного количества смертей среди детей. Большинство умерших детей не получили вакцины от гриппа.
Как распространяется грипп?
Грипп легко передается от человека к человеку. Когда больной гриппом кашляет, чихает или говорит, вирус распространяется по воздуху. Ваш ребенок может заразиться гриппом, если он вдохнет вирус или коснется чего-то (например, игрушки), на котором есть вирус гриппа, а затем коснется своего носа, глаз или рта.
Люди, заболевшие гриппом, могут заразить других от 1 дня до болезни и до 5-7 дней после нее. Люди, которые сильно болеют гриппом, или маленькие дети могут распространять грипп дольше, особенно если у них все еще есть симптомы.
Нужна ли вашему ребенку вакцина от гриппа каждый год?
Да. Центры по контролю и профилактике заболеваний (также называемые CDC) и Американская академия педиатрии (также называемая AAP) рекомендуют делать прививку от гриппа каждый год всем в возрасте 6 месяцев и старше.Это особенно важно для детей младше 5 лет, потому что они чаще, чем дети старшего возраста, имеют серьезные проблемы со здоровьем, вызванные гриппом. Грипп может быть опасен для всех детей, даже для здоровых.
Лучший способ защитить вашего ребенка от гриппа – это делать ему прививку от гриппа каждый год до начала сезона гриппа (с октября по май). Даже если у вашего ребенка больше шансов заразиться гриппом во время сезона гриппа, он может заразиться им в любое время года.
Ваш ребенок может получить вакцину от гриппа двумя способами:
- Прививка от гриппа. Дети от 6 месяцев и старше могут получить прививку от гриппа.
- Спрей назальный от гриппа. Это спрей, который врач вводит вашему ребенку в нос. Большинство детей от 2 лет и старше могут получить назальный спрей от гриппа. Но это не рекомендуется детям с определенными заболеваниями, такими как астма, проблемы с сердцем и легкими, или со слабой иммунной системой, которая плохо защищает его от инфекции. Назальный спрей от гриппа также не рекомендуется детям, которые принимают некоторые лекарства в течение длительного времени, например, аспирин (так называемая долгосрочная терапия аспирином).
Когда ваш ребенок впервые получает вакцину от гриппа, он получает две дозы, чтобы обеспечить ему наилучшую защиту от гриппа. Ваш ребенок будет получать одну дозу вакцины каждый год.
Если вы не уверены, какая вакцина лучше всего подходит для вашего ребенка, спросите его лечащего врача. Посетите flu.gov, чтобы узнать больше о вакцинах от гриппа.
Вакцина против гриппа безопасна для большинства детей, даже для недоношенных (до 37 недель беременности). Но если у вашего ребенка в прошлом была плохая реакция на вакцину от гриппа, сообщите об этом его врачу.Медицинский работник может захотеть внимательно наблюдать за вашим ребенком после вакцинации, чтобы проверить реакцию. Если у вашего ребенка аллергия на яйца, поговорите с его врачом, чтобы решить, можно ли делать прививку от гриппа. Некоторые вакцины против гриппа делают из яиц.
Есть много разных вирусов гриппа, и они постоянно меняются. Каждый год создается новая вакцина от гриппа для защиты от трех или четырех вирусов гриппа, которые могут вызвать заболевание людей во время предстоящего сезона гриппа. Благодаря вакцине защита от гриппа длится около года, поэтому важно ежегодно вакцинировать ребенка.Вы получаете вакцину от его поставщика или из других мест, например, из аптек, которые ее предлагают. Используйте HealthMap Vaccine Finder, чтобы узнать, где можно сделать прививку от гриппа для своего ребенка.
У одних детей больше шансов иметь серьезные проблемы со здоровьем, вызванных гриппом, чем у других?
Да. Младенцы и дети младше 5 лет – и особенно дети младше 2 лет – чаще, чем дети старшего возраста, страдают осложнениями от гриппа. Недоношенные дети также подвержены повышенному риску серьезных осложнений от гриппа.CDC рекомендует, чтобы недоношенные дети получали большинство вакцин, включая вакцину от гриппа, в соответствии с их хронологическим возрастом (время с момента рождения). Даже если ребенок родился маленьким или с низкой массой тела при рождении, он может получить вакцину одновременно с другими младенцами того же возраста. Если у вас недоношенный ребенок, посоветуйтесь с врачом вашего ребенка, чтобы он вовремя получил вакцину от гриппа. Дети с хроническими заболеваниями, такими как астма, сердечные заболевания или заболевания крови, также подвержены высокому риску осложнений от гриппа.
Какие проблемы со здоровьем может вызвать грипп у детей?
Осложнения гриппа у детей младше 5 лет включают:
- Ухудшение хронических заболеваний, таких как сердечные заболевания или астма
- Проблемы с мозгом, например энцефалопатия. Энцефалопатия – это любое заболевание мозга, которое влияет на структуру мозга или его работу.
- Обезвоживание. Это означает, что в вашем теле недостаточно воды.
- Пневмония. Это инфекция одного или обоих легких.
- Проблемы с носовыми пазухами и ушные инфекции. Пазухи – это полые воздушные пространства внутри костей вокруг носа. Инфекции носовых пазух могут возникнуть, когда в носовых пазухах скапливается жидкость.
- Смерть. Осложнения гриппа иногда могут привести к смерти, но это случается редко.
Каковы признаки и симптомы гриппа у вашего ребенка?
Признаки заболевания – это то, что другие люди могут видеть или знать о вас, например, у вас сыпь или вы кашляете. Симптомы – это то, что вы чувствуете сами, чего не могут видеть другие, например, боль в горле или головокружение.Если у вашего ребенка есть какие-либо из этих признаков и симптомов гриппа, немедленно позвоните его врачу или отвезите его к своему поставщику:
- Сильная усталость или сонливость (также называется утомляемостью)
- Кашель
- Лихорадка (100 F или выше), озноб или дрожь тела. Не у всех, кто болеет гриппом, поднимается температура.
- Головная боль, боли в мышцах или теле
- Насморк или заложенность носа
- Боль в горле
- Рвота (рвота) или диарея
Грипп часто возникает быстро.Лихорадка и большинство других признаков и симптомов могут длиться неделю или дольше. В то время как ваш ребенок не может сказать вам, как он себя чувствует, дети, заболевшие гриппом, часто болеют, нервничают и кажутся более неудобными и несчастными, чем дети, заболевшие простудой. Если вы считаете, что ваш ребенок заболел гриппом, даже если он получил вакцину от гриппа, позвоните своему врачу.
Если у вашего ребенка есть какие-либо из этих признаков или симптомов, доставьте его в отделение неотложной помощи больницы:
- Такая суетливая, что не хочет, чтобы ее удерживали
- Голубоватый цвет губ или лица
- Хронические состояния здоровья, такие как астма, ухудшаются
- Учащенное дыхание, затрудненное дыхание, боль в груди или втягивание ребер при каждом вдохе
- Лихорадка у ребенка младше 12 недель, лихорадка выше 104 F у младенцев старшего возраста или детей или лихорадка с сыпью
- Повышение температуры или кашель, которые улучшаются, но затем возвращаются и ухудшаются
- Судорожные припадки.Припадок – это когда все тело или части тела бесконтрольно двигаются.
- Не пьет достаточно жидкости или вырабатывает меньше мочи, чем обычно. Если ваш ребенок не мочится в течение 8 часов, у него сухость во рту или он не плачет, возможно, у него обезвоживание.
- Не просыпается, не бдит и не взаимодействует с вами, когда бодрствует
- Сильная мышечная боль. Это может быть настолько серьезно, что ваш ребенок не может ходить.
- Сильная или не прекращающаяся рвота (рвота)
Как лечат грипп у младенцев и детей?
Лечащий врач вашего ребенка может прописать противовирусное лекарство для профилактики или лечения гриппа.Противовирусное средство – это лекарство, которое убивает инфекции, вызванные вирусами. Противовирусные препараты могут облегчить заболевание гриппа у вашего ребенка и помочь ему быстрее почувствовать себя лучше. Противовирусные препараты также могут помочь предотвратить серьезные осложнения гриппа, такие как легочная инфекция, называемая пневмонией. Против гриппа лучше всего действуют противовирусные препараты, если их использовать в течение 2 дней после появления признаков или симптомов.
Если у вашего ребенка высокий риск заболевания гриппом, его врач может назначить противовирусное средство, как только у него появятся симптомы гриппа. Все дети младше 5 лет подвержены высокому риску заболевания гриппом, особенно дети младше 2 лет.Дети, рожденные недоношенными или страдающие хроническими заболеваниями, такими как астма или серповидно-клеточная анемия, также подвержены высокому риску.
Три лекарства одобрены в США для профилактики или лечения гриппа у детей:
- Осельтамивир (Тамифлю®) для детей в возрасте от 2 недель. Это лекарство выпускается в виде капсул или жидкости.
- Занамивир (Реленза®) для детей от 5 лет. Это лекарство представляет собой порошок, который ребенок вдыхает через рот.Не рекомендуется людям с проблемами дыхания, например астмой.
- Перамивир (Рапиваб®) для детей от 2 лет. Это лекарство вводится врачом через иглу в вену (также называемую внутривенной).
Если у вашего ребенка грипп, помогите ему много отдыхать и пейте много жидкости. Он может не захотеть много есть. Попробуйте кормить его небольшими порциями, чтобы помочь его телу поправиться.
Если ваш ребенок чувствует себя некомфортно из-за лихорадки, спросите у врача, можно ли дать ребенку ацетаминофен (Тайленол®) или ибупрофен (Мотрин® или Адвил®).Не давайте ей аспирин, не посоветовавшись с врачом. Аспирин может вызвать редкое, но опасное для жизни заболевание печени, называемое синдромом Рея, у детей с некоторыми заболеваниями, такими как простуда, грипп и ветряная оспа.
Если у вашего ребенка кашель или простуда, не давайте ему лекарства от кашля и простуды, отпускаемые без рецепта. Это лекарства, которые вы можете купить без рецепта врача. AAP утверждает, что эти лекарства могут вызвать серьезные проблемы со здоровьем у детей. Перед тем, как давать ребенку какие-либо лекарства, поговорите с лечащим врачом.
Как остановить распространение гриппа?
Каждый человек в возрасте 6 месяцев и старше должен пройти вакцинацию от гриппа. Это означает вас, особенно если у вас есть ребенок младше 6 месяцев или вы ухаживаете за ним. Вакцинация от гриппа может помочь предотвратить распространение гриппа.
Если вы или ваш ребенок заболели гриппом, вы можете передать его другим. Вот как предотвратить распространение гриппа:
- Не отпускайте ребенка в детский сад, школу или лагерь в течение как минимум 24 часов после того, как у него спадет температура (100 F или выше).Лихорадку следует снимать без использования лекарства, снижающего температуру.
- Избегайте контактов с другими людьми.
- Не целуйте ребенка и не касайтесь глаз, носа и рта.
- Научите ребенка кашлять или чихать в салфетку или руку. Выбрасывайте использованные салфетки в мусор.
- Мойте руки водой с мылом до и после ухода за ребенком. Вы также можете использовать дезинфицирующие средства для рук на спиртовой основе. Используйте достаточно дезинфицирующего средства для рук, чтобы руки высохли не менее 15 секунд.
- Очистите поверхности и игрушки, на которых может быть вирус гриппа.
- Для мытья посуды и принадлежностей ребенка используйте горячую мыльную воду или посудомоечную машину.
- Не делитесь посудой, стаканами, посудой или зубной щеткой вашего ребенка.
Дополнительная информация
Flu.gov
См. Также: Грипп и беременность, Прививки вашего ребенка
Последнее обновление: сентябрь 2019 г.
Обзор противовирусных препаратов для лечения ВПГ-инфекции у детей
01 августа 2014 г.
Читать 4 мин.
ДОБАВИТЬ ТЕМУ В ОПОВЕЩЕНИЯ ПО ЭЛЕКТРОННОЙ ПОЧТЕ
Получать электронное письмо, когда новые статьи публикуются на
Укажите свой адрес электронной почты, чтобы получать сообщения о публикации новых статей.Подписаться Нам не удалось обработать ваш запрос. Пожалуйста, повторите попытку позже. Если у вас по-прежнему возникает эта проблема, обратитесь по адресу [email protected].Вернуться в Healio
Несколько фармакотерапевтических агентов коммерчески доступны в Соединенных Штатах для лечения инфекции, вызванной семейством герпесвирусов. Однако лишь некоторые из этих агентов были хорошо изучены или отмечены FDA для применения у младенцев и детей, страдающих от инфекции вирусом простого герпеса.За последние несколько лет было опубликовано несколько важных исследований и клинических отчетов, описывающих использование этих противовирусных препаратов, и они рассматриваются здесь.
Возбудители заражения HSV
Ацикловир, наиболее хорошо изученный противовирусный препарат для лечения HSV-инфекции у детей, доступен с 1982 года. Ацикловир – это ациклический гуаниновый нуклеозид, который подавляет синтез ДНК HSV, как только вирус проникает в клетки-хозяева. Это действие ингибирования репликации вирусов терапевтически полезно для младенцев и детей; тем не менее, фармакокинетический профиль ацикловира может ограничивать его терапевтическую ценность.При пероральном применении ацикловир плохо всасывается (от 10% до 30%, причем абсорбция уменьшается по мере увеличения дозировки). Пероральный прием ацикловира составляет от трех до пяти доз в день, поэтому адекватное соблюдение режима лечения может вызывать практические проблемы.
Валацикловир является пролекарством ацикловира и при пероральном приеме метаболизируется до ацикловира путем ферментативного гидролиза в кишечнике и печени. В отличие от ацикловира валацикловир очень хорошо всасывается при пероральном приеме (биодоступность от трех до пяти раз выше по сравнению с ацикловиром).Однако валацикловир не так хорошо изучен для применения у детей, как ацикловир; он отмечен FDA для лечения лабиального герпеса (герпеса) у детей старшего возраста (в возрасте 12 лет и старше) и для лечения ветряной оспы у иммунокомпетентных детей в возрасте от 2 лет и старше. Валацикловир коммерчески доступен в виде таблеток (Valtrex, GlaxoSmithKline; и дженерик), хотя рецепт приготовления суспензии 25 мг / мл или 50 мг / мл для использования у младенцев и детей в возрасте от 3 месяцев и старше доступен во вкладыше к упаковке.
Эдвард А. Белл
Валацикловир предназначен для приема два раза в день (лабиальный герпес) или трижды в день (ветряная оспа). Фамцикловир (Фамвир, Новартис) – еще одно противовирусное средство, доступное для лечения инфекции ВПГ. Фамцикловир также считается пролекарством и метаболизируется до активной формы пенцикловира. Фамцикловир не предназначен для использования в педиатрии и плохо изучен у детей. Его использование у взрослых включает лечение лабиального герпеса, генитальной герпетической инфекции и опоясывающего герпеса.
Ацикловир и валацикловир
Ацикловир хорошо изучен у младенцев и детей и чаще всего является противовирусным препаратом выбора для младенцев и детей с первичной и рецидивирующей инфекцией ВПГ. Ацикловир коммерчески доступен в виде пероральных таблеток или капсул, пероральных буккальных таблеток, пероральной суспензии и раствора для внутривенного введения в виде генерических и фирменных лекарственных форм (Zovirax, GlaxoSmithKline). Валацикловир предназначен для использования у более молодых иммунокомпетентных детей (в возрасте 2 лет и старше), больных ветряной оспой.Валацикловир дополнительно рекомендован для применения у детей в возрасте от 12 лет с лабиальным герпесом (2 г два раза в день в течение 1 дня). Рекомендации, перечисленные в Красной книге 2012 г., описывают потенциальные преимущества валацикловира по сравнению с ацикловиром при лечении отдельных детей с ослабленным иммунитетом, заболевших ветряной оспой (например, ВИЧ-инфицированных с относительно нормальными концентрациями CD4 + Т-лимфоцитов; дети с лейкемией и хорошее наблюдение -up), благодаря улучшенной пероральной биодоступности. Однако это использование не по назначению.
Хотя ацикловир может эффективно управлять рецидивирующими генитальными инфекциями ВПГ, его низкая биодоступность ограничивает его потенциальную эффективность, так как требуется от трех до пяти ежедневных доз. Валацикловир не изучался у детей младше 18 лет и предназначен для приема дважды в день у взрослых с рецидивирующими эпизодами ВПГ. Хроническая супрессивная терапия может быть начата с ацикловира два раза в день (дети старшего возраста и взрослые) и с валацикловира один раз в день (взрослые). Хотя ацикловир доступен в виде кремов и мазей для местного применения, в соответствии с Красной книгой 2012 года использование этих лекарственных форм при лечении лабиального герпеса или генитальных инфекций ВПГ не рекомендуется.
Пенцикловир дополнительно доступен в виде крема для местного применения (Denavir, Prestium Pharma). Он отмечен FDA для детей старшего возраста (в возрасте 12 лет и старше) от рецидивирующего губного герпеса, хотя он также не рекомендован в Красной книге 2012 года.
Поскольку инфицирование ВПГ в неонатальном периоде часто приводит к значительной заболеваемости и смертности, недавние исследования были проведены для оценки преимуществ дополнительного лечения после 14–21-дневного внутривенного курса лечения ацикловиром у новорожденных с ВПГ.В исследовании, опубликованном в 2011 году, Кимберлин и его коллеги сравнили пероральный ацикловир с плацебо у новорожденных с заболеванием ВПГ и центральной нервной системой (ЦНС) или поражением кожи, глаз и рта рандомизированным слепым методом. После завершения 14–21-дневного режима внутривенного введения ацикловира пациентам в исследовании давали ацикловир перорально или плацебо в течение 6 месяцев. Новорожденные с поражением ЦНС в исследовании, получавшие ацикловир, показали значительно более высокие показатели умственного развития по шкале Бейли через 12 месяцев по сравнению с новорожденными, получавшими плацебо.
Доступны эффективные методы лечения
Таким образом, инфекция HSV может привести к значительной заболеваемости и смертности младенцев и детей. Выявление младенцев с риском заражения ВПГ имеет важное значение; в 2013 г. в журнале «Педиатрия» был опубликован клинический отчет, призванный помочь педиатрам-клиницистам вести таких детей. Ацикловир может эффективно лечить первичную и рецидивирующую инфекцию ВПГ, хотя его фармакокинетический профиль может ограничивать его использование у отдельных пациентов и по показаниям из-за низкой биодоступности и необходимости частое дозирование.Валацикловир, пролекарство ацикловира, лучше всасывается при пероральном приеме и его можно вводить реже, хотя данные, подтверждающие его эффективность у младенцев и детей, не столь убедительны.
Хотя валацикловир коммерчески недоступен в виде жидкой лекарственной формы, жидкую суспензию для перорального применения можно приготовить по известному рецепту. Когда ацикловир используется для длительного подавления вируса, рекомендуется мониторинг нейтропении и поддержание адекватной гидратации для ограничения нефротоксичности.
Артикул:
Кимберлин DW. Clin Infect Dis. 2010; 50: 221-228.
Kimberlin DW. N Engl J Med. 2011; 365: 1284-1292.
Kimberlin DW. Педиатрия. 2013; 131: e635-e646.
Pinninti SG. Pediatr Clin North Am. 2013; 60: 351-365.
Для дополнительной информации:
Эдвард А. Белл, фармацевт, BCPS, , профессор фармацевтической практики в Колледже фармацевтики и медицинских наук Университета Дрейка и детской больнице и клиниках Бланка, Де-Мойн, штат Айова.Он также является членом редакционной коллегии журнала «Инфекционные болезни у детей» . С Bell можно связаться по адресу [email protected].
Раскрытие информации: Bell не сообщает о раскрытии соответствующей финансовой информации.
ДОБАВИТЬ ТЕМУ В ОПОВЕЩЕНИЯ ПО ЭЛЕКТРОННОЙ ПОЧТЕ
Получать электронное письмо, когда новые статьи публикуются на
Укажите свой адрес электронной почты, чтобы получать сообщения о публикации новых статей.Подписаться Нам не удалось обработать ваш запрос. Пожалуйста, повторите попытку позже. Если у вас по-прежнему возникает эта проблема, обратитесь по адресу [email protected].Вернуться в Healio
Грипп у младенцев и детей ясельного возраста – симптомы, лечение и профилактика гриппа
Детский грипп (сокращенно от «гриппа») – это тот же вирус, что и взрослый, но грипп не поражает младенцев и детей ясельного возраста. Кстати, как это делают взрослые.
Эта заразная и распространенная вирусная инфекция горла, носа и легких обычно поднимает свою уродливую голову в период с октября по апрель или даже в мае.
Разница в том, что любой ребенок до 5 лет считается «группой повышенного риска», потому что маленькие дети более подвержены осложнениям от гриппа, включая пневмонию, чем здоровые взрослые.
Поэтому, если вы подозреваете, что у вашего малыша грипп, немедленно позвоните своему врачу, чтобы поставить точный диагноз и пройти обследование.
Симптомы гриппа у младенцев и симптомы гриппа у детей ясельного возраста
Общие симптомы гриппа у младенцев и малышей включают:
- Лихорадка
- Сухой кашель
- Боль в горле
- Насморк или заложенность носа
- Мышечные боли и боли
- Головная боль
- Истощение
- Озноб
- Потеря аппетита
- Головокружение
- Иногда тошнота, рвота и / или диарея
Имейте в виду, что некоторые из этих симптомов аналогичны симптомам COVID-19, хотя этот вирус часто проявляется не чем иным, как легкой простудой у младенцев и детей ясельного возраста.Если ваш ребенок болен какими-либо гриппоподобными симптомами, ваш педиатр, вероятно, попросит ее пройти тест на COVID-19, чтобы исключить это, а также на грипп, если тест на COVID окажется отрицательным.
Грипп у младенцев и грипп у детей ясельного возраста – что вызывает грипп у детей?
Виновником гриппа у младенцев и детей ясельного возраста является вирус гриппа, множество штаммов которого циркулируют по всему миру каждый год.
Ваш ребенок может заразиться гриппом, вступив в контакт с инфицированным человеком, особенно если этот больной маленький – или большой – кто-то чихает или кашляет на нее.
Ваш ребенок также может заболеть гриппом, дотронувшись до чего-то (игрушки, чашки-поилки), к которому прикоснулся инфицированный человек, а затем прикоснувшись к своему рту, носу или глазам.
Советы по здоровью для посетителей младенцев
Сколько времени нужно, чтобы симптомы гриппа проявились у младенцев и детей ясельного возраста?
У ребенка (или взрослого) симптомы гриппа обычно проявляются через один-четыре дня после заражения вирусом.
Сколько длится грипп у детей?
Если ваш ребенок заболел гриппом, симптомы обычно длятся около недели, но могут сохраняться до двух недель.Связанный с этим кашель иногда может длиться до четырех недель.
В чем разница между гриппом и желудочным гриппом?
Не путайте грипп с желудочным гриппом (он же гастроэнтерит). Это вызвано множеством других вирусов, не относящихся к гриппу, и приводит к сильной диарее и рвоте, иногда с лихорадкой.
Хотя грипп может сопровождаться рвотой, тошнотой и диареей, существуют и другие симптомы, такие как боли в теле, лихорадка, озноб, боль в горле и заложенность носа или кашель, которые не сопровождают вирусы желудка.Плюс гастроэнтерит обычно проходит намного быстрее.
Как долго ваш ребенок заразен гриппом?
Если кто-то болен гриппом, он может быть заразным за день до появления симптомов и может продолжать распространять болезнь через пять-семь дней после первого дня появления симптомов.
Но младенцы, малыши и дети старшего возраста могут быть заразными еще дольше, поэтому будьте осторожны, подвергая своего малыша контакту с больным гриппом.
Лечение гриппа у младенцев и детей ясельного возраста
В первую очередь, позвольте вашему ребенку обратиться к педиатру для диагностики и лечения гриппа.Дома ваше внимание будет сосредоточено на том, чтобы вашему малышу было комфортно, и на оказании ему ухода, необходимого для выздоровления.
Ваш врач, вероятно, порекомендует следующие методы лечения гриппа (но опять же, поговорите с педиатром и / или обратитесь к педиатру, чтобы получить медицинскую консультацию вам и вашему ребенку):
- Отдых. Помогите своему малышу как можно больше расслабиться, позволяя ему вздремнуть как можно чаще и поощряя много спокойных занятий в течение дня.
- Жидкости. Предложите много жидкости, чтобы предотвратить обезвоживание из-за лихорадки и потери аппетита. Вы можете продолжать кормить ребенка грудью и кормить его из бутылочки; если она ест твердую пищу, попробуйте дать ей немного яблочного пюре или бульона. Вы также можете дать своему малышу фруктовое мороженое.
- Обезболивающие. Дайте парацетамол или ибупрофен, чтобы снизить температуру, если она есть, и облегчить боль в теле (но не давайте ибупрофен детям младше 6 месяцев и никогда не давайте аспирин младенцам или детям ясельного возраста) в соответствии с рекомендациями врача и на этикетке.
- Противовирусные препараты. Ваш врач должен быть в состоянии прописать вашему ребенку или малышу безопасное противовирусное лекарство от гриппа, которое может сократить продолжительность вируса, облегчить симптомы и предотвратить осложнения гриппа, но эти лекарства необходимо давать в течение первых 48 часов после появления симптомов. начиная. Это еще одна причина, чтобы как можно скорее обратиться к педиатру с больным ребенком. И некоторые педиатры не рекомендуют их детям, потому что, хотя противовирусные препараты могут быть эффективными, они могут иметь серьезные побочные эффекты, от легких (тошнота или диарея) до более серьезных (рвота и галлюцинации).Вы и ваш врач должны обсудить риски и преимущества этих лекарств, особенно для вашего ребенка.
Еще несколько советов относительно того, что делать с гриппом у вашего ребенка или малыша:
Поскольку от гриппа вы часто чувствуете то жарко, то холодно, вы можете одеть ребенка в несколько слоев, которые вы можете снять. – или добавить – при необходимости.
Возможно, вы захотите использовать несколько капель в нос с физиологическим раствором, а затем резиновую присоску (которую вы найдете в проходе для младенцев в аптеке), чтобы удалить закупоренную слизь, особенно если заложенность носа мешает вашему ребенку отдыхать, есть или чувствовать себя комфортно.
Увлажнитель с холодным туманом, работающий в комнате вашего ребенка, особенно ночью, также может быть полезен (избегайте испарителя с горячей водой, который потенциально может обжечь вашего малыша, если она прикоснется к нему).
Никогда не давайте младенцам и малышам безрецептурные детские лекарства от простуды и гриппа, поскольку они не помогают и могут нанести вред. Всегда уточняйте у врача, что вы можете сделать, чтобы помочь своему ребенку вылечиться от гриппа.
Как предотвратить грипп у младенцев и детей ясельного возраста
Во время беременности защитить растущего ребенка от микробов гриппа несложно.Уютные и надежно запечатанные в этом уютном маточном коконе еще не родившиеся дети защищены от простуды и гриппа, даже если вы еще не родились. Но можно ли предотвратить заражение вашего малыша гриппом после рождения?
Защита новорожденного:
Перенесемся в жизнь вашего ребенка вне матки, особенно в первые шесть месяцев, прежде чем она сможет пройти безопасную вакцинацию от гриппа – и это может быть совсем другая история.
Как только ваш ребенок сделает эти первые вдохи воздуха, или коснется этих первых поверхностей, или его крошечные ручки сжимают и целуют посетители, которые приходят с микробами вместе со своими подарками, цветами и воздушными шарами, ваш ребенок становится уязвимым для вируса гриппа. .
И из-за ее новой, еще не проверенной иммунной системы, она особенно уязвима для серьезных осложнений гриппа, которые могут быть опасными для жизни.
Поскольку дети младше 6 месяцев еще недостаточно взрослые, чтобы сделать прививку от гриппа, эксперты рекомендуют сделать вакцинацию всем остальным членам семьи, включая тех, кто ухаживает за вашим ребенком.
Беременным мамам также нужна прививка от гриппа, чтобы защитить не только себя, но и своих будущих детей, пока они не станут достаточно взрослыми, чтобы пройти вакцинацию.Если вы решите кормить грудью, ваш ребенок также может получить часть ваших защитных антител с грудным молоком.
И убедитесь, что вы и все, с кем контактирует ваш ребенок, предприняли дополнительные меры, чтобы защитить себя от гриппа, часто мыть руки. Пока вы в пути, возьмите с собой дезинфицирующий гель для рук или салфетки на спиртовой основе на тот случай, если вас поймают с грязными рукавицами и никакой раковины в поле зрения.
Вам также следует сделать все возможное, чтобы ваша собственная иммунная система оставалась сильной, придерживаясь здоровой диеты (без пропуска приемов пищи), много отдыхая и следя за тем, чтобы фитнес стал частью вашей напряженной жизни.
Защита вашего ребенка после 6 месяцев:
Врачи рекомендуют вакцину от гриппа всем детям в возрасте от 6 месяцев в качестве наилучшей защиты от заражения вирусом. Если у вашего ребенка хроническое заболевание, такое как астма или диабет, ему особенно важно пройти вакцинацию, поскольку грипп с большей вероятностью приведет к осложнениям у детей с другими проблемами со здоровьем.
Сделайте прививку ребенку до или в начале сезона гриппа, по возможности, к октябрю (но еще не поздно сделать прививку позже в этом сезоне).
Даже если доминирующие вирусы гриппа в этом сезоне окажутся отличными от штаммов, от которых защищает вакцина, вакцинация может облегчить симптомы гриппа. Так что, несмотря ни на что, у вашего ребенка будет определенный уровень защиты.
Вот еще несколько хороших способов защитить вашего ребенка или малыша от заражения гриппом:
- Регулярно мойте ребенку руки (и научите его основам мытья рук).
- По возможности держитесь подальше от других больных детей и родителей (и их тканей!), Чтобы избежать болезней.Если вы или ваш ребенок контактируете с больными людьми, следует как можно скорее после этого тщательно вымыть руки (и даже принять ванну). Так же обстоит дело с стиркой всей потенциально зараженной одежды и протиранием игрушек, книг и других предметов домашнего обихода дезинфицирующим средством.
- Убедитесь, что ваш ребенок много отдыхает, пьет жидкость и одет по погоде во время сезона гриппа, даже если он не болен.
- Используйте детские салфетки и / или дезинфицирующее средство для рук в крайнем случае, если мытье посуды теплой водой с мылом невозможно сразу.
Когда звонить врачу
Если вы подозреваете, что ваш ребенок или малыш в раннем возрасте заразился гриппом, немедленно звоните своему врачу. И обязательно немедленно обратитесь к педиатру, если вы заметили следующие тревожные симптомы:
- Если вашему ребенку меньше 3 месяцев и у него температура 100,4 градуса по Фаренгейту или выше, немедленно обратитесь к врачу. Грипп может привести к серьезным осложнениям, особенно у маленьких детей, поскольку у них еще не было возможности укрепить свою иммунную систему.Если вашему ребенку от 3 месяцев до 3 лет, позвоните своему врачу с любой температурой выше 100,4 градуса по Фаренгейту, потому что вашему ребенку нужно будет пройти тест на COVID-19, чтобы исключить это. Если ее температура достигнет 101,5 градуса по Фаренгейту или выше, вы захотите, чтобы вашего ребенка проверили, даже если у него отрицательный результат на коронавирус.
- Сильная раздражительность (например, ваш ребенок даже не хочет, чтобы его держали)
- Недостаточное потребление жидкости
- Лихорадка с любым типом сыпи
- Симптомы улучшаются, но затем возвращаются хуже, чем раньше (это может быть признаком пневмонии или другая серьезная инфекция)
- Учащенное или затрудненное дыхание
- Синеватый цвет кожи или губ
- Ваш ребенок выглядит растерянным, не взаимодействует и не просыпается или у него судороги