Отофаг при гайморите: Гель Микромир Отофаг с бактериофагами
Гель Микромир Отофаг с бактериофагами – «Гель-убийца бактерий: действительно ли лечит стафилококк и стрептококковую инфекцию? (+ состав + инструкция к препарату + НЕОДНОКРАТНЫЙ опыт применения у всей семьи и маленького ребенка)»
Предисловие: расскажу немного истории, чтобы было понятно, с какого перепугу мы стали использовать этот новомодный препарат.
Гель с бактериофагами “ОТОФАГ” был назначен нам врачем в составе комплексной терапии при лечении стрептококковой инфекции, подхваченной в модных сейчас соляных пещерах. Назначался ребенку, но мы его использовали всем семейством, поскольку во время болезни ребенка сами начали заболевать.
Все члены семьи применяли “Отофаг” как самостоятельное профилактическое средство. Ребенка им мазали в комплексе с другими средствами… впрочем, использовали мы по 2 курса (все вместе), поскольку после стрептококковой ребенок притащил фарингит, тонзиллит, а посев на стафилококк показал обсеменение 10 в 5 степени. И вот второй раз был уже вообще нешуточный, потому что полегла вся семья с гнойным горлом.
И вот второй раз был уже вообще нешуточный, потому что полегла вся семья с гнойным горлом.
Ниже расскажу про оба опыта использования, а сейчас пока про сам гель “Отофаг”.
упаковка геля Отофаг
Пользовательские характеристики:
Гель с бактериофагами “Отофаг” представляет собой абсолютно прозрачный, бесцветный гель во флаконе с дозатором. Пользоваться довольно удобно как раз из-за дозатора.
Аромата никакого не имеет вообще. Вкуса – тоже. Вообще при первом применении подумала что это какой-то обычный-пустой косметический продукт, в котором нет никаких бактериофагов… и вообще ничего нет. Короче, на первый взгляд и вкус – “разводилово” (пардон за мой французский).
После парочки применений стала замечать, что при закладывании в нос, у меня появляется в носу не то чтобы запах, а некое ощущение, как будто легчайшие испарения чего-то токсичного попали в носоглотку. Ощущение это быстро пропадает и его не сразу можно заметить.
Тем не менее, аллергии этот гель не вызвал ни у кого из нас.
внешний вид геля “Отофаг”
ОПЫТ ИСПОЛЬЗОВАНИЯ И ЭФФЕКТИВНОСТЬ:
Гель “Отофаг” примечателен тем, что содержит бактериофаги 32 видов. Это немало. Во всяком случае, производитель указал именно эту цифру.
Сами бактериофаги являются “пожирателями” бактерий. Производитель позаботился о том, чтобы объяснить кто такие эти бактериофаги. Не вижу смысла перепечатывать тут производителя, всё можете прочесть на фото инструкции (объяснения вполне доступные для рядового потребителя).
Эти вот бактериофаги должны были сожрать наши бактреии в носу и глотке. Тем более, что содержимое наших носов и рта доктора определили однозначно как – бактериальное.
Итак, нам надлежало использовать “Отофаг” в рот и в нос в течении 7 дней (второй раз уже на 2 недели назначили) по 3 раза в сутки. Для ребенка помимо “Отофага” были назначены и другие препараты. В первый раз, при стрептококковой инфекции помимо “отофага” применялся еще и антибиотик.
инфо на упаковке геля Отофаг
Опыт применения №1.
У ребенка: ринит, фарингит, аденоидит и стрептококковая. Больше всех помог антибиотик. В рот ему этот “Отофаг” совершенно неудобно использовать. К тому же, почему-то при использовании во рту ребенок визжит и упирается как сумасшедший. При использовании для носа – нормально переносит и не сопротивляется (да для носа и удобнее его пользовать).
Наибольший эффект, разумеется, дали антибиотики. Что там дал “Отофаг – сложно понять. Мне показалось, что толку от него почти не было ребенку. Во всяком случае, ничего необыкновенного я не увидела, инфекция развивалась своим чередом, никакого облегчения не намечалось. Температура была сатанинская, сбивалась тяжело и ненадолго. Именно поэтому и назначили антибиотик (после него сразу стали поправляться).
Мне показалось, что толку от него почти не было ребенку. Во всяком случае, ничего необыкновенного я не увидела, инфекция развивалась своим чередом, никакого облегчения не намечалось. Температура была сатанинская, сбивалась тяжело и ненадолго. Именно поэтому и назначили антибиотик (после него сразу стали поправляться).
Применение у взрослых: на тот момент, когда ребенок уже лечился антибиотиками, у меня тоже (впрочем, как обычно когда болеет ребенок) наметилось воспаление в горле. Только у меня еще и сопли показались. Поскольку “Отофаг” заявлен как профилактическое средство, то я сразу же его стала использовать точно так же, как было назначено ребенку.
В итоге, после первого же применения “Отофага” вся слизь в носу и носоглотке собралась в один комок и покинула меня. Нос задышал, был сухой и более ничего не появлялось. У мужа – то же самое. Радостно стали мазать его на себя далее… А далее никакого эффекта не последовало. “Отофаг” не помогал ни от чего. .. ну разве что насморк так больше и не появился. Горлу легче не становилось. Поэтому, не отпользовав его 2 недели – забросили, всё-равно пришлось пить антибиотики, поскольку инфекция продолжала развиваться и становилось всё хуже. Убедились, что как профилактика этот гель не сработал никак и даже не облегчил судьбу ни на сколько.
.. ну разве что насморк так больше и не появился. Горлу легче не становилось. Поэтому, не отпользовав его 2 недели – забросили, всё-равно пришлось пить антибиотики, поскольку инфекция продолжала развиваться и становилось всё хуже. Убедились, что как профилактика этот гель не сработал никак и даже не облегчил судьбу ни на сколько.
Короче говоря, первый курс приема как у ребенка так и у нас был полностью провальный. Далее мы долго (всего-то целый месяц) не возвращались к этому “Отофагу”, проклянув его и аптеки. продающие всякую бутафорию, в которой нормальный человек ногу сломит в попытках выбрать что-то нормальное-лечебное.
инфо на упаковке геля Отофаг
Опыт применения №2
Через месяц ребенок притащил из сада (впрочем, как обычно… не могу понять, туда здоровых не водят что ли?) очередную заразу. Снова слег. Снова назначили кучу средств для горла, потому что фарингит, синусит, ринит и фиг-поймешь-что-ещё развивалось стремительно. Причем у всех нас разом.
Причем у всех нас разом.
Вот на этот раз посев из носа, и зева продемонстрировал стафилококк 10 в 5 степени.
Снова среди прочих был назначен “Отофаг”. И вот в этот раз он себя почти полностью реабилитировал. Итак…
Результаты у ребенка: смогли обойтись без применения антибиотиков. Правда, долго возились с горлом и носом. Гораздо дольше чем в первый раз. Удавалось даже “Отофаг” запихивать в рот (он при проглатывании – безобиден, судя по заявлениям производителя), а не только в нос.
Тут я воочию убедилась что он – не пустышка. Как только у ребенка зашмыгал нос – заложила в нос “Отофаг” и уже через минут 20 нос был сухой, дышал свободно. С “Отофагом” все ночи спали спокойно, не задыхались. Корки (бактериальные) в носу отделялись постоянно (были совершенно сухие) и конечно, мешали иногда дышать полноценно, но это было точно лучше, чем ночные вопли при забитом соплями носе (когда ребенок ими захлебывался или забывал дышать ртом, а носом дышать не мог из-за заложенности).
Горлу тоже легче становилось именно после применения “Отофага”, это заметно было потому, что когда его не применяли, ребенок почти ничего не ел. Он вообще плохо ест, когда ему в горле что-то мешает (при тонзиллите, фарингите и иже с ними). Полоскания помогали плохо, потому что маленький ребенок не в состоянии (от слова “вообще”) полноценно прополоскать себе горло.
Еще назначили 5 сеансов КУФ. Не заметила, чтобы они принесли какую-то ощутимую пользу. Их назначили позднее, чем “Отофаг” и ситуацию КУФ не улучшил (правда, и не ухудшил). Помимо “Отофага” в нос еще и стафиллококковый бактериофаг (отдельный) капали. Для чего смешивать стафилококковый бактериофаг с “Отофагом” (в котором также присутствуют стефилококковый бактериофаг) – мне неясно. Но раз доктор назначил – сделали.
Нет я не призываю слепо следовать назначениям врача. Если бы он мне назначил антибиотик и еще антибиотик – я бы призадумалась. А бактериофаг плюс еще бактериофаг меня не так сильно напрягали. Тем более, что производитель “Отофага” уверяет, будто бактериофаги между собой не конфликтуют.
Тем более, что производитель “Отофага” уверяет, будто бактериофаги между собой не конфликтуют.
В-общем, долго мучились без антибиотиков. Но пить 2 курс антибиотиков через месяц после первого я как-то совсем не желаю. Да врачи особо и не настаивали. В-общем, кое-как выпутались… спасались, можно сказать, одними бактериофагами и прочими антибактериальными штуками (например спреями для орошения полости рта).
И если в первый раз (см. опыт использования №1) нам врач его назначил на 7 дней, то во второй раз мы спустя 7 дней к нему явились с жалобами, что никак не можем вылечиться окончательно, хоть ситуация и улучшилась… тогда нам разрешили его использовать еще неделю.
Результаты у взрослых: если в первый раз результаты от “Отофага” были невразумительны и неоднозначны, то во второй раз я в него уверовала. Использовать его стала почти сразу, так как у меня быстро обострился мой хронический тонзиллит почти одновременно с ребенком.
Все спреи антибактериальные помогали только на час-полтора. Полоскания – тоже. Вспомнив про “Отофаг” намазала себе им везде… ну разве что не использовала как вагинальные тампоны… В итоге, боль в горле пропала уже через 15 минут после нанесения. А к утру (при намазывании на ночь) миндалина в горле уменьшилась почти в 2 раза и глотать стало совсем нормально. Даже “ломка” (которая обычно бывает в самом начале болезни) и то – исчезла. На минуточку, никаких таблеток я не использовала вообще. Только полоскания для рта (которые помогали кратковременно) и спреи, которые помогали только облегчить дыхание и никак не помогали вылечить горло.
На второй день использования геля миндалина полностью убралась и из горла вылезло что-то там… Почувствовала было себя совсем вылечившейся (в первые дни температура была, но не слишком высокая, как только горло пришло в норму – она пропала), но тут воспалилась вторая миндалина (с другой стороны).
Основная проблема была в том, что если забыть про “Отофаг”, то всё возвращалось на круги своя, только в меньших масштабах. Пришлось его мазать постоянно (не менее 3 раз в день и обязательно – на ночь) и провозиться с этим не менее 2 недель. С антибиотиками эта проблема решалась уже в первые 2 дня использования.
Нет, я не призываю лопать антибиотики при каждом удобном случае, просто сравниваю действие этих средств.
инструкция к гелю Отофаг
В итоге, муж вообще не выдержал этой тягомотины и выпил-таки курс антибиотиков. Он-то из нас всех очень быстро выздоровел. Уже на вторые сутки после приема антибиотика – прыгал как здоровый. Мы с ребенком провозились не менее 10 дней и потом еще наблюдали всякие остаточные явления.
Тут еще надо отметить, что бактериофаг в горло засовывать продуктивнее после полоскания хлоргексидином. Очень хорошие результаты дает. Если же горло смазывать бактериофагами прямо поверх гнойного налета, то облегчение и улучшение наступает, но как-то быстро возвращается снова и выздоровление замедляется. Этот способ мы не сразу обнаружили.
Если же горло смазывать бактериофагами прямо поверх гнойного налета, то облегчение и улучшение наступает, но как-то быстро возвращается снова и выздоровление замедляется. Этот способ мы не сразу обнаружили.
инструкция к гелю Отофаг
ИТОГИ:
По-моему, довольно неоднозначное средство. И – слабенькое. Но иногда помогает обойтись без антибиотика и сильно облегчить ситуацию. Правда, доктор нам радостно сообщила, что у нас не было фолликулярной ангины. Во всяком случае, она ее у нас не увидела. По всей видимости, с чем-то более серьезным этот “Отофаг” бы и не справился.
В-общем, как профилактика “Отофаг” если и эффективен, то не всегда. При первом применении (когда заболели в первый раз) он себя проявил слабо. В сущности, только нос эффективно осушал.
Во второй раз эффективность была сильно заметна, однако это не помешало нам переболеть, хоть и в облегченном варианте.
инструкция к гелю Отофаг
Оценку средству снизила за то, что непонятно какие испарения ощущаются в момент намазывания этого геля на слизистые оболочки моего организма. Меня это напрягает и хочется надеяться, что сильно опасного в этом ничего нет. Просто у нас не было выбора – или это непонятное нечто на себя мазать или антибиотики. Оба эти варианта мне представлялись отвратительными и сомнительными, поэтому пришлось выбирать бактериофаги (если это именно они там).
Меня это напрягает и хочется надеяться, что сильно опасного в этом ничего нет. Просто у нас не было выбора – или это непонятное нечто на себя мазать или антибиотики. Оба эти варианта мне представлялись отвратительными и сомнительными, поэтому пришлось выбирать бактериофаги (если это именно они там).
инструкция к гелю Отофаг
инструкция к гелю Отофаг
Страница не найдена | Ліки-Інфо
ДОСТАВКА ТОВАРА ПО ВСЕЙ УКРАИНЕАвдеевка, Александрия, Александровск, Алмазная, Алупка, Алушта, Алчевск, Амвросиевка, Ананьев, Андрушёвка, Антрацит, Апостолово, Армянск, Артёмово, Артёмовск, Артёмовск, Арциз, Ахтырка, Балаклея, Балта, Бар, Барановка, Барвенково, Батурин, Бахмач, Бахчисарай, Баштанка, Белая Церковь, Белгород, Белз, Белицкое, Белогорск, Белозёрское, Белополье, Беляевка, Бердичев, Бердянск, Берегово, Бережаны, Березань, Березно, Березо́вка, Берестечко, Берислав, Бершадь, Бобринец, Бобрка, Бобровица, Богодухов, Богуслав, Болград, Болехов, Борзна, Борислав, Борисполь, Борщёв, Боярка, Бровары, Броды, Брянка, Бурштын, Бурынь, Буск, Буча, Бучач, Валки, Васильевка, Васильков, Ватутино, Вахрушево, Вашковцы, Великие Мосты, Верхнеднепровск, Верховцево, Вижница, Вилково, Винники, Винница, Виноградов, Вишнёвое, Владимир, Вознесенск, Волноваха, Волочиск, Волчанск, Вольногорск, Вольнянск, Ворожба, Вышгород, Гадяч, Гайворон, Гайсин, Галич, Геническ, Герца, Глобино, Глухов, Глиняны, Гнивань, Голая Пристань, Горловка, Горное, Горняк, Городенка, Городище, Городня, Городок, Городок, Горохов, Гребёнка, Гуляйполе, Дебальцево, Деражня, Дергачи, Джанкой, Дзержинск, Димитров, Днепродзержинск, Днепропетровск, Днепрорудное, Добромиль, Доброполье, Докучаевск, Долина, Долинская, Донецк, Дрогобыч, Дружба, Дружковка, Дубляны, Дубно, Дубровица, Дунаевцы, Евпатория, Енакиево, Жашков, Ждановка, Жёлтые Воды, Жидачов, Житомир, Жмеринка, Жолква, Залещики, Запорожье, Заставна, Збараж, Зборов, Звенигородка, Здолбунов, Зеленодольск, Зеньков, Зимогорье, Змиёв, Знаменка, Золотое, Золотоноша, Золочев, Зоринск, Зугрэс, Ивано, Измаил, Изюм, Изяслав, Иловайск, Ильинцы, Ильичёвск, Инкерман, Ирмино, Ирпень, Иршава, Ичня, Кагарлык, Казатин, Калиновка, Калуш, Каменец, Каменка, Каменка, Каменка, Камень, Канев, Карловка, Каховка, Керчь, Киверцы, Киев, Килия, Кировоград, Кировское, Кицмань, Кобеляки, Ковель, Кодыма, Коломыя, Комсомольск, Конотоп, Константиновка, Корец, Коростень, Коростышев, Корсунь, Корюковка, Косов, Костополь, Котовск, Краматорск, Красилов, Красноармейск, Красноград, Краснодон, Краснопартизанск, Красноперекопск, Красный Лиман, Красный Луч, Кременец, Кременчуг, Кривой Рог, Кролевец, Кузнецовск, Купянск, Ладыжин, Лановцы, Лебедин, Лисичанск, Лозовая, Лохвица, Лубны, Луганск, Лутугино, Луцк, Львов, Любомль, Люботин, Малин, Марганец, Мариуполь, Макеевка, Малая Виска, Мелитополь, Мена, Мерефа, Миргород, Мироновка, Миусинск, Могилёв, Молодогвардейск, Молочанск, Монастыриска, Монастырище, Мостиска, Мукачево, Надворная, Николаев, Николаев, Никополь, Нежин, Немиров, Нетешин, Новая Каховка, Новая Одесса, Новый Буг, Новоазовск, Нововолынск, Новгород, Новогродовка, Новомиргород, Новоград, Новодружеск, Новоднестровск, Новомосковск, Новопсков, Новоселица, Новоукраинка, Новый Роздол, Носовка, Обухов, Овруч, Одесса, Орджоникидзе, Орехов, Острог, Очаков, Павлоград, Первомайск, Первомайск, Первомайский, Перевальск, Перемышляны, Перечин, Перещепино, Переяслав, Першотравенск, Петровское, Пирятин, Погребище, Подволочиск, Подгайцы, Подгородное, Пологи, Полонное, Полтава, Попасная, Почаев, Приволье, Прилуки, Приморск, Припять, Пустомыты, Путивль, Пятихатки, Рава, Радехов, Радомышль, Радивилов, Рахов, Ржищев, Рогатин, Ровеньки, Ровно, Рожище, Ромны, Рубежное, Рудки, Саки, Самбор, Сарны, Свалява, Сватово, Свердловск, Светловодск, Севастополь, Северодонецк, Седнев, Селидово, Семёновка, Середина, Симферополь, Синельниково, Скадовск, Скалат, Сквира, Сколе, Славута, Славутич, Славянск, Смела, Снежное, Снигирёвка, Снятын, Сокаль, Сокиряны, Соледар, Старобельск, Староконстантинов, Старый Крым, Старый Самбор, Стаханов, Сторожинец, Стрый, Судак, Сумы, Суходольск, Счастье, Таврийск, Тальное, Тараща, Татарбунары, Теплодар, Тернополь, Терновка, Тетиев, Тысменица, Тлумач, Теребовля, Тростянец, Трускавец, Токмак, Торез, Тульчин, Тячев, Угледар, Угнев, Узин, Украинка, Ужгород, Умань, Устилуг, Фастов, Феодосия, Харцызск, Харьков, Херсон, Хмельник, Хмельницкий, Хорол, Хотин, Христиновка, Хуст, Хыров, Цюрупинск, Червоноград, Червонозаводское, Червонопартизанск, Черкассы, Чернигов, Чернобыль, Черновцы, Чигирин, Чоп, Чортков, Чугуев, Шаргород, Шахтёрск, Шепетовка, Шостка, Шпола, Шумск, Щёлкино, Щорс, Энергодар, Южное, Южноукраинск, Яворов, Яготин, Ялта, Ямполь, Яремче, Ясиноватая
Отофаг при аденоидах.
 Другие мази при аденоидите
Другие мази при аденоидитеОтофаг относится к группе ЛОР-препаратов, которые оказывают селективное действие, убивая определенный вид бактерии. В составе лекарственного средства присутствуют большое количество бактериофагов, перемешанных в физиотерапевтическом растворе. Врачом назначение Отофага производится при аденоидах. Это одно из наиболее действенных и безопасных лекарств, применение которого сохраняет естественную микрофлору в организме.
Действие препарата
Отофаг при аденоидах назначают маленьким детям, новорожденным и беременным женщинам. Обусловлено это отсутствием отрицательного влияния на ткани организма. Гель Отофаг допускается использовать в качестве гигиены кожных покровов, ушных раковин и ЛОР-органов. Подавление активного роста бактериального воспаления происходит за счет содержания в лекарстве нескольких видов бактериофагов:
- Моракселла
- Протеи
- Кишечная палочка
- Золотистый стафилококк
- Стрептококк
- Клебсиеллы
Каждый из 32 фаг, входящий в состав препарата, отвечает за уничтожение только одного типа бактерий и абсолютно нейтрально действует на другие. При этом они не влияют на работу внутренних органов и на естественную микрофлору. Лекарственное средство легко сочетается с одновременным приемом антибиотиков, также оказывая антибактериальное действие. В комплексном лечении аденоидов быстрее наступает полное выздоровление, снижается тяжесть протекания заболевания и становится возможным избежать в дальнейшем рецидивов.
При этом они не влияют на работу внутренних органов и на естественную микрофлору. Лекарственное средство легко сочетается с одновременным приемом антибиотиков, также оказывая антибактериальное действие. В комплексном лечении аденоидов быстрее наступает полное выздоровление, снижается тяжесть протекания заболевания и становится возможным избежать в дальнейшем рецидивов.
Показания к применению
Продолжительность применения мази Отофаг в целях профилактики несколько короче, чем во время курсового лечения. Производится обработка поверхности ЛОР-органов для защиты от возможной бактериальной инфекции. Делать это следует в случае появления определенных факторов риска:
- Перемена климата
- Наличие аутоиммунных заболеваний
- Снижение защитных функций иммунитета
- Оперативное вмешательство
- Болезни легочной системы, носа и горла
Так от бронхита, от трахеита, от ринита, от ангины, от гайморита, от фарингита, при воспалении миндалин и при тонзиллите назначают Отофаг. Каждое из этих заболеваний может в итоге привести к воспалению уха. Если не заняться их лечением, вполне вероятно развитие серьезных осложнений.
Каждое из этих заболеваний может в итоге привести к воспалению уха. Если не заняться их лечением, вполне вероятно развитие серьезных осложнений.
Как использовать препарат
В инструкции геля Отофаг для взрослых и детей при аденоидах установлена определенная дозировка и продолжительность курса применения. Но лучше всего получить консультацию у специалиста с целью назначения индивидуального приема. Лекарство назначается как при воспалительном поражении аденоидов, так и в постоперационный период при их удалении. Максимального эффекта от терапии возможно достичь при комплексном подходе к назначению терапевтического курса. Ускорить процесс выздоровления также поможет курс:
- Антибиотиков
- Антигистаминных препаратов
- Сосудосуживающих средств
Во время эпидемиологических всплесков инфекций бактериальной этиологии детский терапевт Комаровский советует гель Отофаг при аденоидах у детей. Инструкцией для профилактики в данном случае предусмотрен рекомендуемый курс применения продолжительностью 20-30 дней с ежедневным нанесением 2-3 раза.
Область, на которую нанесен гель, нельзя мочить в течении 40 минут. Попадание лекарства на слизистые оболочки не несет вреда здоровью, состав можно и проглатывать. На начальном этапе развития заболевания препарат наносят через 2 часа. Когда предстоит операция на аденоидах или уже после ее проведения курсовое лечение займет 7 дней по 2-3 раза нанесения в сутки.
Побочные эффекты и противопоказания
Во время лечения или профилактического курса применение лекарства не вызывает побочных реакций и достаточно легко переносится как взрослыми, так и детьми. Возможно проявление незначительной аллергии, при выявлении которой необходимо завершать курс и консультироваться у специалиста.
Регулярное «поедание» препарата может спровоцировать появление в области живота болей, а также стать причиной расстройства стула. Тогда рекомендуется делать промывание или искусственно вызывать рвоту. Нельзя применять лекарство при индивидуальной непереносимости состава. Запрещается мазать гелем закрытые участки воспаления, так как повышается вероятность их обострения. При невозможности использования данного препарата, врачом должен быть назначен его достойный аналог.
Использование прочих мазей
Полных аналогов Отофаг не имеет. В нем объединены 32 бактериофага. Еще большего количества компонентов нет ни в одном лекарственном средстве. Немного схожим фармакологическим действием обладает оксолиновая мазь. При аденоидах она довольно часто используется, но как профилактическое средство. Другими аналогами являются:
При аденоидах также допускается использовать такой препарат, как мазь Флеминга. Назначение аналогов активно производится в комплексном подходе к терапии, а также для предупреждения инфицирования человеческого организма вследствие влияния на организм различных патогенных бактерий.
Мазь флеминга при аденоидах
При аденоидах применяется мазь Флеминга. Она относится к группе гомеопатов. Ее нанесение на пораженные участки улучшает кровоснабжение воспаленных тканей и повышает защитные функции иммунитета. Мазь наносится непосредственно на слизистые носа курсовым лечением не более 5 недель. Ежедневно состав наносится на пораженный участок не меньше двух раз.
Ежедневно состав наносится на пораженный участок не меньше двух раз.
Оксолиновая мазь при разрастании тканей
При аденоидах Оксолиновая мазь может стать заменителем Отофага не иначе, как в профилактических целях. Она в небольших объемах распределяется по слизистым носа 2 раза в день. Данный препарат не оказывает положительного воздействия при стремительном воспалительном поражении. Мазь эффективнее всего зарекомендовала себя в качестве защиты от заражения гриппом, ОРВИ и аналогичными инфекционными заболеваниями. Лучше всего наносить ее на слизистые перед сном, иначе на будет вытекать из носа.
Перед нанесением состава носовую полость следует хорошенько прочистить. Мази наносятся равномерным и небольшим слоем, в противном случае больной рискует заработать еще приступы чихания и раздражение оболочек.
Отофаг (Otofag): описание, рецепт, инструкция
Otofag
Аналоги (дженерики, синонимы)
Других названий нет
Действующее вещество
Стерильная суспензия фаговых частиц в физиологическом растворе (Sterilis suspensionis de phage particulis in sal solutio)
Фармакологическая группа
Вакцины, сыворотки, фаги и анатоксины
Рецепт
Международный:
Rp.: Gel. «Otofag» 50 ml D. S. наносить на обрабатываемый участок непосредственно из флакона или салфеткой (ватным тампоном).
Россия:
Отпускается без рецепта
Фармакологическое действие
Гель с бактериофагами для гигиены кожи ушных раковин применяют с целью нормализации микрофлоры и профилактики бактериальных воспалительных заболеваний уха, в том числе, при заболеваниях других ЛОР-органов.
Отофаг содержит комплекс из 32 видов бактериофагов, подавляющих рост следующих патогенных бактерий:
Bacteroides spp.
Escherichia coli spp.
Haemophilus influenzae spp.
Klebsiella spp.
Moraxella catarrhalis
Morganella morganii
Neisseria spp.
Proteus vulgaris spp.
Providencia rettgeri spp.
Pseudomonas aeruginosa spp.
Staphylococcus aureus spp.
Streptococcus pyogenes spp.
Практика применения бактериофагов
Бактериофаги (с др.-гр. – «пожиратели бактерий») – вирусы, избирательно поражающие бактерии: каждый вид бактериофагов активен только в отношении определённого вида бактерий и нейтрален в отношении других видов. В клинической практике используются бактериофаги, которые уничтожают патогенные бактерии, не нарушая нормофлору человека и не взаимодействуя с его органами и системами. Это позволяет применять их у всех категорий пациентов (включая новорожденных, беременных и кормящих матерей) как эффективное и безопасное антибактериальное средство профилактики и терапии, в т. ч. в комбинации с антибиотиками. («Рациональное применение бактериофагов в лечебной и противоэпидемической практике. Федеральные клинические (методические) рекомендации». М., 2014).
ч. в комбинации с антибиотиками. («Рациональное применение бактериофагов в лечебной и противоэпидемической практике. Федеральные клинические (методические) рекомендации». М., 2014).
Особенную актуальность имеет профилактический приём бактериофагов в тех случаях, когда клинические признаки бактериального инфицирования отсутствуют, а применение антибиотиков нежелательно из-за их побочных эффектов. Например, профилактика бактериофагами бактериальных осложнений вирусных и грибковых инфекций, травм, ожогов, хирургических вмешательств, а также профилактика собственно бактериальных инфекций при наличии различных факторов риска (сопутствующие заболевания, отдельные состояния, опасная эпидемиологическая ситуация и другие неблагоприятные факторы внешней среды).
В результате применения бактериофагов уничтожаются патогенные бактерии, поддерживается нормальный баланс микрофлоры, ослабляется негативное воздействие на организм инфекционного воспаления. Комплексное защитное действие бактериофагов помогает организму справиться с инфекцией и её последствиями, а регулярное профилактическое использование бактериофагов предотвращает новые случаи инфекционного воспаления или значительно снижает тяжесть его течения.
Способ применения
Для взрослых:
Местно. В домашних условиях Отофаг наносить на обрабатываемый участок непосредственно из флакона или салфеткой (ватным тампоном). Обработанный участок не мочить (гель не смывать) в течение 40 мин после применения Отофага.
В условиях приема специалистом пораженные или травмированные участки уха и других лор-органов обрабатываются Отофагом.
Отофаг безопасен при попадании на слизистую и проглатывании.
Не вносить Отофаг в закрытые очаги воспаления, не имеющие или имеющие ограниченный отток экссудата из очага (например ушитые раны). Внесение Отофага в такие очаги может привести к выраженному обострению воспалительного процесса и/или отекам и/или лимфостазу.
Схемы применения
Гигиена ушных раковин у здоровых людей, в т.ч. в период неблагоприятной эпидемиологической обстановки, при смене климатических поясов, вредных воздействиях внешней среды и других рисках заражения бактериальными инфекциями:1 мл Отофага (одно нажатие) наносят 2–3 раза в день после гигиенических мероприятий. Длительность профилактического курса — от 7 до 14 дней. Курс рекомендуется повторять каждый месяц. Длительность применения Отофага в профилактических целях не ограничена.
Длительность профилактического курса — от 7 до 14 дней. Курс рекомендуется повторять каждый месяц. Длительность применения Отофага в профилактических целях не ограничена.
Профилактика бактериальных воспалительных заболеваний уха при наличии факторов риска, в т.ч. сахарного диабета, онкологических заболеваний (особенно в период проведения лучевой и химиотерапии), сниженного местного и общего иммунитета, грибковых и вирусных инфекциях лор-органов, аутоиммунных и других системных заболеваниях: 1 мл Отофага (одно нажатие) 2–3 раза в день после гигиенических мероприятий. Длительность курса соответствует длительности действия фактора риска. При прекращении действия фактора риска рекомендуется схема применения для здоровых людей.
Профилактика бактериальных воспалительных заболеваний уха (наружный и средний отит) и их рецидивов, носа (гайморит, ринит), горла (фарингит, абсцессы, ангина, хронический тонзиллит) и других респираторных заболеваниях (бронхит, эпиглоттит, грипп, ОРВИ): доза Отофага определяется врачом, исходя из конкретной клинической ситуации. Рекомендуется сочетать с применением в домашних условиях — 1 мл Отофага (одно нажатие) 3–4 раза в день после гигиенических мероприятий. Длительность курса домашних процедур — 3–4 нед. Частота повторения курсов — по рекомендации врача. Далее рекомендуется схема применения для здоровых людей.
Рекомендуется сочетать с применением в домашних условиях — 1 мл Отофага (одно нажатие) 3–4 раза в день после гигиенических мероприятий. Длительность курса домашних процедур — 3–4 нед. Частота повторения курсов — по рекомендации врача. Далее рекомендуется схема применения для здоровых людей.
Профилактика бактериальных осложнений при хирургических вмешательствах и других лечебных манипуляциях в области уха и других лор-органов: доза Отофага определяется врачом, исходя из конкретной клинической ситуации. Перед хирургическим вмешательством — 2–3 раза в день после гигиенических мероприятий в течение 7 дней до начала вмешательства. После хирургического вмешательства — 2–3 раза в день после гигиенических мероприятий в течение 7 дней. Далее рекомендуется схема применения для здоровых людей.
По назначению врача в других клинических ситуациях, при которых важно обеспечить высокую антибактериальную защиту и отсутствие побочных эффектов: врач определяет схему применения, кратность и объем использования Отофага, исходя из конкретной клинической ситуации.
На начальном этапе при наличии воспалительного очага рекомендуется более частое применение Отофага с интервалом 1–2 ч.
Показания
– Гигиена ушных раковин у здоровых людей, в том числе, в период неблагоприятной эпидемиологической обстановки, при смене климатических поясов, при вредных воздействиях внешней среды и других рисках заражения бактериальными инфекциями.
– Профилактика бактериальных воспалительных заболеваний уха при наличии факторов риска, в том числе, сахарного диабета, онкологических заболеваний (особенно в период проведения лучевой и химиотерапии), сниженного местного и общего иммунитета, грибковых и вирусных инфекциях ЛОР-органов, аутоиммунных и других системных заболеваниях.
– Профилактика бактериальных воспалительных заболеваний уха (наружный и средний отит) и их рецидивов, в том числе, при заболеваниях носа (гайморит, ринит), горла (фарингит, абсцессы, ангина, хронический тонзиллит) и других респираторных заболеваниях (бронхит, эпиглоттит, грипп, ОРВИ).
– Профилактика бактериальных осложнений при хирургических вмешательствах и других лечебных манипуляциях в области уха и других ЛОР-органов.
– По назначению врача в других клинических ситуациях, при которых важно обеспечить высокую антибактериальную защиту и отсутствие побочных эффектов.
Противопоказания
– Повышенная чувствительность к компонентам Отофага
Побочные действия
– аллергическая реакция
Форма выпуска
Гель для местного применения. Гель для местного применения.Во флаконе 50 мл с дозатором и защитным колпачком.
1 фл.
активное вещество:
стерильная суспензия фаговых частиц в физиологическом растворе
вспомогательные вещества:вода очищенная; карбопол; экстракт календулы
Отофаг гель с бактериофагами 50мл.
Аптеки города:
Москва, Автозаводская ул. , 13/1
, 13/1 пн-пт 8:00-23:00, сб-вс 9:00-22:00
+7 (495)419-24-50
В наличии, 928 ₽ Москва, Самора Машела ул, 2А
пн-пт 9:00-22:00, сб-вс 9:00-21:00
+7 495 419-12-51
В наличии, 950 ₽
Видное, Лемешко ул, 10
пн-вс 9:00-21:00
+7 495 419-19-57
Видное, Строительная ул, д. 3, пом. 19-25
пн-вс 8:00-20:00
8 (495) 419-24-84
г. Домодедово аэропорт, 2 этаж
пн-вс круглосуточно
8-495-419-12-81
Голиково, Усковский пр-д, 2
пн-вс 9:00-22:00
+7 495 419-15-65
Жуковский, Клубная ул, 4/8
пн-вс 9:00-21:00
+7 495 221-53-88
Москва, Живописная ул, 12
пн-пт 8:00-22:00, сб 8:00-21:00, вс 9:00-21:00
+7 495 419-06-22
Москва, Нижняя Красносельская ул, д 35, с 49
пн-пт 9:00-22:00, сб-вс 10:00-22:00
+7 495 419 13 48
Ногинск, 1-ая Ильича ул, строение 6/29
пн-вс 9:00-22:00
+7 495 221-53-85
Ногинск, Дмитрия Михайлова ул, 1
пн-вс 9:00-22:00
+7 495 419-06-21
Подольск, Академика Доллежаля ул, 3с2
пн-вс 9:00-21:00
+7 495-419-12-85
Химки, Ленинский пр, 1к1
пн-вс 8:00-21:00
+7 495 419 12 97
Щелково, Богородский мкр, 3
пн-вс 9:00-21:00
+7 495 419-12-54
Состав
Активное вещество: стерильная суспензия фаговых частиц в физиологическом растворе,
Вспомогательные вещества: вода очищенная, карбопол, экстракт календулы.
Описание
Гель с бактериофагами для гигиены кожи ушных раковин
Действие
Гель с бактериофагами для гигиены кожи ушных раковин «Отофаг» (далее – Отофаг) применяют с целью нормализации микрофлоры и профилактики бактериальных воспалительных заболеваний уха, в том числе, при заболеваниях других ЛОР-органов. Отофаг содержит комплекс из 32 видов бактериофагов коллекции ООО НПЦ «МикроМир», подавляющих рост следующих патогенных бактерий: Bacteroides spp. Escherichia coli spp. Haemophilus influenzae spp. Klebsiella spp. Moraxella catarrhalis Morganella morganii Neisseria spp. Proteus vulgaris spp. Providencia rettgeri spp. Pseudomonas aeruginosa spp. Staphylococcus aureus spp. Streptococcus pyogenes spp. Практика применения бактериофагов Бактериофаги (с др.-гр. – «пожиратели бактерий») – вирусы, избирательно поражающие бактерии: каждый вид бактериофагов активен только в отношении определённого вида бактерий и нейтрален в отношении других видов. В клинической практике используются бактериофаги, которые уничтожают патогенные бактерии, не нарушая нормофлору человека и не взаимодействуя с его органами и системами. Это позволяет применять их у всех категорий пациентов (включая новорожденных, беременных и кормящих матерей) как эффективное и безопасное антибактериальное средство профилактики и терапии, в т. ч. в комбинации с антибиотиками. («Рациональное применение бактериофагов в лечебной и противоэпидемической практике. Федеральные клинические (методические) рекомендации». М., 2014). Особенную актуальность имеет профилактический приём бактериофагов в тех случаях, когда клинические признаки бактериального инфицирования отсутствуют, а применение антибиотиков нежелательно из-за их побочных эффектов. Например, профилактика бактериофагами бактериальных осложнений вирусных и грибковых инфекций, травм, ожогов, хирургических вмешательств, а также профилактика собственно бактериальных инфекций при наличии различных факторов риска (сопутствующие заболевания, отдельные состояния, опасная эпидемиологическая ситуация и другие неблагоприятные факторы внешней среды). В результате применения бактериофагов уничтожаются патогенные бактерии, поддерживается нормальный баланс микрофлоры, ослабляется негативное воздействие на организм инфекционного воспаления.
 Комплексное защитное действие бактериофагов помогает организму справиться с инфекцией и её последствиями, а регулярное профилактическое использование бактериофагов предотвращает новые случаи инфекционного воспаления или значительно снижает тяжесть его течения.
Комплексное защитное действие бактериофагов помогает организму справиться с инфекцией и её последствиями, а регулярное профилактическое использование бактериофагов предотвращает новые случаи инфекционного воспаления или значительно снижает тяжесть его течения.
Фармакокинетика
Гель с бактериофагами для гигиены кожи ушных раковин Отофаг (далее – Отофаг) применяют с целью нормализации микрофлоры и профилактики бактериальных воспалительных заболеваний уха, в том числе, при заболеваниях других ЛОР-органов.
Отофаг содержит комплекс из 32 видов бактериофагов коллекции ООО НПЦ МикроМир, подавляющих рост следующих патогенных бактерий:
- Bacteroides spp.
- Escherichia coli spp.
- Haemophilus influenzae spp.
- Klebsiella spp.
- Moraxella catarrhalis
- Morganella morganii
- Neisseria spp.
- Proteus vulgaris spp.
- Providencia rettgeri spp.
- Pseudomonas aeruginosa spp.
- Staphylococcus aureus spp.

- Streptococcus pyogenes spp.
Практика применения бактериофагов
Бактериофаги (с др.-гр. – пожиратели бактерий) – вирусы, избирательно поражающие бактерии: каждый вид бактериофагов активен только в отношении определённого вида бактерий и нейтрален в отношении других видов. В клинической практике используются бактериофаги, которые уничтожают патогенные бактерии, не нарушая нормофлору человека и не взаимодействуя с его органами и системами. Это позволяет применять их у всех категорий пациентов (включая новорожденных, беременных и кормящих матерей) как эффективное и безопасное антибактериальное средство профилактики и терапии, в т. ч. в комбинации с антибиотиками. (Рациональное применение бактериофагов в лечебной и противоэпидемической практике. Федеральные клинические (методические) рекомендации. М., 2014).
Особенную актуальность имеет профилактический приём бактериофагов в тех случаях, когда клинические признаки бактериального инфицирования отсутствуют, а применение антибиотиков нежелательно из-за их побочных эффектов. Например, профилактика бактериофагами бактериальных осложнений вирусных и грибковых инфекций, травм, ожогов, хирургических вмешательств, а также профилактика собственно бактериальных инфекций при наличии различных факторов риска (сопутствующие заболевания, отдельные состояния, опасная эпидемиологическая ситуация и другие неблагоприятные факторы внешней среды).
Например, профилактика бактериофагами бактериальных осложнений вирусных и грибковых инфекций, травм, ожогов, хирургических вмешательств, а также профилактика собственно бактериальных инфекций при наличии различных факторов риска (сопутствующие заболевания, отдельные состояния, опасная эпидемиологическая ситуация и другие неблагоприятные факторы внешней среды).
В результате применения бактериофагов уничтожаются патогенные бактерии, поддерживается нормальный баланс микрофлоры, ослабляется негативное воздействие на организм инфекционного воспаления. Комплексное защитное действие бактериофагов помогает организму справиться с инфекцией и её последствиями, а регулярное профилактическое использование бактериофагов предотвращает новые случаи инфекционного воспаления или значительно снижает тяжесть его течения.
Показания к применению
- Гигиена ушных раковин у здоровых людей, в том числе, в период неблагоприятной эпидемиологической обстановки, при смене климатических поясов, при вредных воздействиях внешней среды и других рисках заражения бактериальными инфекциями.
- Профилактика бактериальных воспалительных заболеваний уха при наличии факторов риска, в том числе, сахарного диабета, онкологических заболеваний (особенно в период проведения лучевой и химиотерапии), сниженного местного и общего иммунитета, грибковых и вирусных инфекциях ЛОР-органов, аутоиммунных и других системных заболеваниях.
- Профилактика бактериальных воспалительных заболеваний уха (наружный и средний отит) и их рецидивов, в том числе, при заболеваниях носа (гайморит, ринит), горла (фарингит, абсцессы, ангина, хронический тонзиллит) и других респираторных заболеваниях (бронхит, эпиглоттит, грипп, ОРВИ).
- Профилактика бактериальных осложнений при хирургических вмешательствах и других лечебных манипуляциях в области уха и других ЛОР-органов.
- По назначению врача в других клинических ситуациях, при которых важно обеспечить высокую антибактериальную защиту и отсутствие побочных эффектов.
Противопоказания
Повышенная чувствительность к компонентам Отофага.
Взаимодействие
- антибактериальные средства: Отофаг можно применять одновременно с антибактериальными средствами.
- антисептические средства:
Отофаг можно применять одновременно с растворами хлоргексидина биглюконата 0,05% и 0,2%, гидроксиметилхиноксалиндиоксида 2,0%,
из-за инактивации бактериофагов, входящих в состав Отофага, не рекомендуется одновременное использование с Отофагом следующих средств:
– средств на основе октенидина и феноксиэтанола,
– средств на основе солей полиакриловой кислоты,
– растворов перекиси водорода.
Способ применения и дозы
- В домашних условиях Отофаг наносят на обрабатываемый участок непосредственно из флакона или салфеткой (ватным тампоном). Обработанный участок не мочить (гель не смывать) в течение 40 минут после применения Отофага.
- В условиях приёма специалиста Отофагом обрабатываются поражённые или травмированные участки уха и других ЛОР-органов.

ВАЖНО! Отофаг безопасен при попадании на слизистую и при проглатывании. Не вносить Отофаг в закрытые очаги воспаления, не имеющие или имеющие ограниченный отток экссудата из очага (например, ушитые раны и т. п.). Внесение Отофага в такие очаги может привести к выраженному обострению воспалительного процесса и/или отёкам и/или лимфостазу.
Схемы применения и дозы
- гигиена ушных раковин у здоровых людей, в том числе, в период неблагоприятной эпидемиологической обстановки, при смене климатических поясов, при вредных воздействиях внешней среды и других рисках заражения бактериальными инфекциями:1 мл Отофага (одно нажатие) наносят 2-3 раза в день после гигиенических мероприятий.Длительность профилактического курса – от 7 до 14 дней. Курс рекомендуется повторять каждый месяц.Длительность применения Отофага в профилактических целях не ограничена.
- профилактика бактериальных воспалительных заболеваний уха при наличии факторов риска, в том числе, сахарного диабета, онкологических заболеваний(особенно в период проведения лучевой и химиотерапии), сниженного местного и общего иммунитета, грибковых и вирусных инфекциях ЛОР-органов, аутоиммунных и других системных заболеваниях:1 мл Отофага (одно нажатие) 2-3 раза в день после гигиенических мероприятий.
 Длительность курса соответствует длительности действия фактора риска.При прекращении действия фактора риска рекомендуется схема применения для здоровых людей.
Длительность курса соответствует длительности действия фактора риска.При прекращении действия фактора риска рекомендуется схема применения для здоровых людей. - профилактика бактериальных воспалительных заболеваний уха (наружный и средний отит) и их рецидивов, в том числе, при заболеваниях носа (гайморит, ринит), горла (фарингит, абсцессы, ангина, хронический тонзиллит) и других респираторных заболеваниях (бронхит, эпиглоттит, грипп, ОРВИ):доза Отофага определяется врачом исходя из конкретной клинической ситуации.Рекомендуется сочетать с применением в домашних условиях: 1 мл Отофага (одно нажатие) 3-4 раза в день после гигиенических мероприятий.Длительность курса домашних процедур – 3-4 недели. Частота повторения курсов -по рекомендации врача.Далее рекомендуется схема применения для здоровых людей.
- профилактика бактериальных осложнений при хирургических вмешательствах и других лечебных манипуляциях в области уха и других ЛОР-органов:доза Отофага определяется врачом исходя из конкретной клинической ситуации.
 Перед хирургическим вмешательством – 2-3 раза в день после гигиенических мероприятий в течение 7 дней до начала вмешательства.После хирургического вмешательства – 2-3 раза в день после гигиенических мероприятий в течение 7 дней.Далее рекомендуется схема применения для здоровых людей.
Перед хирургическим вмешательством – 2-3 раза в день после гигиенических мероприятий в течение 7 дней до начала вмешательства.После хирургического вмешательства – 2-3 раза в день после гигиенических мероприятий в течение 7 дней.Далее рекомендуется схема применения для здоровых людей. - по назначению врача в других клинических ситуациях, при которых важно обеспечить высокую антибактериальную защиту и отсутствие побочных эффектов:врач определяет схему применения, кратность и объём использования Отофага исходя из конкретной клинической ситуации.
ВАЖНО! На начальном этапе при наличии воспалительного очага рекомендуется более частое применение Отофага с интервалом 1-2 часа.
Особые указания
Предохранять дозатор от попадания грязи и инородных веществ. Очищать носик дозатора и колпачок от остатков геля. После использования следует всегда закрывать дозатор колпачком.
Форма выпуска
Гель во флаконе 50 мл с дозатором и защитным колпачком
Условия отпуска из аптек
Отпускается без рецепта
Условия хранения
В сухом, защищённом от света месте при температуре от 2С до 8С в течении 24 месяцев. После начала использования допускается хранение Отофага при комнатной температуре (не более 25С) при условиях соблюдения стерильности и использования
После начала использования допускается хранение Отофага при комнатной температуре (не более 25С) при условиях соблюдения стерильности и использования
Срок годности
2 года.
Производитель и организация, принимающие претензии потребителей
ООО «НВЦ Агроветзащита С.-П.», Россия, 141315, Московская обл., г. Сергиев Посад, ул. Центральная, д. 1 по заказу ООО НПЦ «МикроМир», Россия, 107031, г. Москва, пер. Нижний Кисельный, д. 5/23, стр. 1.
Лор-заболевания | Елена Корнилова
Лор-заболевания — одни из самых распространенных у детей и взрослых. Как забыть о рецидивирующих синуситах, гайморитах, отитах, тонзиллитах, ринитах и «победить» аденоиды — разбираемся в статье.
Заболевания лор-органов могут быть острыми и хроническими. В первом случае признаки инфекции исчезают в течение 7−10 дней. При хроническом течении возбудители сохраняются в слизистых дольше, вызывая периодические обострения, а также способствуя развитию других заболеваний.
Лор-хроника может быть источником бактериальных урогенитальных инфекций, а также привести к изменению функции щитовидной железы. В силу того, что лор-органы и щитовидная железа находятся в одном лимфатическом бассейне, при гипотиреозе / тиреоидите крайне важно исключить хронические лор-инфекции.
С чего начать лечение хронических заболеваний лор-органов
При частых синуситах, отитах и т. п. крайне важно озадачиться состоянием зубов. В идеале стоит сделать КТ зубов — так можно исключить скрытый кариес, кисты, гранулемы и т. д, дающие очаг хронической инфекции.
Также стоит следить за состоянием миндалин. При хроническом тонзиллите, в том числе для профилактики обострений заболевания, рекомендуется курс промываний лакун нёбных миндалин.
Учитывая отрицательное воздействие нарушений микрофлоры кишечника на состояние лор-органов, при частых лор-инфекциях показана элиминационная диета (подробнее в этой статье). Исключите глютен, молочные белок, яйца, сахара хотя бы на месяц и посмотрите на реакцию организма.
Последнее время постоянно текло из носа, особенно во время еды. Занялась как раз микробиомом, исключила очень много продуктов (больше, чем в элиминационном списке). Через две недели такого питания всё прошло!
@rodionova_horeca
Третья неделя диеты, и той мокроты, которая мучила меня последние лет 15 — нет! Раньше я думала, диета без глютена и молочки — это пустые слова. Спасибо за то, что несете в мир полезную информацию!
@aibaik
У дочки гайморит, ей сейчас 16, а когда было 7 лет, попали в лор-отделение с гайморитом и одним проколом. Года четыре назад я исключила молоко из рациона. Сейчас сопли если и бывают, то на погоду, и за неделю проходит насморк. Раньше же без кукушки мы не обходились. Сейчас из молочной продукции только сыр, не часто, сливочное масло. Иногда — творог и сметана, но очень редко. Это работает!
@annushka61
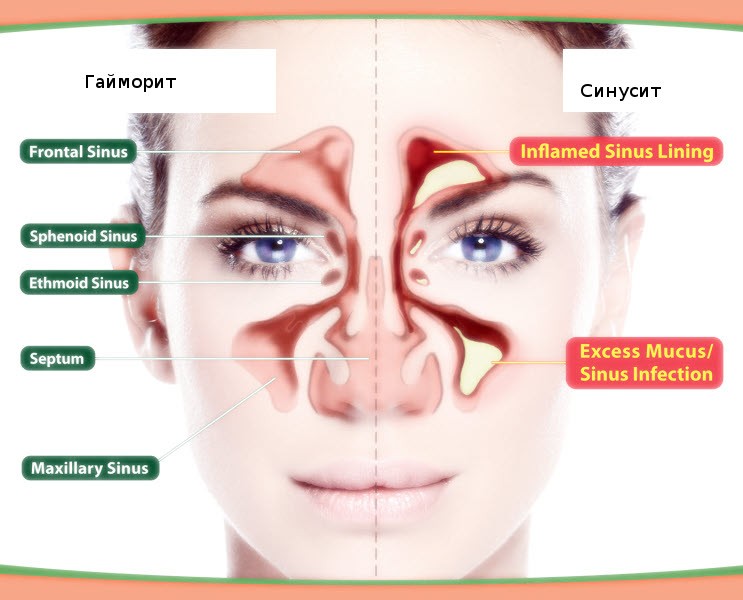
Лечение гайморита
Гаймориты (практически все виды синуситов) зачастую имеют бактериальное происхождение — отделяемое из носа имеет желтый и зеленый цвет. При аллергическом и вирусном отделяемое прозрачного цвета. Также природу заболевания может прояснить общий анализ крови.
При аллергическом и вирусном отделяемое прозрачного цвета. Также природу заболевания может прояснить общий анализ крови.
Прекрасная рабочая группа из аптеки, работает при бактериальном гайморите:
Шаг 1. Если слизистая отекла, использовать сосудосуживающие капли перед манипуляцией (но не более 5 дней).
Шаг 2. Промывание носа на вдохе солевым раствором (половина столовой ложки на 100 мл воды с каплей йода), можно добавить туда 30 капель Ротокана, промывать можно шприцом или специальными устройствами.
Шаг 3. Бактериофаг Секстафаг для промывания носа, полоскания горла, приёма внутрь.
Шаг 4. Бактериостатик Стрептоцид в порошке, вдыхать носиком, можно через купюру для пущего антуража:)
Шаг 5. Синупрет в каплях — приём внутрь, в момент обострения дозу можно повышать.
Шаг 6. Найдите капли Цикламена, отлично работают при всех видах синуситов, использовать можно длительно.
Шаг 7. Лимфомиозот 15−20 капель.
Выполнять последовательно, 2−3 раза в день, после снятия обострения 1−2 раза в день.
Травяной чай: 1 ст.л. тысячелистника, 1 ст. л. листьев эвкалипта, 1 ст.л. корня аира, 1 ст. л. цветков календулы, 1 ст. л. почек берёзы заварить литром кипятка, дать настояться час, пить тёплым по 150−200 мл 3−4 раза в день, 1−3 месяца.
Можно также использовать GSE и коллоидное серебро.
Другие рабочие средства при хронических проблемах:
- при полипозном синусите можно попробовать сок чистотела, местно.
- при сухости слизистой носа отлично подходит масло облепихи — по 2−3 капли в носовой проход.
- при бактериальных отитах, синуситах, аденоидах, тонзиллитах и т. д. отлично работает гель с бактериофагами Отофаг. И прекратите лазить в уши ватными палочками, вы можете собирать серу только снаружи, не нужно лезть в проход — это большие риски травматизации и хроники в дальнейшем!
- при частых лор-инфекциях также желателен пробиотик для ротовой полости PRO-Dental от Hyperbiotics.

- барокамера также желательна для хроников, курсом 10−15 процедур (барокамера много чем полезна, но прежде всего она устраняет гипоксию мозга, которая возникает при нарушениях дыхания).
Эффективные Средства при проблемах с горлом
Проблемы с горлом, вроде хронического тонзиллита, фарингита — это в 90% стрептококк группы А, в большинстве случаев ангины он также главный виновник. Можно подключить:
- Отофаг (местно)
- Секстафаг (внутрь) / можно заменить стрептококковым бактериофагом,
- Коллоидное серебро курсом (внутрь и местно),
- Экстракт грейпфрутовых косточек (внутрь и местно),
- Стрептоцид (местно),
- Лизобакт курсом
- полоскания с йодом и солью,
- Тонзилгон H,
- полоскание отваром корня окопника
- полоскания кокосовым маслом с 3−4 каплями эфирного масла чайного дерева и масла орегано,
- полоскания оливковым маслом с добавлением спиртовой настойки прополиса.
Хроникам обязательная элиминационная диета, санация ротовой полости, промывание миндалин, поход к стоматологу и оральные пробиотики.
Фитотерапия: череды трава 2 ст. л., шалфей 1 ст. л., чабрец 1 ст. л., эвкалипт 1 ст. л., подорожник 1 ст. л., ромашка 1 ст. л., таволга 1 ст. л., мята 1 ст.л. Заварить 1 л кипятка, настаивать 30 минут, пить теплым по 200 мл 4−5 раз в день, 1−3 месяца.
Лечение аденоидов
Проблему с аденоидами однозначно надо решать. Детям крайне важно для развития челюстей носовое дыхание. Но удаление аденоидов не дает гарантий, что в будущем они вновь не разрастутся.
В лечении аденоидов эффективны:
- Лимфомиозот курсами 20−30 капель (внутрь) 2−3 раза в день.
- Компрессы с касторовым маслом на область живота (как правильно их делать, читайте здесь),
- Коллоидное серебро курсом и местно.
- Gse внутрь курсом и местно.
- Чай из Pau de arco (высыпать содержимое 3−4 капсул в чашку, дать настояться), 2−3 чашки в день.
- Полоскания 1 ч.л. соли и 25 капель настойки прополиса.
- Отофаг
- Оральные пробиотики.
Обязательна строгая элиминационная диета на 2 месяца!
Фитотерапия: полынь 1 ч. л., хвощ 2 ч.л., календула 2 ч.л. шалфей 2 ч.л., подорожник 2 ч.л., крапива 1 ч.л. Заварить 0,5 л кипятка, настоять 30 минут, пить тёплым по ¼ стакана 4−5 раз в день.
легкий способ вылечить тяжелое заболевание :: Жизнь
Современная фармакология стремится свести к минимуму побочные действия, которые могут возникнуть при употреблении лекарств, и нацелена на адресную доставку препаратов к органам, нуждающимся в лечении
Современная фармакология стремится свести к минимуму побочные действия, которые могут возникнуть при употреблении лекарств, и нацелена на адресную доставку препаратов к органам, нуждающимся в лечении. Это очень важно, особенно при употреблении тех препаратов, которые имеют противопоказания и к которым может возникать устойчивость.Сейчас врачи всего мира обеспокоены тем, что бактерии научились сопротивляться антибиотикам. Например, традиционный путь, когда пациент принимает антибиотик в таблетках, вызывает много побочных эффектов, например, дисбактериоз, не говоря уже о токсичности многих антибактериальных препаратов. Та же часть лекарства, которая попала в кровь, всосавшись в желудочно-кишечный тракт, или после инъекции, затем обязательно проходит через печень. Печень способна нейтрализовать часть антибиотика и снизить его эффективность, когда он попадет в нужный орган. При этом “закаленные” безопасными для них дозами антибиотиков патогенные бактерии быстро становятся устойчивыми к антибиотикам. Тогда приходится увеличивать дозы антибиотиков, а заболевания все чаще переходят в хроническую форму.
Это происходит, в частности, при лечении гайморита. В гайморовых пазухах скапливается экссудат (мокрота), появляется воспаление и отек, сосуды сужаются, не давая слизи с бактериями выйти из пазухи. При этом системные антибиотики начинают действовать не сразу, нужно время, чтобы таблетка всосалась и достигла пазухи через кровоток.
Казалось бы, на помощь должна приходить пункция (прокол) гайморовой пазухи. Она позволяет не только удалить из верхнечелюстных пазух носа лишнее содержимое, но и ввести туда различные препараты, в частности, антибиотики. Но эта процедура болезненная и относительно сложная, и может приводить к осложнениям или занесению инфекции извне. Кроме того, часто такие пациенты нуждаются в стационарном лечении. Пункцию следует применять, когда гайморит перешел в тяжелую стадию и без хирургического вмешательства уже не обойтись.
На сегодняшний день наиболее современным методом лечения не только гайморита, но и многих других болезней легких и ЛОР-органов является небулайзерная (ингаляционная) терапия, позволяющая мельчайшим частицам лекарства попасть именно в место воспаления и уничтожить там бактерии, практически не проникая в кровь. Уточним, что под термином “небулайзеры” – от латинского слова nebula-туман, облако – объединены устройства, которые генерируют аэрозольное облако, состоящее из микрочастиц ингалируемого раствора препарата.
Основной целью небулайзерной терапии является быстрая доставка терапевтических доз препарата в аэрозольной форме за минимальный период времени, обычно за 5-10 минут. К ее преимуществам относятся высокая безопасность лечения, даже у самых маленьких пациентов, возможность доставки более высокой дозы препарата и обеспечение проникновения лекарств в труднодоступные ЛОР-органы и плохо вентилируемые участки бронхов, куда не могут проникнуть системные антибиотики.
Фармацевтические компании сегодня выпускают для небулайзерной терапии специализированные комплексные соединения в форме порошка для приготовления раствора для ингаляций, объединяющее в своем составе сразу 2 компонента: антибиотик и муколитик.
Муколитиками называют вещества, способствующие разжижению мокроты и ее выводу, что особенно важно в лечении гайморита. В частности, в состав широко используемого в России для борьбы с ЛОР- и легочными заболеваниями препарата Флуимуцил-антибиотик входят молекулы антибиотика тиамфеникола и муколитика ацетилцистеина.
Ацетилцистеин, разрывая связи слизи, быстро разжижает мокроту, гной, снижает их вязкость и способствует быстрому отхождению. А кроме того, Ацетилцистеин снижает способность бактерий укрепиться на слизистой оболочке и облегчает проникновение антибиотика тиамфеникола в слизистую оболочку гайморовых пазух. Тиамфеникол обладает широким спектром антибактериального действия в отношении бактерий, наиболее часто вызывающих инфекции ЛОР- органов и дыхательных путей .
В результате лечения гайморита с помощью небулайзерной терапии, при которой лекарственные средства доставляются прямо в пазухи без пункций, сроки заболевания могут сокращаться на 30% и более, а риск развития побочных негативных эффектов сведен к минимуму. При выборе небулайзера очень важно не экономить и не приобретать устройства сомнительных, как правило, китайских производителей.
На рынке сегодня представлен широкий выбор европейских и российских производителей, качество небулайзера определяется способностью создавать мелкодисперсные взвеси, причем, чем мельче будут частицы лекарства, тем лучше терапевтический эффект. При выборе небулайзера важно обратить внимание на тип небулайзера, наиболее универсальным будет являться компрессорный механизм работы, это важно, т.к. ультразвуковые небулайзеры способны разрушать многие компоненты лекарств. Среди компрессорных небулайзеров лидером в создании мелкодисперсной взвеси считается итальянский Hi neb.
Роль аутофагии в сверхэкспрессии MUC5AC у пациентов с хроническим риносинуситом
Основные моменты
- •
Был изучен механизм индуцированной HNE экспрессии MUC5AC при CRS, а патогенез CRS, вызванный HNE, был дополнительно изучен.
- •
Взяв за точку входа аутофагию, была изучена взаимосвязь между аутофагией и HNE-индуцированным CRS, что обеспечило новую возможную точку входа для иммунотерапии CRS.
- •
Гипотеза о том, что HNE может опосредовать путь аутофагии-JNK-AP-1, ведущий к сверхэкспрессии MUC5AC, впервые предложена при CRS.
Реферат
Предпосылки
Аутофагия – это путь лизосомной деградации, который защищает организм и необходим для выживания и дифференцировки клеток. Муцины (MUC) являются важными компонентами секретируемой слизи, муцин (MUC) 5AC является основным MUC, секретируемым в нормальных дыхательных путях.
Цель
Изучена роль аутофагии в продукции патогенного муцина (MUC) 5AC при хроническом риносинусите (CRS).
Методы
Экспрессия человеческой нейтрофильной эластазы (HNE) и аутофагических белков легкой цепи (LC) 3B-II, ассоциированного с микротрубочками белка 1, N-концевой киназы c-Jun (JNK), c-Jun и MUC5AC была анализировали на слизистой оболочке носовых пазух и в эпителиальных клетках носа человека (HNEC) с помощью иммуногистохимии, твердофазного иммуноферментного анализа (ELISA) и количественной полимеразной цепной реакции в реальном времени (qRT-PCR). Аутофагические вакуоли изучали с помощью просвечивающей электронной микроскопии (ПЭМ).Первичные HNEC лечили HNE, бафиломицином A1 и SP600125. В некоторых экспериментах культивированные первичные HNEC трансфицировали малыми интерферирующими РНК (миРНК) для нацеливания на Beclin-1 (BECN1; BECN1-siRNA), ген 5, связанный с аутофагией (Atg5; Atg5-siRNA) и c-Jun (c-Jun -сиРНК). Культивируемые клетки анализировали с помощью вестерн-блоттинга, qRT-PCR и ELISA.
Результаты
У пациентов с СВК, как с назальными полипами, так и без них, уровни экспрессии HNE, LC3B, JNK, c-Jun и MUC5AC были повышены.Бафиломицин A1 усиливал экспрессию LC3B-II и ингибировал секрецию MUC в обработанных HNE нормальных первичных HNEC. Аутофагосомы наблюдали в обработанных HNE первичных HNEC с помощью ПЭМ. HNE-индуцированная секреция MUC5AC подавлялась в нормальных первичных HNEC с помощью BECN1-миРНК, Atg5-миРНК, c-Jun-миРНК и SP600125.
Выводы
При индуцированном HNE CRS аутофагия увеличивает секрецию MUC5AC, способствуя фосфорилированию JNK и c-Jun.
Ключевые слова
Аутофагия
Хронический риносинусит (CRS)
Человеческие эпителиальные клетки носа (HNECs)
Эластаза нейтрофилов человека (HNE)
MUC5AC
V.
Рекомендуемые статьи
Цитирующие статьи
Аутофагия и LAP в борьбе с грибковыми инфекциями: регулирование и терапия
Фагоциты борются с грибами, используя канонический и неканонический, также называемый LC3-ассоциированный фагоцитоз (LAP), пути аутофагии. Однако результаты аутофагии / LAP в формировании иммунных ответов хозяина, по-видимому, сильно различаются в зависимости от видов грибов и типов клеток. Обеспечивая эффективное очищение от патогенов и / или деградацию медиаторов воспаления, белки аутофагии играют широкую роль в клеточном и иммунном гомеостазе во время грибковых инфекций.В самом деле, дефекты аутофагического аппарата были связаны с аберрантной защитой хозяина и воспалительными состояниями. Таким образом, понимание молекулярных механизмов, лежащих в основе взаимосвязи между различными формами аутофагии, может предложить способ идентифицировать лекарственные молекулярные сигнатуры, различающие избирательное распознавание груза и защиту хозяина. В этом отношении IFN-, γ и анакинра являются обучающими примерами успешных противогрибковых агентов, нацеленных на механизм аутофагии. В этой статье представлен обзор роли аутофагии / LAP в ответ на грибки, а также в их инфекциях, регуляции и терапевтическом использовании.
1. Каноническая и неканоническая аутофагия
Растет понимание сложной роли белков аутофагии в иммунитете и воспалении. Аутофагия играет прямую роль в защите хозяина, способствуя устранению патогенов и косвенно за счет жесткой регуляции сигнальных путей врожденного и адаптивного иммунитета [1–4]. Канонический путь аутофагии (называемый просто «аутофагией») – это физиологический процесс клеточной деградации, посредством которого внутриклеточные материалы подвергаются опосредованному лизосомами саморазложению и рециклингу.Он активируется при определенных стрессовых условиях / ситуациях, таких как голодание, гипоксия или инфекция патогенами, чтобы сохранить клеточный гомеостаз [5]. Процесс аутофагии регулируется большим количеством белков, которые также важны в эндосомных / фагосомных путях, а также специфическими белками, связанными с аутофагией (ATG) [6]. Все больше данных свидетельствует о том, что белки ATG играют широкую роль, выходящую за рамки аутофагии, и включают широкое влияние на многие аспекты здоровья и болезней человека [7, 8].В борьбе с патогенными микроорганизмами механизм аутофагии / перекрестного взаимодействия врожденного иммунитета имеет важное значение для индукции и модуляции воспалительной реакции во время инфекций [6, 9]. Например, аутофагия может смягчить воспаление, устраняя активные инфламмасомы посредством убиквитинирования p62 [10]. Таким образом, дефекты аутофагии могут ухудшать или напрямую способствовать аберрантной защите хозяина, воспалительным заболеваниям и аутоиммунитету [7, 11].
В последнее десятилетие появилась альтернативная форма аутофагии, известная как LC3- (связанный с микротрубочками белок 1A / 1B-легкая цепь 3-) связанный фагоцитоз (LAP) или неканоническая аутофагия.Связь между аутофагическим механизмом и фагоцитозом можно рассматривать как безопасный способ контроля и ускорения лизосомной доставки фагосомы и деградации ее груза (патогенов и захваченных клеток). LAP представляет собой уникальный путь, который задействует передачу сигналов рецептора клеточной поверхности во время фагоцитоза посредством рекрутирования системы конъюгации LC3-фосфатидилэтаноламин (PE), необходимой для слияния лизосом и созревания LAPosome [12]. В отличие от канонической аутофагии, образование двухмембранной аутофагосомы не требует иерархического вмешательства всех белков ATG [13].Rubicon, напротив, является главным регулятором LAP [14]. Рубикон активирует LAP, когда он связан с комплексом фосфатидилинозит (PI) 3-киназы [PI (3) K] класса III, содержащим ген, связанный с устойчивостью к УФ-излучению (UVRAG) на LAPосоме, состоящей из одной мембраны, и ингибирует каноническую аутофагию за счет предотвращение образования комплекса Atg14L [14]. Более того, Rubicon, способствуя локализации фосфатидилинозитол-3-фосфата [PI (3) P] и стабилизации NOX2 NADPH-оксидазного комплекса для производства активных форм кислорода (ROS), способствует уничтожению проглоченных патогенов [14].
В дополнение к микробной защите, LAP недавно стал основным противовоспалительным путем, играющим важную роль в клеточном гомеостазе и физиологии [15]. В частности, LAP предотвращает воспаление во время выведения мертвых клеток и защищает от аутоиммунитета и воспалительных заболеваний кишечника [15]. Таким образом, понимание молекулярных механизмов, лежащих в основе способности LAP модулировать воспалительный ответ во время инфекции, может иметь терапевтическое значение. В этом обзоре мы обсуждаем, как каноническая аутофагия и LAP способствуют защите хозяина от грибов и возможные терапевтические последствия.
2. Каноническая аутофагия и LAP в защите хозяина от грибковых патогенов
Большинство грибковых патогенов человека, таких как Candida spp., Cryptococcus neoformans и Aspergillus fumigatus , не эволюционировали в качестве основных патогенов у здоровых людей, но вместо этого вызывают серьезные опасные для жизни заболевания, когда иммунная компетентность хозяина нарушена [16, 17]. Врожденные иммунные механизмы фагоцитов хозяина являются основным методом защиты от грибковых патогенов [17].Фагоцитарный клиренс грибковых патогенов начинается с активации ассоциированных с патогенами молекулярных паттернов – специфичных для грибов молекул клеточной поверхности – рецепторами распознавания паттернов фагоцитов [16, 17], которые запускают индукцию цитокинов, хемокинов и других антимикробных медиаторов для управления воспалением. и защита хозяина [16].
Несколько исследований продемонстрировали, что LAP играет критическую роль в противогрибковом иммунитете во время грибковой инфекции [14, 18–24] и необходим для эффективного уничтожения грибков [25].LAP, но не каноническая аутофагия, участвует в деградации поглощенных конидий Aspergillus [14, 21, 22] (Figure 1). Дектин-1 играет ключевую роль в регуляции индукции LAP. Мыши с дефицитом дектина-1 нарушили распознавание β -глюкана, что привело к повышенной восприимчивости к грибковым инфекциям, вызываемым A. fumigatus [26]. Более того, генетические полиморфизмы, влияющие на человеческий Dectin-1, также рассматривались как потенциальные прогностические факторы, которые увеличивают восприимчивость к инвазивному аспергиллезу у пациентов с ослабленным иммунитетом [27].Дополнительные доказательства участия LAP в клиренсе A. fumigatus были предоставлены с использованием LAP-дефицитных мышей ATG7, которые проявляли повышенную грибковую нагрузку, воспаление и уровни провоспалительных цитокинов [28]. Кирмизи и др. недавно сообщили, что воздействие на поверхность β -глюкана при прорастании «набухающих» конидий A. fumigatus активирует LAP посредством сигнального каскада киназы Dectin-1 / Src / Syk и последующего привлечения липидата LC3 (LC3-II) к Aspergillus -содержащие фагосомы [19].Рекрутирование LC3 в фагосомы, содержащие Aspergillus , зависело от продукции АФК, опосредованной НАДФН оксидазой [19, 21]. Моноциты пациентов с хронической гранулематозной болезнью (ХГБ) – никотинамидадениндинуклеотидфосфат (НАДФН) оксидаза-дефицит – обнаруживали дефектное привлечение LC3 к фагосомам в ответ на интернализованные бактерии и Aspergillus [19–21]. У мышей и человека воспалительные процессы и восприимчивость к инфекциям регулируются LAP [20]. Потеря продукции ROS была связана с уменьшением количества LC3-положительных клеток при A.fumigatus и высокий уровень активности инфламмасом / каспаз, причем обе функции нормализуются при лечении анакинрой [20]. Интересно, что лечение кортикостероидами ингибирует передачу сигналов Src / Syk и продукцию ROS, что приводит к нарушению рекрутирования LC3-II в фагосомы. Это предполагает, что ингибирование LAP кортикостероидами может способствовать повышенной чувствительности, связанной с лечением кортикостероидами [19]. Эти данные позволяют предположить, что LAP является лекарственным путем при инфекциях Aspergillus .Кроме того, Akoumianaki et al. показали, что меланин клеточной стенки также блокирует функциональный LAP против A. fumigatus [21]. Механически меланин ингибирует НАДФН-оксидазозависимую активацию LAP путем избирательного исключения субъединицы p22phox из фагосомной мембраны [21]. Таким образом, индуцированная меланином блокада LAP является важной стратегией вирулентности, которая придает устойчивость к убийству макрофагами, одновременно способствуя развитию инвазивной грибковой инфекции [29]. В совокупности эти исследования подтвердили, что активация LAP в ответ на конидию Aspergillus происходит посредством Dectin-1 / Syk kinase / NADPH-зависимого механизма.Martinez et al. также идентифицировали Rubicon как молекулярный переключатель между репрессией аутофагии и активацией LAP [14]. В частности, они показали незаменимую роль Rubicon в LAP A. fumigatus и идентифицировали белки аутофагии (Beclin-1, Atg7, UVRAG, VPS34 PI3-киназный комплекс I и LC3-II), необходимые для LAP [14] . Рекрутирование Rubicon в LAPosomes, как было обнаружено, зависит от комплекса PI (3) K, а созревание LAPosomes требует продукции ROS посредством NOX2 [14].LAP-дефицитные мыши проявляли повышенное патологическое воспаление, провоспалительные цитокины (такие как IL-1 β , IL-6, IL-12 и TNF- α ) и грибковую нагрузку [14]. Эти данные подчеркивают как молекулярную потребность в LAP, так и центральную роль Rubicon в иммунном ответе на A. fumigatus .
LAP также возник в ответ на Candida albicans в зависимости от воздействия достаточного количества β -глюкана на поверхность клетки [30].Предыдущие исследования показали успешное привлечение LC3 к частицам зимозана [14] и шарикам полистирола, покрытым β -глюканом [18, 30]. Привлечение LC3 к фагосомам, содержащим C. albicans , способствовало представлению MHC класса II грибковых антигенов в дендритных клетках [18] и способствовало фунгицидной активности и экспрессии провоспалительных цитокинов в макрофагах [30]. Аутофагия усиливала активность NF- κ B в ответ на грибок посредством секвестрации A20, и это позволяло высвобождать хемокины для рекрутирования нейтрофилов.Соответственно, мыши, лишенные аутофагии в миелоидных клетках, показали более высокую восприимчивость к инфекции C. albicans из-за нарушения рекрутирования нейтрофилов [24]. Однако роль аутофагии in vivo еще не выяснена. Было показано, что белки аутофагии ATG5 и ATG7 играют защитную роль у мышей [6, 15], но не при системной инфекции C. albicans человека [31]. Вероятно, что роль белков аутофагии в защите хозяина от C. albicans зависит от вида грибов и может зависеть от конкретных компонентов аутофагии.Белки аутофагии также участвуют в ответе хозяина на Cryptococcus neoformans . ATG5, ATG9a и ATG12 были задействованы, но не обязательно, в макрофагах, фагоцитирующих C. neoformans , и белки рекрутировались вблизи вакуолей, содержащих C. neoformans [23]. Однако белки аутофагии и LC3 усиливают внутриклеточную репликацию и выход C. neoformans из вакуолей. Действительно, фармакологическое подавление аутофагии 3-метиладенином и дефицит Atg5 в миелоидных клетках [23] снижали уровни инфекции Cryptococcus [32].Необходимы дальнейшие исследования для выяснения роли аутофагии и LAP в инфекции Cryptococcus .
3. DAPK1 ослабляет воспаление во время грибковой LAP
Способность LAP выполнять очистку от патогенов при одновременном ослаблении воспаления и аутоиммунитета [33] указывает на LAP как на идеальный лекарственный путь иммунного гомеостаза во время инфекций и требует лучшего понимания молекулярные механизмы, лежащие в основе этого. Предполагаемые механизмы, с помощью которых LAP может регулировать иммунную функцию, были недавно описаны [33].Мы недавно идентифицировали механизм, с помощью которого воспаление регулируется во время LAP, то есть через ассоциированную со смертью протеинкиназу 1 (DAPK1) [22]. DAPK1 представляет собой Ca +2 / кальмодулин-регулируемую серин / треониновую киназу, первоначально идентифицированную как эффектор индуцированной IFN- γ гибели клеток, с ключевой ролью в подавлении роста опухоли [34]. DAPK1 – это молекула, которая участвует во множестве сигнальных каскадов [35] с плейотропным действием на регуляцию воспаления в зависимости от типов клеток и сигналов окружающей среды [34].В легких DAPK1 подавлял воспаление легких и повреждение дыхательных путей [36]. Следует отметить, что экспрессия DAPK1 регулируется сигнальным путем IFN- γ посредством протеолитического расщепления и ядерной транслокации транскрипционного фактора ATF6, активируемого стрессом эндоплазматического ретикулума, в ассоциации с фосфорилированным фактором транскрипции C / EBP- β [ 37, 38]. Интересно, что IFN- γ играет решающую роль в противогрибковом иммунитете [16] с множеством ролей, от аутофагии до негативной регуляции воспалительного ответа.Соответственно, IFN- γ используется для лечения инвазивных грибковых инфекций [16]. Мы обнаружили, что DAPK1 играет двойную защитную роль против инфекции Aspergillus . Он был задействован в фагосомах, содержащих Aspergillus , способом, зависящим от Rubicon, и был важен для LAP и выведения грибов (рисунки 1 и 2). Кроме того, DAPK1 был способен индуцировать убиквитинирование инфламмасомы рецепторного белка 3, подобного нуклеотидсвязывающему домену (NLRP3), в зависимости от F-бокса, богатого лейцином повтора белка 2, таким образом сдерживая воспалительную реакцию.В соответствии с участием DAPK1 в LAP в ответ на грибок, ингибирование DAPK1 не влияет на индуцированную рапамицином аутофагию [22], это открытие подтверждает, что DAPK1 не участвует в аутофагии, вызванной голоданием [39]. Клинический перевод этих результатов оценивался на двух разных моделях. Учитывая зависимость DAPK1 от NOX2, мы обнаружили, что экспрессия DAPK1 отсутствовала на модели мышей с CGD и в моноцитах пациентов с CGD и могла быть восстановлена после лечения IFN- γ .Кроме того, в группе пациентов с трансплантированными гемопоэтическими стволовыми клетками мы смогли показать, что генетический дефицит DAPK1 был связан с усилением воспаления и предрасположенностью к аспергиллезу [22]. Таким образом, сигнальный путь IFN- γ / DAPK1 не только опосредует LAP в ответ на A. fumigatus , но также ингибирует активацию NLRP3, сдерживает патогенное воспаление и является лекарственным путем.
4. Перекрестная регуляция между LAP и канонической аутофагией при грибковых инфекциях
Приведенные выше результаты ясно указывают на то, что LAP кардинально способствует контролю инфекции и воспаления на границе раздела грибок / хозяин.Однако вклад канонической аутофагии в этот процесс менее очевиден. В связи с этим было продемонстрировано, что мыши ULK1, , – / – обладают такой же устойчивостью к инфекции, как и мыши с канонической аутофагией [14]. В соответствии с этим наблюдением мы показали, что рапамицин, известный индуктор канонической аутофагии [40], не может повышать устойчивость к инфекции при введении обычным мышам C57BL / 6 с легочным аспергиллезом [41]. Этот результат может указывать на ограниченную роль, если таковая имеется, канонической аутофагии в очищении от грибка и воспалении.Это оказалось так, поскольку лечение мышей CGD рапамицином не спасало мышей от инфекции. Фактически, лечение рапамицином уменьшало выживаемость, препятствовало выведению грибков и в значительной степени способствовало воспалению (Рисунки 3 (a) –3 (c)). Как уже было показано [42], обработка IFN- γ способствовала очищению от грибков и уменьшала патогенное воспаление (Рисунки 3 (a) –3 (c)). В целом, эти результаты подтверждают уникальную роль LAP в инфекции Aspergillus и предполагают возможную перекрестную регуляторную активность между канонической аутофагией и LAP во время инфекции (Figure 2).Это неудивительно, учитывая, что Rubicon, как известно, подавляет каноническую аутофагию [14]. Однако менее ясно, мешает ли и как каноническая аутофагия развитию LAP. Учитывая, что IFN- γ может активировать аутофагию посредством триптофанового голодания с помощью фермента индоламин-2,3-диоксигеназа 1 [43], мы обратились к мышам Indo – / – для оценки возможной регуляторной активности канонической аутофагии на LAP. . Мы обнаружили, что индуцированная IFN- γ аутофагия была дефектной в макрофагах Indo – / – и не модифицировалась ингибированием DAPK1 [22].Напротив, LC3-зависимый фагоцитоз гриба наблюдался в макрофагах Indo – / – in vitro, а экспрессия DAPK1 увеличивалась у мышей Indo – / – при инфицировании in vivo. Блокирование DAPK1 значительно увеличивало грибковую нагрузку и распространение у мышей Indo – / – , а также рекрутирование воспалительных клеток в легких и в жидкости бронхоальвеолярного лаважа [22], это открытие указывает на то, что аутофагия, вызванная голоданием, и LAP являются отдельными, но взаимодополняющими путями в инфекции Aspergillus .
5. Выводы
Механизм аутофагии / LAP активируется в ответ на грибки, что делает этот путь доступным для лечения. В этом отношении IFN-, γ и анакинра являются обучающими примерами успешных противогрибковых агентов, нацеленных на механизм аутофагии. Однако результаты аутофагии / LAP в формировании иммунных ответов хозяина, по-видимому, сильно различаются в зависимости от вида грибов. Вполне вероятно, что эти результаты также зависят от типов задействованных иммунных клеток.В конечном счете, одним из наиболее интригующих аспектов, требующих дальнейшего изучения, является взаимосвязь между селективными формами аутофагии и неканонической аутофагией в разных клеточных компартментах. Умение различать каноническую и неканоническую аутофагию может предложить способ идентифицировать молекулярные сигнатуры аутофагии, которые выходят за рамки избирательного распознавания груза, чтобы включить сигнатуры, защищающие хозяина.
Аббревиатуры
| ATG: | Гены, связанные с аутофагией | |||
| ATF6: | Активирующий фактор транскрипции 6 | |||
| C / EBP: | CCAAT | -связывающие белки / энхансер 90D357 | Хроническая гранулематозная болезнь | |
| DAPK1: | Связанная со смертью протеинкиназа 1 | |||
| IFN- γ : | Интерферон гамма | |||
| Indice – / m , Мыши с дефицитом фермента 3-диоксигеназы 1 | ||||
| LAP: | LC3-ассоциированный фагоцитоз | |||
| LC3: | Связанный с микротрубочками белок 1A / 1B-легкая цепь 3 | |||
| MHC комплекс | ||||
| НАДФН: | Никотинамидадениндинуклеотидфосфатоксидаза | |||
| NLR P3: | Нуклеотидсвязывающий домен-подобный рецепторный белок 3 | |||
| PE: | Фосфатидилэтаноламин | |||
| PI (3) P: | PI (3) P: Фосфатидилинозит (PI) 3-киназы | |||
| ROS: | Активные формы кислорода | |||
| Rubicon: | Run domain Beclin-1-intericing and cysteine-rich domain-contains protein | |||
| тирозинкиназа | ||||
| ULK: | UNC-51-подобная киназа, активирующая аутофагию 1 | |||
| UVRAG: | Ген, связанный с устойчивостью к УФ-излучению. |
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов в отношении публикации этой статьи.
Благодарности
Это исследование было поддержано Целевым исследовательским проектом FunMeta (ERC-2011-AdG-293714, Луиджина Романи).
Долголетие и аутофагия
Недавно у меня была возможность выступить одним из спонсоров мероприятия по смузи на FaceBook Live с Salt Kitchen & Co в центре Дикинсона. Мы представили несколько различных вариантов смузи и выделили часть оборудования из кухонного магазина. Это было веселое время, и, надеюсь, те, кто вошли в систему, чему-то научились. Мероприятие вернуло меня к моим корням в приготовлении смузи, которым я занимаюсь последние 15-20 лет.
Один из основных выводов, которые я хотел, чтобы люди знали о смузи, заключается в том, что они такие, какими вы их себе представляете, а это означает, что не существует правильного или неправильного способа их приготовления. Примером этого является вопрос, когда меня спрашивают, как приготовить смузи, что я нахожу немного смешным, потому что они чертовски просты.По определению Вебстера, смузи – это сливочный напиток, приготовленный из фруктов, смешанных с соком, молоком или йогуртом. Определение – отличное место для начала, но это базовая версия, которую я расширю в этой статье.
Прежде всего, смузи – это то, чем вы его делаете. Это не ракетостроение, и поэтому для приготовления одного из этих вкусных угощений не требуется специальной степени. Лето – идеальное время, чтобы запустить автомат для приготовления смузи, потому что у нас есть множество свежих фруктов и овощей.
По словам Вебстера, это будет основная формула смузи: жидкость на ваш выбор, свежие или замороженные фрукты и овощи и лед, если вы хотите, чтобы он был немного более замороженным. Это основа смузи, но мы не должны останавливаться на достигнутом. Вы можете добавить белок, фрукты и зелень, коллаген, порошок для детоксикации и даже конкретизировать ингредиенты, направленные на воспаление, поддержку мозга или сердечно-сосудистые заболевания.
В качестве жидкости можно выбрать простую воду или любую другую жидкость, добавляющую влагу в смузи.Вебстер говорит, что вы можете использовать сок, что я не большой поклонник из-за того, что он может добавить много сахара в смузи, но иногда это может быть забавным удовольствием. Молочные продукты – еще один вариант, но я предпочитаю альтернативы молоку, такие как овсяное, конопляное, соевое, миндальное и мое любимое кокосовое молоко, которое я предпочитаю, потому что его текстура похожа на молоко. Следует учитывать, что некоторые ароматизированные заменители молока могут содержать сахар, поэтому читайте этикетку. Количество добавляемой жидкости зависит от желаемой консистенции. Если вам нравится более жидкий смузи, добавьте еще воды. Текстура будет зависеть от типа добавляемых ингредиентов, порошков и льда.
Фрукты и овощи могут быть настолько восхитительными или мягкими, насколько вы хотите. Раньше я всегда делал свои смузи с бананом и арахисовым маслом довольно простым смузи, но они мне нравились. Если положить в них разные продукты, в том числе шпинат и капусту, они получатся не только вкусными, но и очень питательными. Я предпочитаю более замороженный смузи, но мне не особо нравится, как лед со временем делает его водянистым; Поэтому мои основные ингредиенты – это замороженная клубника и малина, и время от времени я добавляю замороженные манго и вишню.
Свежую или замороженную чернику часто добавляют, потому что она богата антиоксидантами. Если вы когда-нибудь используете их и оставите смузи на какое-то время, ваш смузи может превратиться в один большой блок смузи, из-за чего его будет сложно пить, не упав целиком на ваше лицо. Причина этого кроется в высоком содержании пектина в чернике. Пектин вызывает образование геля, и простое его смешивание решит проблему.
После того, как вы выбрали все ингредиенты, можно приступать к сборке смузи. Вы можете использовать такие простые устройства, как шейкер, одноразовый блендер (их отличный выбор в Salt Kitchen & Co) или полноразмерный блендер. Вы можете потратить очень мало или много в зависимости от того, что ищете, но если вы придирчивы к консистенции, я бы потратил больше и получил тот, который хорошо измельчает и дает вам смузи, потому что они не называются “коренастый” по этой причине.
И наконец, что вы можете добавить в свой смузи, чтобы сделать его более питательным или решить проблемы, которые могут происходить в вашем теле? Протеин будет наиболее часто добавляемым ингредиентом. Добавление 15-20 г белка – отличное начало. Протеин доступен во многих формах; сыворотка, горох, рис, конопля, говядина или палео, и это лишь некоторые из них. Ваш выбор будет зависеть от стоимости, текстуры, вкуса, аромата и источника.
Покупка протеина может быть немного пугающей отчасти из-за огромных емкостей, а также из-за того, что вы не знаете, понравится ли вам этот продукт или вы будете терпеть его. Это одна из причин, по которой мы предлагаем образцы в аптеке, потому что мы хотим, чтобы вы были довольны своей покупкой, а не просто покупали то, что в конечном итоге истечет в шкафу.
Фрукты и зелень продукты – еще один дополнительный ингредиент. Они могут предоставить питательные вещества, плотно упакованные в небольшую ложку. И снова самая важная область, вызывающая беспокойство, – это вкус. Как и в случае с белком, если он неприятный на вкус, вам будет сложно каждый день заглатывать смузи, и если вы попытаетесь добавить его в свой ежедневный режим, вы можете сорвать этот план с помощью невкусных фруктов и зеленых продуктов. Выбор продукта, который не только приятен на вкус, но и содержит антиоксиданты, про- и пребиотики, значительно повысит питательную ценность вашего смузи
.Когда я тороплюсь, я использую протеин, зелень и кокосовое молоко в шейкере с 6-8 кубиками льда. Это быстро и дает мне питательные вещества, которые мне нужны утром или днем. Я обычно пью их по дороге на работу и обычно оставляю в машине пару шейкеров, что не впечатляет мою любимую жену.
Я расскажу о дополнительных ингредиентах в своей следующей статье, и, надеюсь, вы узнали немного об основах приготовления смузи.
Мои сотрудники и я хотели бы помочь вам с вопросами относительно вариантов смузи, поэтому позвоните или зайдите, чтобы назначить консультацию. До следующего раза будьте бдительны за свое здоровье !!
границ | Ось MiR-135-5p-p62 регулирует аутофагический поток, опухолевый потенциал и клеточные взаимодействия, опосредованные внеклеточными пузырьками, во время аллергического воспаления
Введение
Нарушение аутофагии в миелоидных клетках играет причинную роль в эозинофильном воспалении и хроническом риносинусите (1). Нарушение регуляции активности аутофагии и инфламмасом способствует развитию аутовоспалительных заболеваний (2).Аутофагия играет решающую роль в дегрануляции тучных клеток (3, 4). Блокада гистаминового рецептора h4 (h4R) может ингибировать фосфорилирование рапамицина (mTOR) млекопитающих и усиливать аутофагию (5). В-клеточная аутофагия усугубляет экспериментальную астму по множеству механизмов (6). Усиленная антителами инфекция вирусом денге (DENV) клеток KU812 (линия предбазофилоподобных клеток) и линия незрелых тучных клеток человека (HMC-1) показывает увеличение везикул аутофагосом, пунктировку легкой цепи 3 (LC3) и LC3-II. накопление (7).MTOR, ингибитор аутофагии, опосредует метаболическую адаптацию антигенпрезентирующих клеток (APC) в различных тканях, влияя, таким образом, на иммунологические характеристики аллергического воспаления (8). Ингибирование активности PI3K / Akt и последующая блокада модуля mTOR-hypoxia-inducible factor (HIF) -1α-фактора роста эндотелия сосудов (VEGF) может ослабить типичный астматический приступ на мышиной модели (9). Трансглутаминаза II (TGaseII) опосредует пассивную кожную анафилаксию и атопический дерматит (10). TGase II посредством взаимодействия с NF-kappaB может индуцировать гистондеацетилазу-3 (HDAC3) путем прямого связывания с промоторными последовательностями (10).HDAC3 может взаимодействовать с FcεRIβ и опосредовать аллергическое воспаление за счет увеличения экспрессии хемоаттрактантного белка 1 моноцитов (MCP1) (11). Подавление HDAC3 отменяет способность ингибитора HDAC вальпроевой кислоты (VPA) модулировать фосфорилирование AKT, подавлять рост опухолевых клеток и вызывать аутофагию (12). Таким образом, аутофагия может играть роль в аллергическом воспалении.
Адаптерный белок каркаса P62 / SQSTM1 представляет собой рецептор аутофагии, который действует как связующее звено между механизмами убиквитинирования и аутофагии.Связываясь со своим лигандом, p62 действует как модулятор макроаутофагии и индуцирует биогенез аутофагосом (13). Стимуляция TLR2 / 6 или TLR4 в первичных кератиноцитах человека может активировать пути аутофагии и увеличить экспрессию p62 за счет индукции NADPH-оксидаз 2 и 4 и генерации активных форм кислорода (14). P62 действует после активации TCR. Это важно при поляризации Th3 и астме. P62 также играет важную роль в контроле длительной активации NF-kappaB и позднего синтеза GATA3 и IL-4, участвуя в активации комплекса IKK (15).Сверхэкспрессия p62 увеличивает уровни экспрессии провоспалительных цитокинов, таких как TNFα, CXCL10 и CCL2 (16). P62 может стабилизировать белок COX-2 посредством своего убиквитин-ассоциированного домена. P62 может также регулировать продукцию простагландина E 2 in vitro (17). Известно, что ось miR-26a / -26b-COX-2 регулирует аллергическое воспаление (18). Эти сообщения предполагают роль p62 в аллергическом воспалении.
Астма показывает усиленную секрецию внеклеточных везикул эпителиальными клетками, а не макрофагами, под влиянием IL-13 (19).Альвеолярные макрофаги секретируют SOCS1 и SOCS3 во внеклеточные везикулы и микрочастицы, соответственно, для захвата альвеолярными эпителиальными клетками и последующего ингибирования активации STAT (20). Ось MiR-122-SOCS1 регулирует аллергическое воспаление (21). Повышенное высвобождение внеклеточных везикул может вызвать аутофагию (22). Внеклеточные везикулы в ЖБАЛ от астматиков могут способствовать субклиническому воспалению за счет увеличения выработки цитокинов и LTC (4) в эпителии дыхательных путей (23). GW4869, ингибитор образования внеклеточных везикул, может снижать количество цитокинов Th3 и эозинофилов в ЖБАЛ и уменьшать накопление эозинофилов в стенках дыхательных путей и слизистой оболочке (24).Эти сообщения предполагают роль внеклеточных пузырьков в аллергическом воспалении.
В этом исследовании мы представляем новую роль оси miR-135-5p-p62 в регуляции аллергического воспаления в сочетании с аутофагическим потоком, клеточными взаимодействиями и повышенным канцерогенным и метастатическим потенциалом раковых клеток, вызванным аллергическим воспалением. Мы показали присутствие p62 во внеклеточных везикулах и роль p62 в клеточных взаимодействиях, опосредованных внеклеточными везикулами во время аллергического воспаления.Таким образом, ось miR-135-5p-p62 может быть использована для разработки терапевтических средств против аллергии.
Материалы и методы
Материалы
Олигонуклеотиды, использованные в этом исследовании, были коммерчески синтезированы компанией Bioneer Co. (Тэджон, Корея). DNP-HSA (2,4-динитрофенил-человеческий сывороточный альбумин), TNP-BSA (тринитрофенил-бычий сывороточный альбумин), DNP-специфические IgE-антитела и TNP-специфические IgE-антитела были приобретены у Sigma. Химические вещества, использованные в этом исследовании, были приобретены у Sigma. Все остальные антитела были приобретены у Cell Signaling Co.(Беверли, Массачусетс). Конъюгированные с пероксидазой хрена антитела против мышиного и кроличьего IgG были приобретены у Pierce. Липофектамин и реагент PlusTM для трансфекции были приобретены у Invitrogen.
Культура клеток
Клетки базофильного лейкоза крыс (RBL2h4), клетки B16F1 и клетки B16F10 были получены из Korea Cell Line Bank (Сеул, Корея). Клетки выращивали в среде Игла, модифицированной Дульбекко, содержащей инактивированную нагреванием фетальную бычью сыворотку, 2 мМ L-глутамин, 100 единиц / мл пенициллина и 100 мкг / мл стрептомицина (Invitrogen).Культуры поддерживали в 5% CO 2 при 37 ° C. Тучные клетки легких и макрофаги легких выделяли в соответствии со стандартными процедурами (25).
Мыши
Пятинедельные самки мышей BALB / C были приобретены в Nara Biotech (Сеул, Корея). Все эксперименты на животных были одобрены институциональным комитетом по уходу и использованию животных (IACUC) Национального университета Кангвон (KIACUC-160329-2) и проводились в соответствии с руководящими принципами этического комитета по уходу и использованию лабораторных животных.Для измерения онкогенного потенциала клетки меланомы мыши B16F1 (1 × 10 6 клеток в 100 мкл PBS) после индукции пассивной системной анафилаксии вводили подкожно в правый бок каждой мыши ( n = 5).
Анализ активности β-гексозаминидазы
Анализ активности β-гексозаминидазы проводили по стандартным методикам (26).
Иммуноблоттинг и иммунопреципитация
Иммуноблоттинг и иммунопреципитацию проводили по стандартным методикам (25).
Уровни выхода PGE2 и гистамина
Уровни PGE2 и количество высвобожденного гистамина измеряли в соответствии с инструкциями производителя, используя коммерчески доступный набор для ELISA (Abcam, UK). Продукт реакции измеряли колориметрически с помощью считывающего устройства для микропланшетов.
Химиотерапевтические тесты на вторжение и миграцию
Инвазивный потенциал определяли с использованием системы трансвеллентных камер с фильтрующими вставками из поликарбоната с порами 8 мкм (CoSTAR, Acton, MA).Нижняя и верхняя стороны фильтра были покрыты желатином и матригелем соответственно. Для определения потенциала миграции нижние стороны фильтров были покрыты желатином. Трипсинизированные клетки (5 × 10 3 ) в бессывороточной среде RPMI 1640, содержащей 0,1% бычьего сывороточного альбумина, добавляли в каждую верхнюю камеру трансвелл. Среду RPMI 1640 с добавлением 10% фетальной бычьей сыворотки помещали в нижнюю камеру и клетки инкубировали при 37 ° C в течение 16 часов. Клетки фиксировали метанолом, и пораженные клетки окрашивали и подсчитывали.
Иммунофлуоресцентное окрашивание
Клетки высевали на стеклянные покровные стекла в 24-луночных планшетах и фиксировали 4% параформальдегидом (об. / Об.) В течение 10 минут, а затем подвергали проницаемости 0,4% Triton X-100 в течение 10 минут. Клетки инкубировали с первичными антителами, специфичными к LC3 (1: 100; Santa Cruz Biotechnology), P62 (1: 100; Santa Cruz Biotechnology), CD163 (1: 100; Ab Cam) или iNOS (1: 100; Santa Cruz Biotechnology). за 2 ч. Вторичные антитела против кроличьего Alexa Fluor 488 (для обнаружения LC3 и iNOS) или против козьего Alexa Fluor 546 (для обнаружения P62 и CD163) (молекулярные зонды) добавляли к клеткам и инкубировали в течение 1 часа.Флуоресцентные изображения получали с использованием конфокального лазерного сканирующего микроскопа и программного обеспечения (Fluoview, версия 2.0) с объективом X 60 (Olympus FV300, Токио, Япония).
Анализ пробок Matrigel
Семинедельным мышам BALB / C (Nara Biotech) подкожно вводили 0,1 мл культуральной среды, содержащей матригель, и 10 единиц гепарина (Sigma). Через 8 дней кожу мыши легко оттянули, чтобы обнажить пробку матригеля, которая осталась нетронутой. Содержание гемоглобина (Hb) в пробках из матригеля измеряли с помощью реактива Драбкина (Sigma, США) для количественной оценки образования кровеносных сосудов.
Трансфекция
Трансфекции выполняли в соответствии с инструкциями производителя. Использовали реагенты Липофектамин и Плюс (Invitrogen). Для нокдауна miR-135-5p клетки трансфицировали 10 нМ олигонуклеотида (ингибитор) с липофектамином 2000 (Invitrogen) в соответствии с протоколом производителя. Используемые последовательности представляли собой 5′-UUCACAUAGGAAUAAAAAGCCAUA-3 ‘(ингибитор miR-135-5p) и 5′-TAACACGTCTATACGCCCA-3’ (контрольный ингибитор).
Целевой анализ миРНК
Гены, содержащие сайт (ы) связывания miRNA в UTR, были получены с помощью программы TargetScan (http: // www.targetscan.org/, http://pictar.mdc-berlin.de/, http://www.microrna.org/microrna/home.do).
Экстракция РНК и количественная ПЦР в реальном времени (QRT-PCR)
Тотальную миРНК выделяли с использованием набора для выделения mir VanamiRNA (Ambion). MiRNA удлиняли с помощью реакции поли (A) хвоста с использованием набора хвостов поли (A) полимеразы A-Plus (Cell Script). кДНК синтезировали из миРНК с поли (А) хвостом с использованием адаптера поли (Т) праймера и обратной транскриптазы qScriptTM (Quanta Biogenesis).Уровень экспрессии miR-135-5p или p62 определяли количественно с помощью набора SYBR Green для количественной ПЦР в реальном времени (Ambion) с использованием miRNA-специфичного прямого праймера и универсального поли (Т) адаптера обратного праймера. Уровень экспрессии miR-135-5p был определен на основе порога ( Ct ), а относительные уровни экспрессии были рассчитаны как 2 – (Ct ofmiR −135-5 p ) – ( CtofU 6) после нормализации в отношении экспрессии малой ядерной РНК U6. Для количественной ПЦР в реальном времени использовали смесь SYBR PCR Master Mix (Applied Biosystems) в термоциклере системы реального времени CFX96 (Bio-Rad).
Конструкции
Для создания конструкции pGL3–3′-UTR-P62 сегмент гена p62 человека длиной (136), включающий 3′-UTR, амплифицировали с помощью ПЦР и субклонировали в сайт (XbaI) люциферазной плазмиды pGL3. Мутантная конструкция pGL3–3′-UTR-CAGE была получена с помощью набора для сайт-направленного мутагенеза QuikChange (Stratagene). Анализ активности люциферазы выполняли в соответствии с инструкцией по эксплуатации (Promega).
Пассивная кожная анафилаксия
мышей BALB / C сенсибилизировали внутрикожной инъекцией IgE (0.5 мкг / кг). Двадцать четыре часа спустя мышам вводили внутривенную инъекцию DNP-HSA (250 мкг / кг) и 2% (об. / Об.) Раствора синего Эванса. Через час после инъекции раствора синего Эванса после провокации ДНП-ЧСА мышей умерщвляли, и 2% (об. / Об.) Краситель синего Эванса экстрагировали из каждого рассеченного уха в 700 мкл ацетона / воды (7: 3) в течение ночи. . Поглощение синего Эванса в экстрактах измеряли с помощью спектрофотометра при 620 нм. Чтобы определить влияние p62 на PCA, мышам BALB / C внутрикожно вводили DNP-IgE (0.5 мкг / кг) и внутривенное введение миРНК p62 (100 нМ). На следующий день мышам BALB / C внутривенно вводили PBS или DNP-HSA (250 мкг / кг) вместе с 2% (об. / Об.) Раствором Эванса синего для определения степени проницаемости сосудов, сопровождающейся PCA.
Влияние пассивной системной анафилаксии на опухолевый потенциал
мышей BALB / C сенсибилизировали путем внутривенной инъекции IgE (0,5 мкг / кг). На следующий день сенсибилизированным мышам внутривенно вводили DNP-HSA (250 мкг / кг).Через два дня после инъекции DNP-HSA клетки меланомы мыши B16F1 (1 × 10 6 клеток) инъецировали в бока каждой мыши BALB / C. Чтобы определить влияние p62 на повышенный канцерогенный потенциал PSA, мышам BALB / C в указанные дни вводили внутривенную инъекцию siRNA p62 (100 нМ).
Влияние пассивной системной анафилаксии на метастатический потенциал
Пассивная системная анафилаксия была вызвана, как описано. Через три дня после инъекции IgE мышам BALB / C внутривенно вводили клетки меланомы B16F1 (2 × 10 5 ).Чтобы определить влияние p62 на повышенный метастатический потенциал раковых клеток с помощью PSA, мышам BALB / C внутривенно вводили p62 siRNA (100 нМ) на 5, 7, 10 и 12 дни. На 14 день опухолевые ткани легких. были собраны.
Мониторинг ректальной температуры
Изменения внутренней температуры тела, связанные с системной анафилаксией, контролировались путем измерения изменений ректальной температуры с помощью ректального зонда, соединенного с цифровым термометром.
Иммуногистохимическое окрашивание
Иммуногистохимическое окрашивание проводили с использованием метода определения авидин-биотина (набор Vectastain ABC, Vector Laboratories Inc., Бурлингейм, Калифорния).
Наблюдение аутофагосом под электронным микроскопом
IgE-сенсибилизированные клетки RBL2h4, стимулированные без или с помощью DNP-HSA (100 нг / мл) в течение 2 часов, фиксировали 2,5% глутаровым альдегидом в 0,1 М растворе какодилата (pH 7,0) в течение 1 часа, а затем использовали 2% тетроксид осмия в течение 2 ч при 4 ° C. Затем клетки обезвоживали серией градуированного ацетона и помещали в среду Spurr (система электронной микроскопии). Образцы разделяли (60 нм) на ультрамикротоме (RMC MTXL, Аризона, США) и дважды окрашивали 2% уранилацетатом в течение 20 минут и цитратом свинца в течение 10 минут.Затем срезы просматривали под ТЕМ Tecnai G2 (FEI, США) при 200 кВ.
Выделение и характеристика внеклеточных везикул
Клетки культивировали в бессывороточной среде (Invitrogen, Carlsbad, CA). Культуральную среду собирали через 48 ч инкубации, а фракцию внеклеточных везикул очищали с использованием реагента Exoquick-TC (System Biosciences, Mountain View, CA) в соответствии с инструкциями производителя. Внеклеточные везикулы наблюдали под просвечивающим электронным микроскопом Tecnai T10 (FEI, США).
Маркировка и интернализация внеклеточных везикул
Выделяливнеклеточных везикул из стимулированных антигеном клеток RBL2h4 и метили с использованием наборов для связывания флуоресцентных клеток PKH67 (Sigma-Aldrich, Сент-Луис, Миссури). Чтобы исследовать захват внеклеточных везикул, нестимулированные клетки RBL2h4 помещали на покровное стекло (2 × 10 4 клеток). Через 24 часа покровные стекла трижды промывали в PBS, и каждую среду, содержащую внеклеточные везикулы, меченные PKH67, или внеклеточные везикулы, не меченные PKH67, добавляли в каждую лунку на 24 часа.После инкубации покровные стекла трижды промывали PBS и затем добавляли к предметным стеклам 4% раствор параформальдегида на 15 мин. Покровные стекла трижды промывали в PBS. Клетки визуализировали под конфокальным лазерным сканирующим микроскопом LX70 FV300 05-LPG-193 (Olympus).
Присутствие P62 во внеклеточных везикулах клеток RBL2h4, стимулированных антигеном
Внеклеточных везикул, экстрагированных из стимулированных антигеном клеток RBL2h4 (REF, модель KIT), подвергали центрифугированию при 60 000 g в течение 30 мин для осаждения внеклеточных везикул.Собранные внеклеточные везикулы фиксировали 0,1% глутаровым альдегидом и 2% параформальдегидом в фосфатном буфере (pH 7,4) в течение 1 ч при 4 ° C, а затем дополнительно фиксировали 2% тетроксидом осмия в течение 30 мин при 4 ° C. Они были обезвожены серией градуированных этанолов с последующей обработкой градуированной серией пропиленоксида и залиты эпоксидной смолой (PELCO, США). Ультратонкие срезы (~ 80 нм) получали с помощью Ultracut UCT (Leica, Германия), закрепляли на медных сетках и окрашивали 1% уранилацетатом и цитратом свинца (10 мин) для последующих наблюдений.Для электронной микроскопии иммуно-золотого мечения ультратонкие срезы на сетках обрабатывали 0,02 М глицином в течение 10 мин для гашения реакции свободной альдегидной группы. Затем срезы промывали деионизированной водой, флотировали в течение 1 часа в PBS, содержащем 1% BSA, и инкубировали непосредственно с первичными кроличьими или / или мышиными антителами (антителами против P62 и / и против CD63) в разведениях 1:20 в течение ночи. при 4 ° C. Сетку промывали пять раз 0,1% БСА в PBS, инкубировали со вторичными антителами, конъюгированными против кроличьего IgG до 10 нМ и антимышиными IgG, конъюгированными до 25 нМ (AURION, Голландия), разведенными 1:20 в 0.1% BSA-PBS. Сетки для образцов окрашивали уранилацетатом и цитратом свинца. Разделенные и меченные иммунным золотом сетки исследовали с помощью просвечивающего электронного микроскопа Tecnai T10 (FEI, США) при 100 кВ и просвечивающего электронного микроскопа JEOL-2100F (JEOL, США) при 200 кВ.
Статистический анализ
Данные были проанализированы и нанесены на график с использованием статистической программы GraphPad Prism (программное обеспечение GraphPad Prism). Результаты представлены в виде средних значений ± стандартное отклонение. Статистический анализ проводился с использованием односторонних тестов t , при этом различия между средними значениями считались значимыми, когда p <0.05.
Результаты
P62 Опосредует аллергическое воспаление, регулируя аутофагический поток
На основе тесной взаимосвязи между аллергическим воспалением и аутофагией (3, 4, 26) и роли p62, селективного адаптера в аутофагических процессах (13), было изучено влияние p62 на аллергическое воспаление. Антиген DNP-HSA увеличивал аутофагический поток, такой как ATG5, LC3-II, pBeclin1 , Ser14 и p62, вместе с HDAC3 и TGaseII в клетках RBL2h4 (рис. 1A). Ранее сообщалось о роли HDAC3 и TGaseII в аллергическом воспалении (11, 25, 26).Уровни экспрессии LC3-II, p62 и pBeclin1 Ser14 были увеличены в тучных клетках легких, стимулированных антигеном (рис. 1A, нижняя панель). Подавление p62 предотвращает увеличение антигеном аутофагического потока, HDAC3 и TGaseII. Это предотвращало индукцию антигеном взаимодействий FcεRIß с Lyn и HDAC3 (рис. 1B). Это также препятствовало увеличению активности ß-гексозаминидазы антигеном (рис. 1C). Подавление p62 только блокирует увеличение экспрессии p62 при стимуляции аллергена, но не снижает ее ниже уровня, обнаруженного в нестимулированных клетках RBL2h4 (рис. 1B).Повышенная экспрессия LC3 puncta (рис. 1D) и совместная локализация p62 с LC3 наблюдались в антиген-стимулированных клетках RBL2h4 (рис. 1D). Стимулированные антигеном клетки RBL2h4 показали увеличенное количество аутолизосом по сравнению с нестимулированными клетками RBL2h4 (фигура S1). 3-МА, ингибитор аутофагических процессов, предотвращал увеличение антигеном уровней аутофагического потока и признаков аллергического воспаления, не позволял антигену индуцировать взаимодействия FcεRIß с Lyn и HDAC3 (рис. S2A), не позволял антигену увеличивать активность ß-гексозаминидазы (рис. S2B), подавлял пассивную кожную анафилаксию (PCA) (Рисунок S2C), предотвращал увеличение активности ß-гексозаминидазы антигеном (Рисунок S2D) и предотвращал увеличение антигеном аутофагического потока и признаки аллергического воспаления на мышиной модели PCA (Рисунок S2E) .Таким образом, аллергическое воспаление опосредуется p62, который регулирует аутофагический поток. О влиянии p62 на аллергическое воспаление в сочетании с аутофагическим потоком ранее не сообщалось.
Рисунок 1 . P62 необходим для аллергического воспаления и регуляции аутофагического потока . (A) Клетки RBL2h4, чувствительные к IgE (специфическим к DNP), обрабатывали без или с использованием DNP-HSA (100 нг / мл) в течение различных интервалов времени с последующим иммуноблоттингом (верхняя панель). IgE-сенсибилизированные тучные клетки легких обрабатывали без или с помощью DNP-HSA в течение различных интервалов времени с последующим иммуноблоттингом (нижняя панель).Каждый блот представляет три независимых эксперимента. (B) Клетки RBL2h4 трансфицировали указанной миРНК (каждая по 10 нМ). На следующий день клетки сенсибилизировали IgE в течение 24 ч с последующей стимуляцией без или с помощью DNP-HSA. Scr. обозначает скремблированную миРНК. Каждый блот представляет три независимых эксперимента. (C) То же, что (B) , за исключением того, что была определена активность ß-гексозаминидазы. ** p <0,005; *** р <0.0005. Каждое значение представляет собой среднее значение трех независимых экспериментов. (D) Иммунофлуоресцентное окрашивание показывает совместную локализацию p62 с LC3 в клетках RBL2h4. Масштабные линейки представляют 10 мкм.
P62 Опосредует анафилаксию
МодельBALB / C на мышах пассивной кожной анафилаксии (PCA) была использована для исследования роли p62 в аллергическом воспалении. PCA увеличивал проницаемость сосудов (рис. 2A) и активность β-гексозаминидазы (рис. 2B) в зависимости от p62. P62 был необходим для повышения уровней экспрессии HDAC3 и TGase II.Это было также необходимо для взаимодействия FcεRIβ с HDAC3, Lyn и TGaseII в мышиной модели PCA (рис. 2C). Пассивная системная анафилаксия (ПСА) снижала ректальную температуру у мышей BALB / C (рис. 2D), но увеличивала активность β-гексозаминидазы (рис. 2E) зависимым от p62 образом. Подавление p62 предотвращает повышение уровня экспрессии антигена HDAC3 и TGaseII. Это также препятствовало тому, чтобы антиген индуцировал взаимодействия FcεRIβ с HDAC3, TGase II и Lyn (рис. 2F). Таким образом, p62 может опосредовать анафилаксию in vivo .
Рисунок 2 . P62 опосредует анафилаксию. (A) Мышам BALB / C вводили внутрикожную инъекцию IgE (0,5 мкг / кг) и внутривенную инъекцию указанной миРНК (каждая 100 нМ). На следующий день мышам BALB / C внутривенно вводили PBS или DNP-HSA (250 мкг / кг) вместе с 2% (об. / Об.) Раствором Эванса синего. Показаны репрезентативные изображения каждой мыши BALB / C каждой экспериментальной группы. Каждая экспериментальная группа состояла из четырех мышей BALB / C. (B, C) Лизат ткани уха от мышей BALB / C каждой экспериментальной группы подвергали анализу активности β-гексозаминидазы, иммуноблоттингу и иммунопреципитации.Мышам (D) BALB / C внутривенно вводили указанную миРНК. На следующий день мышам BALB / C внутривенно вводили IgE. На следующий день мышам BALB / C внутривенно вводили DNP-HSA и измеряли ректальную температуру. Каждая экспериментальная группа состояла из четырех мышей BALB / C. Средние ± S.E. изображены три независимых эксперимента. Было проведено сравнение между мышами, активированными PSA, и мышами, которым вводили SiP62. (E, F) Лизаты тканей подвергали анализу активности β-гексозаминидазы, иммуноблоттингу и иммунопреципитации.* p <0,05; ** p <0,005; *** p <0,005.
P62 Опосредует опухолевый потенциал клеток B16F1, усиленный пассивной системной анафилаксией
PSA увеличивал канцерогенный потенциал клеток B16F1 (фиг. 3A) и увеличивал активность β-гексозаминидазы в зависимости от p62 (фиг. 3B). PSA-индуцированное взаимодействие между FcεRIβ и HDAC3 p62-зависимым образом (рис. 3C). Повышенный канцерогенный потенциал при аллергическом воспалении, как известно, связан с повышенным ангиогенным потенциалом при аллергическом воспалении (21).Культуральная среда для стимулированных антигеном клеток RBL2h4 показала ангиогенный потенциал p62-зависимым образом на основании анализов матригелевой пробки (фигура 3D). Таким образом, p62 может опосредовать вызванное аллергическим воспалением усиление канцерогенного потенциала раковых клеток.
Рисунок 3 . P62 опосредует канцерогенный потенциал клеток B16F1, усиленный пассивной системной анафилаксией. (A) Пассивная системная анафилаксия (ПСА) вызывалась, как описано. Каждая мышь получала инъекцию клеток меланомы B16F1 (2 × 10 5 ) на 3 день.После того, как опухоль достигла определенного размера, мышам BALB / C внутривенно вводили указанную миРНК. Каждая экспериментальная группа состояла из четырех мышей BALB / C. (B, C) Лизат опухолевой ткани из каждой экспериментальной группы подвергали анализу активности β-гексозаминидазы, иммуноблоттингу и иммунопреципитации. (D) Культуральная среда для стимулированных антигеном клеток RBL2h4, трансфицированных каждой миРНК в течение 48 часов, подвергалась анализу с матригельной пробкой. СМ. обозначает питательную среду. ** p <0.005; *** p <0,005.
P62 Опосредует метастатический потенциал клеток B16F1, усиленный пассивной системной анафилаксией
P62 может способствовать росту опухолевых клеток и метастазированию Twist1-зависимым образом (27). PSA увеличивал метастатический потенциал клеток B16F1 (фиг. 4A) и увеличивал активность β-гексозаминидазы p62-зависимым образом (фиг. 4B). Подавление p62 предотвращает повышение уровня аутофагического потока ПСА и появление признаков аллергического воспаления. Это также препятствовало тому, чтобы PSA индуцировал взаимодействия FcεRIβ с HDAC3, Lyn и SOCS1 (рис. 4C).Иммуногистохимическое окрашивание показало повышенный уровень экспрессии p62 с помощью PSA (фиг. 4D). Таким образом, p62 может опосредовать повышенный метастатический потенциал раковых клеток за счет аллергического воспаления.
Рисунок 4 . P62 опосредует метастатический потенциал клеток B16F1, усиленный пассивной системной анафилаксией. (A) Каждая мышь получала инъекцию клеток меланомы B16F1 (2 × 10 5 ) на день 3. Определяли степень метастазирования в легкие. Также было проведено окрашивание H&E.Каждая экспериментальная группа состояла из четырех мышей BALB / C. (B, C) Лизаты ткани опухоли легкого подвергали анализу активности β-гексозаминидазы, анализу qRT-PCR, иммуноблоттингу и иммунопреципитации. (D) Осуществляли иммуногистохимическое окрашивание ткани опухоли легкого с использованием антитела p62. * p <0,05; ** p <0,005; *** p <0,005.
P62 Опосредует клеточные взаимодействия при аллергическом воспалении
Известно, что канцерогенные и метастатические потенциалы раковых клеток, усиленные аллергическим воспалением, обусловлены взаимодействием между раковыми клетками и иммунными клетками, такими как тучные клетки и макрофаги (11, 25, 26).Антиген увеличивал уровни экспрессии HDAC3 и TGaseII в клетках RBL2h4 p62-зависимым образом (рис. 5A). Когда культуральная среда стимулированных антигеном клеток RBL2h4 была добавлена к клеткам B16F1, она увеличивала инвазию (фиг. 5B), потенциал миграции (фиг. 5C) и уровень экспрессии HDAC3 (фиг. 5D) в зависимости от p62. Когда культуральная среда антиген-стимулированных тучных клеток легких была добавлена к клеткам B16F1, это увеличивало уровни экспрессии признаков аллергических воспалений, таких как MCP1, COX2, HDAC3 и SOCS1, в зависимости от p62 (рис. 5E).Клетки B16F10 показали более высокий уровень аутофагического потока, чем клетки B16F1 (Рисунок 5F). Подавление p62 снижает аутофагический поток и признаки аллергического воспаления в клетках B16F10 (рис. 5F). Когда культуральная среда клеток B16F10 добавлялась к клеткам RBL2h4, это усиливало признаки аллергического воспаления и аутофагического потока. Он также индуцировал взаимодействия FcεRIß с HDAC3, Lyn и SOCS1 p62-зависимым образом (рис. 5G). Когда культуральная среда клеток B16F10 была добавлена к макрофагам легких, это усиливало признаки аллергического воспаления и аутофагического потока зависимым от p62 образом (рисунок S3A).Когда культуральная среда клеток B16F10 (фигура S3B) или клеток RBL2h4 (фигура S3D) была добавлена к макрофагам легких, она увеличивала уровень экспрессии CD163, но снижала уровень экспрессии iNOS зависимым от p62 образом. Когда культуральная среда клеток RBL2h4 была добавлена к макрофагам легких, это усилило признаки аллергического воспаления, аутофагического потока и CD163, но снизило уровень экспрессии iNOS в зависимости от p62 (рисунок S3C). Таким образом, p62 может опосредовать клеточные взаимодействия во время аллергического воспаления.
Рисунок 5 . P62 опосредует клеточные взаимодействия во время аллергического воспаления. (A) Иммуноблоттинг. (B – D) Через один час после стимуляции DNP-HSA культуральную среду добавляли к клеткам B16F1 и инкубировали в течение 8 часов с последующей миграцией, анализами инвазии и иммуноблоттингом. СМ. обозначает питательную среду. (E) То же, что и (D) , за исключением того, что использовали культуральную среду тучных клеток легких. (F) Лизаты клеток указанных клеток подвергали иммуноблоту (верхняя панель).Через 48 ч после трансфекции указанной миРНК проводили иммуноблоттинг (нижняя панель). (G) Через 48 часов после трансфекции указанной миРНК культуральную среду клеток B16F10 добавляли к клеткам RBL2h4 и инкубировали в течение 8 часов с последующим иммуноблоттингом и иммунопреципитацией. ** p <0,005; *** p <0,005.
МиР-135-5п Прямая цель с.62
АнализTargetScan предсказал связывание miR-135-5p с 3′-UTR p62 (фигура 6A). 3′-UTR p62 дикого типа и мутантная 3′-UTR проявляли люциферазную активность, когда их трансфицировали в клетки RBL2h4 (фиг. 6B).Антиген увеличивал активность люциферазы, связанную с диким типом и мутантной 3′-UTR p62 (фиг. 6B). MiR-135-5p имитирует снижение активности люциферазы, связанной с Luc-3′-UTR дикого типа p62, но не активности люциферазы, связанной с Luc-3′-мутантной UTR p62 в антиген-стимулированных клетках RBL2h4 (фиг. 6B). Таким образом, miR-135-5p может напрямую регулировать уровень экспрессии p62.
Рисунок 6 . miR-135-5p непосредственно нацелен на p62. (A) Возможное связывание miR-135-5p с 3′-UTR p62. (B) Luc-p62-3′-UTR дикого типа или мутантный Luc-p62-3′-UTR трансфицировали вместе с контрольным миметиком или миметиком miR-135-5p (каждый по 10 нМ) в указанную линию клеток. Через 48 ч после трансфекции проводили анализ активности люциферазы. * p <0,05; ** p <0,005; *** p <0,005.
Миметик MiR-135-5p подавляет аллергическое воспаление
in vitro и in vivo МиметикMiR-135-5p предотвращал усиление антигеном признаков аллергического воспаления и аутофагического потока.Он также препятствовал тому, чтобы антиген индуцировал взаимодействия FcεRIß с HDAC3, Lyn и SOCS1 в клетках RBL2h4 (фиг. 7A). Антиген снизил уровень экспрессии miR-135-5p в клетках RBL2h4 (фиг. 7B). Миметик MiR-135-5p не позволял антигену увеличивать активность ß-гексозаминидазы (рис. 7C). Это также препятствовало тому, чтобы культуральная среда стимулированных антигеном клеток RBL2h4 увеличивала миграцию (фигура 7D) и потенциал инвазии (фигура 7E) клеток B16F1. Миметик MiR-135-5p предотвращал усиление в культуральной среде стимулированных антигеном клеток RBL2h4 признаков аллергического воспаления и аутофагического потока в клетках B16F1 (фиг. 7F).Это препятствовало увеличению проницаемости сосудов антигеном (рис. 8А). Он также предотвращал увеличение антигеном активности ß-гексозаминидазы (фиг. 8B) и экспрессии p62 (фиг. 8B) в мышиной модели PCA. Миметик MiR-135-5p также предотвращал усиление аутофагического потока антигеном, признаки аллергического воспаления, а антиген индуцировал взаимодействия FcεRIß с HDAC3, Lyn и SOCS1 на мышиной модели PCA (фиг. 8C). Таким образом, миметик miR-135-5p может регулировать аллергическое воспаление как in vitro , так и in vivo .
Рисунок 7 . Миметик miR-135-5p подавляет аллергическое воспаление. (A) Клетки RBL2h4 трансфицировали контрольным миметиком (80 нМ) или миметиком miR-135-5p в указанной концентрации. На следующий день клетки сенсибилизировали IgE в течение 24 часов, стимулировали DNP-HSA в течение 1 часа и подвергали иммуноблоту. Для иммунопреципитации клетки RBL2h4 трансфицировали контрольным миметиком (80 нМ) или миметиком miR-135-5p (20 нМ). (B) То же, что (A) , за исключением того, что был проведен анализ qRT-PCR. (C) То же, что (A) , за исключением того, что были выполнены анализы активности ß-гексозаминидазы. Клетки (D, E) RBL2h4 трансфицировали указанным миметиком (каждая при 20 нМ). На следующий день клетки сенсибилизировали IgE в течение 24 часов с последующей стимуляцией DNP-HSA в течение 1 часа. Культуральную среду получали и добавляли к клеткам B16F1 и инкубировали в течение 8 часов с последующими анализами миграции или потенциала инвазии. (F) То же, что и (E) , за исключением того, что был проведен иммуноблоттинг.** p <0,005; *** p <0,005.
Рисунок 8 . Миметик miR-135-5p подавляет пассивную кожную анафилаксию. Мышам (A) BALB / C вводили внутрикожную инъекцию антитела IgE (0,5 мкг / кг) или IgG (0,5 мкг / кг) вместе с указанным имитатором (каждое в концентрации 100 нМ). На следующий день мышам BALB / C внутривенно вводили PBS или DNP-HSA (250 мкг / кг) вместе с 2% (об. / Об.) Раствором Эванса синего. Через час после инъекции определяли степень проницаемости сосудов.Каждая экспериментальная группа состояла из четырех мышей BALB / C. Средние ± S.E. изображены три независимых эксперимента. (B, C) Лизат ткани уха мышей BALB / C каждой экспериментальной группы подвергали анализу активности β-гексозаминидазы, анализу qRT-PCR, иммуноблоттингу и иммунопреципитации. * p <0,05; ** p <0,005; *** p <0,005.
Миметик MiR-135-5p подавляет метастатический и опухолевый потенциал клеток меланомы B16F1 с повышенным уровнем аллергического воспаления
МиметикMiR-135-5p не позволял ПСА увеличивать метастатический потенциал клеток меланомы B16F1 (рис. 9).Он также предотвращал увеличение антигеном активности β-гексозаминидазы, количества высвобожденного гистамина и уровня PGE2 у мышей BALB / C (рис. 9B). Известно, что PGE2 способствует развитию астмы, способствуя выработке IgE (28). Миметик MiR-135-5p предотвращал усиление антигеном признаков аллергического воспаления и аутофагического потока. Он также препятствовал тому, чтобы антиген индуцировал взаимодействия FcεRIβ с HDAC3 и Lyn (фиг. 9C). Иммуногистохимическое окрашивание показало, что миметик miR-135-5p не позволяет антигену повышать уровень экспрессии p62 (фиг. 9D).Миметик MiR-135-5p не позволял PSA увеличивать канцерогенный потенциал клеток меланомы B16F1 (фиг. 10A). Миметик MiR-135-5p предотвращал усиление антигеном признаков аллергического воспаления и аутофагического потока. Он предотвращал индукцию антигеном взаимодействий FcεRIβ с HDAC3 и Lyn в опухолевых тканях (фиг. 10B). Это также препятствовало увеличению антигеном активности β-гексозаминидазы, количества высвобожденного гистамина и уровня PGE2 (рис. 10C). Таким образом, миметик miR-135-5p может ингибировать усиленный аллергическим воспалением метастатический потенциал и канцерогенный потенциал клеток меланомы B16F1.
Рисунок 9 . Миметик MiR-135-5p подавляет метастатический потенциал клеток меланомы B16F1, вызванный пассивной системной анафилаксией (PSA). (A) Индукция пассивной системной анафилаксии выполнялась, как описано. Каждая мышь получала внутривенную инъекцию клеток меланомы B16F1 (2 × 10 5 ) на 3 день и внутривенную инъекцию миметика miR-135-5p (100 нМ) в указанный день. Каждая экспериментальная группа состояла из четырех мышей BALB / C. (B, C) Лизаты опухолевой ткани подвергали анализу активности β-гексозаминидазы, иммуноблоту и иммунопреципитации.Сыворотки мышей BALB / C использовали для определения уровней высвобожденного гистамина и PGE2. (D) Иммуногистохимическое окрашивание. * p <0,05; ** p <0,005; *** p <0,005.
Рисунок 10 . Миметик miR-135-5p ингибирует повышенный канцерогенный потенциал клеток меланомы B16F1, индуцированный пассивной системной анафилаксией. (A) Каждая мышь получала внутривенную инъекцию клеток меланомы B16F1 (2 × 10 5 ) на 3 день и внутривенную инъекцию контрольного миметика или миметика miR-135-5p (каждая в концентрации 100 нМ) в указанный день.Каждая экспериментальная группа состояла из четырех мышей BALB / C. (B, C) Лизаты опухолевой ткани подвергали иммуноблоттингу, иммунопреципитации и анализам активности β-гексозаминидазы. Сыворотки использовали для определения уровней высвобожденного гистамина и PGE2. *** р <0,0005.
Внеклеточные везикулы необходимы для клеточного взаимодействия во время аллергического воспаления
Внеклеточные везикулы клеток множественной миеломы (MM) могут стимулировать секрецию цитокинов, таких как CXCL1, MCP1, IL6, IL-, IP-10 и CCL5, в мезенхимальных стромальных клетках (MSC), способствуя росту и миграции MM-клеток (29) .GW4869, ингибитор образования внеклеточных пузырьков, уменьшал признаки аллергического воспаления и аутофагического потока. Он также ингибировал взаимодействия FcεRIβ с HDAC3 и Lyn в антиген-стимулированных клетках RBL2h4 (фиг. 11A). Это предотвратило повышение активности β-гексозаминидазы антигеном (рис. 11В). GW4869 не позволял культуральной среде стимулированных антигеном клеток RBL2h4 усиливать признаки аллергического воспаления и аутофагического потока (фиг. 11C) или повышать потенциал миграции и инвазии клеток B16F1 (фиг. 11D).GW4869 не позволял культуральной среде стимулированных антигеном клеток RBL2h4 регулировать уровни экспрессии CD163 и iNOS, признаки аллергического воспаления и аутофагический поток в макрофагах легких (фигура 11E). GW4869 препятствовал тому, чтобы антиген индуцировал уровень экспрессии p62 во внеклеточных везикулах клеток RBL2h4 (фиг. 11F). MiR-135-5p имитирует снижение уровня экспрессии внеклеточного везикулярного p62 в антиген-стимулированных клетках RBL2h4 (фиг. 11G). Когда культуральная среда стимулированных антигеном клеток RBL2h4 добавлялась к макрофагам легких, она увеличивала уровень экспрессии CD163, но снижала уровень экспрессии iNOS в отсутствие GW4869 (фигура S4A).Фракция гранул ростовой среды клеток RBL2h4 показала внеклеточные везикулы (рисунок S4B). Таким образом, внеклеточные везикулы могут опосредовать клеточные взаимодействия во время аллергического воспаления.
Рисунок 11 . Внеклеточные везикулы необходимы для клеточного взаимодействия при аллергическом воспалении. (A, B) IgE-сенсибилизированные клетки RBL2h4 обрабатывали без или с GW4869 (10 мкМ) в течение 24 часов с последующей стимуляцией DNP-HSA в течение 1 часа. Были выполнены иммуноблоттинг, иммунопреципитация и анализы активности ß-гексозаминидазы. (C) Культуральную среду клеток RBL2h4 добавляли к клеткам B16F1 и инкубировали в течение 8 часов с последующим иммуноблоттингом. (D) То же, что и (C) , за исключением того, что определялись потенциалы миграции и инвазии клеток B16F1. (E) То же, что и (C) , за исключением того, что культуральная среда была добавлена к макрофагам легких. (F) Внеклеточные везикулы, выделенные из стимулированных антигеном клеток RBL2h4 без обработки G4869 или после нее, подвергали иммуноблоту. Клетки (G) RBL2h4 трансфицировали указанным миметиком (каждая при 20 нМ).На следующий день клетки сенсибилизировали IgE в течение 24 часов с последующей стимуляцией DNP-HSA. Внеклеточные везикулы выделяли и подвергали иммуноблоттингу. *** р <0,0005.
Внеклеточные везикулы необходимы для анафилаксии
GW4869 предотвращал снижение ректальной температуры антигеном (рисунок S5A). Это также препятствовало увеличению антигеном активности ß-гексозаминидазы, количества высвобожденного гистамина и уровня PGE2 на мышиной модели PSA (рисунок S5B).GW4869 предотвращал усиление антигеном признаков аллергического воспаления и аутофагического потока. Это также препятствовало тому, чтобы антиген индуцировал взаимодействия FcεRIß с HDAC3, Lyn и SOCS1 (рисунок S5C). GW4869 предотвращал увеличение антигеном уровней экспрессии G-CSF и MCP1 в сыворотке BALB / C мышиной модели PSA (фигура S5D). GW4869 предотвращал увеличение антигеном проницаемости сосудов (рисунок S6A), аутофагический поток и признаки аллергического воспаления (рисунок S6B). Он также препятствовал тому, чтобы антиген индуцировал взаимодействия FcεRIß с HDAC3, SOCS1 и Lyn (фигура S6B) в мышиной модели PCA.GW4869 также препятствовал увеличению активности ß-гексозаминидазы антигеном (рис. S6C). Таким образом, внеклеточные везикулы могут опосредовать анафилаксию in vivo .
Внеклеточные везикулы содержат p62, челнок между клетками и вызывают признаки аллергического воспаления
Затем мы исследовали, существует ли p62 во внеклеточных везикулах, с помощью электронной микроскопии с окрашиванием иммунным золотом. Антитело p62, конъюгированное с иммуноголотом, использовали для определения местоположения P62 в изолированных везикулах, и P62 был обнаружен в просвете везикулы, тогда как CD63, известный мембранный маркер внеклеточных везикул, был обнаружен на внешней мембране везикул ( Рисунок 12A).Это наблюдение было подтверждено коиммунным окрашиванием золотом p62 (как показано золотом размером 10 нм, расположенным во внутренней части везикул) и CD63 (как показано золотом размером 25 нм, расположенным на внешней мембране везикул). Визуализированные внеклеточные везикулы при отрицательном окрашивании под электронной микроскопией продемонстрировали существование везикул в клетках RBL2h4 независимо от стимуляции антигеном (фиг. 12B).
Рисунок 12 . P62 присутствует во внеклеточных везикулах стимулированных антигеном клеток RBL2h4. (A) Общий вид изолированных внеклеточных везикул и изображения окрашивания иммуно-золотом с использованием анти-CD63, известного мембранного маркера внеклеточных везикул, и антител против p62. Золотые частицы размером 25 и 10 нм указывают на локализацию CD63 (внешняя мембрана везикул) и p62 соответственно. Обратите внимание, что p62, как показано, располагается в просвете пузырьков. (B) Внеклеточные везикулы, выделенные из нестимулированных клеток RBL2h4 или антиген-стимулированных клеток RBL2h4, визуализировали с помощью электронной микроскопии с отрицательным окрашиванием.Масштабные линейки 100 и 200 нм, примененные к монтажам (A), и полям (B) , соответственно.
меченных PKH67 внеклеточных везикул добавляли к клеткам RBL2h4, чтобы проверить, могут ли внеклеточные везикулы перемещаться между клетками. Зеленая флуоресценция наблюдалась в клетках RBL2h4, которые поглощали меченные PKH67 внеклеточные везикулы нестимулированных клеток RBL2h4 и стимулированные антигеном клетки RBL2h4 (фигура S7A). Однако флуоресценция не наблюдалась в клетках RBL2h4, которые поглощали немеченые внеклеточные везикулы стимулированных антигеном клеток RBL2h4 (фигура S7A).Внеклеточные везикулы стимулированных антигеном клеток RBL2h4 увеличивают уровни высвобожденного гистамина и PGE2 в клетках RBL2h4 (рисунок S7B). Таким образом, внеклеточные везикулы могут перемещаться между клетками и вызывать признаки аллергического воспаления.
Внеклеточные пузырьки способствуют развитию признаков аллергического воспаления р62-зависимым образом
Результаты с использованием GW4869, ингибитора образования внеклеточных везикул, показали, что внеклеточные везикулы играют роль в анафилаксии (рис. S5A).Таким образом, было исследовано прямое влияние внеклеточных везикул на аллергическое воспаление. Маркеры внеклеточных везикул, такие как CD63, TSG101 и CD81, были обнаружены во фракции осадка ростовой среды, но не во фракции супернатанта ростовой среды клеток RBL2h4 (фиг. 13A). P62 также присутствовал во фракции осадка ростовой среды, но не во фракции супернатанта ростовой среды антиген-стимулированных клеток RBL2h4 (фиг. 13A). Внеклеточные везикулы, выделенные из антиген-стимулированных клеток RBL2h4, усиливали признаки аллергического воспаления и аутофагического потока.Они также индуцировали взаимодействия FcεRIß с HDAC3 и Lyn в нестимулированных клетках RBL2h4 (фиг. 13B). Внеклеточные везикулы, выделенные из антиген-стимулированных клеток RBL2h4, увеличивали CD163 и признаки аллергического воспаления и аутофагического потока, но снижали экспрессию iNOS в макрофагах (фиг. 13C). Внеклеточные везикулы, выделенные из антиген-стимулированных клеток RBL2h4, увеличивали экспрессию p62, признаки аллергического воспаления и аутофагический поток в клетках B16F1 (фиг. 13D). Они также увеличивали возможности миграции и инвазии клеток B16F1 (рис. 13E).Внеклеточные везикулы стимулированных антигеном клеток RBL2h4 содержали p62 (фигура S8A). Они увеличили аутофагический поток и CD163, но снизили экспрессию iNOS p62-зависимым образом в макрофагах легких (Рисунок S8B). Внеклеточные везикулы стимулированных антигеном клеток RBL2h4 увеличивают аутофагический поток в клетках RBL2h4 (рисунок S8C). Они также индуцировали взаимодействия FcεRIß с HDAC3 и Lyn p62-зависимым образом (рисунок S8C). Внеклеточные везикулы стимулированных антигеном клеток RBL2h4 также увеличивали уровни высвобожденного гистамина и PGE2 в клетках RBL2h4 в зависимости от p62 (фигура S8D).Внеклеточные везикулы стимулированных антигеном клеток RBL2h4 увеличивали аутофагический поток (рисунок S8E) и увеличивали возможности миграции и инвазии клеток B16F1 в зависимости от p62 (рисунок S8F). Влияние p62 на клеточные взаимодействия, опосредованные внеклеточными везикулами, было дополнительно исследовано. Для этого мы использовали внеклеточные везикулы, выделенные из сыворотки PSA-активированных мышей BALB / C (рисунок S9A). Внеклеточные везикулы, выделенные из сыворотки активированных PSA мышей BALB / C, показали экспрессию p62 (фигура S9B).Сыворотка каждой мыши из каждой экспериментальной группы в мышиной модели PSA показала внеклеточные везикулы (рисунок S9C). Внеклеточные везикулы увеличивают аутофагический поток и признаки аллергического воспаления (Рисунок S9D) и индуцируют взаимодействия FcεRIß с HDAC3, Lyn и SOCS1 в нестимулированных клетках RBL2h4 (Рисунок S9E). Они также увеличивали возможности миграции и инвазии клеток B16F1 зависимым от p62 образом (рисунок S9F). Таким образом, p62 необходим для клеточных взаимодействий, опосредованных внеклеточными пузырьками, во время аллергического воспаления.
Рисунок 13 . Внеклеточные пузырьки способствуют развитию признаков аллергического воспаления . (A) Внеклеточные везикулы выделяли из ростовой среды клеток RBL2h4 без или со стимуляцией антигеном в течение 1 часа. Внеклеточные везикулярные белки подвергали иммуноблоту. Е.В. обозначает внеклеточные везикулы. (B, C) Внеклеточные везикулы (20 мкг), выделенные из клеток RBL2h4 без или со стимуляцией антигеном в течение 1 часа, добавляли к клеткам RBL2h4 или макрофагам легких и инкубировали в течение 24 часов с последующим иммуноблоттингом и иммунопреципитацией.Отсутствие внеклеточных везикул означает иммуноблоттинг и иммунопреципитацию клеток RBL2h4. (D) То же, что (B) , за исключением того, что внеклеточные везикулы были добавлены к клеткам B16F1. Отсутствие внеклеточных везикул означает иммуноблот клеток B16F1 без обработки внеклеточных везикул. (E) То же, что и (D) , за исключением того, что были выполнены анализы миграции и потенциала инвазии. Отсутствие внеклеточных везикул указывает на возможность миграции или инвазии клеток B16F1 без обработки внеклеточных везикул.*** р <0,0005.
Обсуждение
Аутофагия нейтрофилов усиливает тяжесть астмы, повреждая эпителий дыхательных путей и вызывая воспалительные реакции (30). TLR2 играет ключевую роль в аллергическом воспалении дыхательных путей посредством регуляции аутофагии, связанной с сигнальным путем PI3K / Akt (31). Положительная корреляция между паттернами экспрессии генов ATG5 и COL5A1 предполагает, что нарушение регуляции аутофагии может способствовать субэпителиальному фиброзу дыхательных путей у рефрактерных астматиков (32).Экспрессия беклина-1 повышалась в дыхательных путях пациентов с астмой и мышей, зараженных OVA, что сопровождалось EMT дыхательных путей и ремоделированием (33). Больше аутофагосом обнаружено у пациентов с астмой и у мышей, зараженных OVA, по сравнению со здоровыми контрольными животными (33). Аутофагия тесно связана с тяжестью астмы из-за эозинофильного воспаления (34). Эти отчеты предполагают тесную связь между аутофагией и аллергическим воспалением.
p62 был увеличен во время аллергического воспаления (рис. 1A).Он регулировал признаки аллергического воспаления и аутофагического потока (рис. 1В). Мы также показали, что аллергическое воспаление сопровождалось усиленным образованием аутофагосом (Рисунок S1). В будущих исследованиях будет интересно изучить влияние p62 на образование аутофагосом во время аллергического воспаления. Также будет необходимо идентифицировать молекулу, регулируемую p62. 3-МА, ингибитор аутофагии, предотвращал увеличение экспрессии антигена p62 и признаков аллергического воспаления в клетках RBL2h4 (рисунок S2A).3-МА также отрицательно регулируется PCA (рисунок S2D). Это указывает на роль аутофагии в аллергическом воспалении. О роли аутофагии в анафилаксии еще не сообщалось.
Стимуляция антигена увеличивала экспрессию HDAC3 в клетках RBL2h4 (рис. 1А). Сообщалось о роли HDAC3 в аллергическом воспалении (11, 26). MiR-384 и HDAC3 могут образовывать петлю отрицательной обратной связи для регулирования аллергического воспаления и клеточных взаимодействий во время аллергического воспаления (26). MiR-384, негативный регулятор HDAC3, может снижать усиление Beclin1-зависимой аутофагии гладкомышечных клеток дыхательных путей (35).Hdac3-дефицитные клетки iNKT показали меньшее окрашивание Cyto-ID и более низкую экспрессию LC3A / B, что указывает на снижение аутофагии (36). HDAC3 может регулировать аутофагический поток во время аллергического воспаления. Необходимы дальнейшие исследования для идентификации miRNA, которые регулируют экспрессию HDAC3 во время аллергического воспаления.
Известно, чтоCOX2 является геном, связанным с астмой (37). Аллергическое воспаление увеличивает экспрессию COX2 в клетках RBL2h4 (рисунок S2E). COX2 и miR-26 могут образовывать петлю отрицательной обратной связи и регулировать аллергическое воспаление и клеточные взаимодействия во время аллергического воспаления (18).Сверхэкспрессия COX2, индуцированная путем стресса ATF4 ER, способствует аутофагии и повреждению почек, вызванным волчаночным нефритом (38). Вероятно, что ось miR-26 / COX2 может регулировать аутофагический поток во время аллергического воспаления.
АнализTargetScan предсказал связывание miR-181a / -218 / -122a с 3’UTR p62 (личное наблюдение). MiR-181a / -218 может образовывать петлю отрицательной обратной связи с TGaseII и регулировать аллергическое воспаление (25). Аллергическое воспаление увеличивало экспрессию TGaseII в клетках RBL2h4 (рис. 1А).В условиях стресса TGaseII опосредует усиленную аутофагию, способствуя развитию лимфомы из клеток мантии (MCL) (39). Продукт аутофагии ATG5, участвующий в удлинении аутофагосом, может положительно регулировать передачу сигналов TGase II / NF-κB / IL6 (39). Миметик MiR-181a предотвращал повышение уровня экспрессии антигена TGaseII и p62 в клетках RBL2h4, в то время как ингибитор miR-181a увеличивал уровни экспрессии TGaseII и p62 антиген-независимым образом в клетках RBL2h4 (личные наблюдения). В будущем будет необходимо идентифицировать miRNA, которые могут регулировать экспрессию TGaseII.
Сообщалось о повышенном уровне CXCL1 на мышиной модели аллергического ринита (40). Аллергическое воспаление увеличивало экспрессию CXCL1 в клетках RBL2h4 (рис. 7A). Миметик MiR-135-5p не позволял антигену увеличивать экспрессию CXCL1 в клетках RBL2h4 (фиг. 7A). Нейтрофильное воспаление, характерное для аллергической астмы, опосредуется CXCR2, рецептором CXCL1 (41). CXCR2 может усиливать нейтрофильное воспаление и усиливать индуцированную IL-33 гиперчувствительность дыхательных путей (41). Нейтрофильная астма у мышей STAT6 – / – , устойчивых к стероидам, сопровождается повышенными уровнями в легких TNF-α, CXCL1, CXCL2 и CXCL5 (42).CXCL1, происходящий из тучных клеток, опосредует протуморигенную роль тучных клеток (43). Вероятно, что CXCL1 может опосредовать клеточные взаимодействия во время аллергического воспаления. Было бы интересно изучить сигнальные пути оси CXCL1-CXCR2 для лучшего понимания вызываемого p62 аллергического воспаления. Также важно идентифицировать цитокины / миРНК, которые могут служить мишенями для CXCL1.
Интравитреальное применение miR-135 облегчает регенерацию аксонов ганглиозных клеток сетчатки (RGC) после повреждения зрительного нерва у взрослых мышей частично за счет репрессии KLF4 (44).Отсутствие экспрессии Kruppel-подобного фактора 4 (KLF4) в моноцитах и эпителиальных клетках легких снижает цитокины Th3 у мышей и снижает гиперчувствительность дыхательных путей (AHR) (45). Эндогенный KLF4 может связываться с промоторными областями гена p62, в то время как повышающая регуляция KLF4 индуцирует экспрессию p62 (46). Таким образом, KLF4 может опосредовать аллергическое воспаление как in vitro , так и in vivo в ассоциации с аутофагическими процессами, регулируя уровень экспрессии p62. Анализ TargetScan предсказал, что miR-135-5p является отрицательным регулятором p62 (т.е.е. miR-135-5p непосредственно регулирует экспрессию p62) (фиг. 6). Миметик MiR-135-5p играл отрицательную регулирующую роль в in vitro аллергическом воспалении (Фигуры 7A, C). MiR-135-5p имитирует негативно регулируемые клеточные взаимодействия во время аллергического воспаления (рисунки 7D, F). Будет необходимо идентифицировать цитокины, которые регулируются миметиком miR-135-5p. Эти цитокины могут опосредовать клеточные взаимодействия во время аллергического воспаления. Миметик MiR-135-5p может ингибировать PCA (Рисунки 8A, C). MiR-135 имитирует отрицательно регулируемый метастатический потенциал раковых клеток, усиленный PSA (Фигуры 9A, B).
MiR-135-5p нацелен на Smad5, ключевой преобразователь остеогенного сигнала BMP2, и ингибирует дифференцировку остеопрогениторов (47). BMP2 участвует в аллергическом воспалении дыхательных путей, вызванном клещом домашней пыли (48). Гистамин, полученный из тучных клеток, индуцирует экспрессию BMP-2 в эндотелиальных клетках коронарных артерий человека (49). Таким образом, BMP2 может действовать как мишень для miR-135-5p и опосредовать анафилаксию в сочетании с аутофагией.
Внеклеточные везикулы регулируют чувствительность к противораковым препаратам, способствуя аутофагии (50).Внеклеточные везикулы, полученные из мезенхимальных стволовых клеток пуповины (МСК) человека (hucMSC-Ex), могут способствовать аутофагии для предотвращения повреждения почек, вызванного цисплатином (51). Внеклеточные везикулы мезенхимальных стволовых клеток активируют регуляторные Т-клетки для подавления астмы (52). Эти сообщения предполагают, что внеклеточные везикулы играют роль в аллергическом воспалении. GW4869, ингибитор образования внеклеточных везикул, отрицательно регулирует PSA (Рисунок S5A) и PCA (Рисунок S6A). Таким образом, внеклеточные везикулы могут опосредовать анафилаксию.
Внеклеточные везикулы, выделенные из инфицированных макрофагов, могут стимулировать секрецию цитокинов, таких как RANTES, IL-1ra, MIP-2, CXCL1, MCP1, sICAM-1 и G-CSF (53). Таким образом, внеклеточные везикулы могут опосредовать клеточные взаимодействия во время аллергического воспаления. GW4869, ингибитор образования внеклеточных везикул, предотвращал усиление экспрессии антигена признаков аллергического воспаления и аутофагического потока в клетках RBL2h4 (фиг. 11A). GW4869 не позволял культуральной среде стимулированных антигеном клеток RBL2h4 увеличивать инвазионные и миграционные потенциалы клеток B16F1 (фиг. 11D).Эти результаты указывают на роль внеклеточных везикул в аллергическом воспалении.
GW4869 предотвращал повышение уровня экспрессии антигена MCP1 и CXCL1 в мышиной модели PSA (фигура S5C). GW4869 препятствовал тому, чтобы антиген стимулировал секрецию MCP1 в сыворотке PSA-активированной мыши BALB / C (фигура S5D). MCP1 в клетках B16F1 увеличивалось в культуральной среде антиген-стимулированных тучных клеток p62-зависимым образом (фиг. 5E). Таким образом, MCP1 и CXCL1 могут опосредовать клеточные взаимодействия во время аллергического воспаления.Во время аллергического воспаления необходимо будет изучить присутствие MCP1 и / или CXCL1 во внеклеточных везикулах активированных иммунных клеток, таких как тучные клетки и макрофаги. Мы показали присутствие p62 во внеклеточных везикулах стимулированных антигеном клеток RBL2h4 (Фигуры 12A, 13A). Внеклеточные везикулы стимулированных антигеном клеток RBL2h4 активировали макрофаги (фиг. 13C) и увеличили потенциал инвазии и миграции клеток B16F1 (фиг. 13D). Эти внеклеточные везикулы могут вызывать признаки аллергического воспаления антиген-независимым образом.Будет необходимо дополнительно идентифицировать miRNA и цитокины, присутствующие во внеклеточных везикулах антиген-стимулированных клеток RBL2h4. Также будет необходимо идентифицировать молекулы, регулируемые этими внеклеточными пузырьками.
Анализ массиваMiRNA проводили для идентификации miRNA, регулируемых p62. Наши результаты показали, что miR-154-5p и miR-31-5p были увеличены в клетках RBL2h4 за счет стимуляции антигеном p62-зависимым образом (личные наблюдения). Повышенный уровень экспрессии miR-154-5p также наблюдался во внеклеточных везикулах стимулированных антигеном клеток RBL2h4 (данные не показаны).Наши результаты показали, что miR-154-5p была необходима для аллергического воспаления как in vitro , так и in vivo (данные не показаны). Промоторные последовательности miR-154-5p и miR-31-5p содержат сайты связывания для HDAC2, SP1 и YY (личные наблюдения). Следовательно, SP1 и YY1 могут напрямую увеличивать уровни экспрессии miR-154-5p и miR-31-5p. Анализ TargetScan предсказал связывание miR-154-5p с 3′-UTR SOCS5 и связывание miR-31-5p с 3′-UTR реагирующего на окислительный стресс-1 (Oxsr-1).SOCS5 может снижать фосфорилирование JAK2 (54). JAK2 необходим при аллергическом воспалении (21). Следовательно, SOCS5 может быть негативным регулятором аллергического воспаления. MiR-31-5p является кандидатом в главный регулятор генов, связанных с рекрутированием нейтрофилов. Он нацелен на Oxsr-1 (55). Было бы интересно изучить, будет ли Oxsr-1 негативным регулятором аллергического воспаления в будущем.
Таким образом, мы показали новую роль оси miR-135-5p-p62 в аллергическом воспалении в сочетании с аутофагическим потоком.Было бы необходимо дополнительно идентифицировать внеклеточные везикулярные цитокины и миРНК, чтобы лучше понять p62-опосредованное аллергическое воспаление и клеточные взаимодействия во время аллергического воспаления.
Авторские взносы
DJ задумал исследование, участвовал в разработке эксперимента и написал статью. МК провел эксперименты in vitro и in vivo . YP, YKw и YKi предоставили экспериментальных данных in vivo и экспериментальных данных. JM внес свой вклад в электронно-микроскопические наблюдения аутофагосом.HJ, H-UK и MJ внесли свой вклад в выделение внеклеточных везикул и электронно-микроскопические наблюдения внеклеточных везикул. JB внесла люциферазные конструкции.
Финансирование
Работа поддержана грантами Национального исследовательского фонда (2017R1A2A2A05001029, 2017M3A9G7072417 и 2018R1D1A1B07043498), грантом программы BK21 plus. Это исследование было поддержано исследовательским грантом 2018 г. (PoINT) Национального университета Кангвон. Это исследование было поддержано программой фундаментальных исследований KBRI через Корейский институт исследования мозга, финансируемой Министерством науки и ИКТ (19-BR-01-08 to JM).
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Дополнительные материалы
Дополнительные материалы к этой статье можно найти в Интернете по адресу: https://www.frontiersin.org/articles/10.3389/fimmu.2019.00738/full#supplementary-material
Список литературы
1. Чой ГЭ, Юн Си, Ким Джи, Кан ДЙ, Джанг Йи, Ким Х.S. Дефицит аутофагии в миелоидных клетках усугубляет эозинофильное воспаление при хроническом риносинусите. J Allergy Clin Immunol. (2018) 141: 938–50.e912. DOI: 10.1016 / j.jaci.2017.10.038
PubMed Аннотация | CrossRef Полный текст | Google Scholar
2. Ли П.П., Лобато-Маркес Д., Праманик Н., Сирианни А., Даза-Кахигал В., Риверс Э. и др. Белок синдрома Вискотта-Олдрича регулирует аутофагию и активность инфламмасом в клетках врожденного иммунитета. Nat Commun. (2017) 8: 1576.DOI: 10.1038 / s41467-017-01676-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
3. Накано Х., Ушио Х. Неожиданная роль аутофагии в дегрануляции тучных клеток. Аутофагия. (2011) 7: 657–9.
PubMed Аннотация | Google Scholar
4. Ушио Х., Уэно Т., Кодзима Ю., Комацу М., Танака С., Ямамото А. и др. Решающая роль аутофагии в дегрануляции тучных клеток. J Allergy Clin Immunol. (2011) 127: 1267–76.e1266.DOI: 10.1016 / j.jaci.2010.12.1078
PubMed Аннотация | CrossRef Полный текст | Google Scholar
5. Янь Х., Чжан Х, Ху В., Ма Дж., Хоу В., Чжан Х и др. Гистаминовые рецепторы h4 усугубляют ишемическое повреждение головного мозга за счет гистамин-независимых механизмов. Nat Commun. (2014) 5: 3334. DOI: 10.1038 / ncomms4334
PubMed Аннотация | CrossRef Полный текст | Google Scholar
6. Ся Ф, Дэн Ц., Цзян И, Цюй Й, Дэн Дж, Цай Зи и др. IL4 (интерлейкин 4) вызывает аутофагию в B-клетках, что приводит к обострению астмы. Аутофагия. (2018) 14: 450–64. DOI: 10.1080 / 15548627.2017.1421884
PubMed Аннотация | CrossRef Полный текст | Google Scholar
7. Fang YT, Wan SW, Lu YT, Yao JH, Lin CF, Hsu LJ, et al. Аутофагия способствует усиленной антителами инфекции вируса денге в предбазофильных / тучных клетках человека. PLoS ONE. (2014) 9: e110655. DOI: 10.1371 / journal.pone.0110655
PubMed Аннотация | CrossRef Полный текст | Google Scholar
8. Sinclair C, Bommakanti G.mTOR регулирует метаболическую адаптацию APC в легких и контролирует исход аллергического воспаления. PLoS ONE. (2017) 357: 1014–21. DOI: 10.1126 / science.aaj2155
PubMed Аннотация | CrossRef Полный текст | Google Scholar
9. Цой Й.Х., Джин Г.Й., Ли Л.К., Янь Г.Х. Ингибирование протеинкиназы C-дельта ослабляет аллергическое воспаление дыхательных путей за счет подавления пути PI3K / Akt / mTOR / HIF-1 alpha / VEGF. PLoS ONE. (2013) 8: e81773. DOI: 10,1371 / журнал.pone.0081773
PubMed Аннотация | CrossRef Полный текст | Google Scholar
10. Ким И, Эом С., Ким К., Ли Ю.С., Чхве Дж., Хан Дж. Х. и др. Трансглутаминаза II взаимодействует с rac1, регулирует выработку активных форм кислорода, экспрессию улитки, секрецию цитокинов Th3 и опосредует in vitro и in vivo аллергическое воспаление. Mol Immunol. (2010) 47: 1010–22. DOI: 10.1016 / j.molimm.2009.11.017
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11.Kim Y, Kim K, Park D, Lee E, Lee H, Lee YS и др. Гистондеацетилаза 3 опосредует аллергическое воспаление кожи, регулируя экспрессию белка MCP1. J Biol Chem. (2012) 287: 25844–59. DOI: 10.1074 / jbc.M112.348284
PubMed Аннотация | CrossRef Полный текст | Google Scholar
12. Дун Л. Х., Ченг С., Чжэн З., Ван Л., Шен Й, Шен З. X и др. Ингибитор гистондеацетилазы усиливал способность ингибитора MTOR вызывать гибель аутофагических клеток при лейкемии / лимфоме Беркитта. J Hematol Oncol. (2013) 6:53. DOI: 10.1186 / 1756-8722-6-53
PubMed Аннотация | CrossRef Полный текст | Google Scholar
13. Cha-Molstad H, Yu JE, Feng Z, Lee SH, Kim JG, Yang P, et al. p62 / SQSTM1 / Sequestosome-1 представляет собой N-распознающий путь правила N-конца, который модулирует биогенез аутофагосомы. Nat Commun. (2017) 8: 102. DOI: 10.1038 / s41467-017-00085-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
14. Ли Х.М., Шин Д.М., Юк Дж. М., Ши Г., Чой Д. К., Ли Ш. и др.Аутофагия негативно регулирует воспалительные реакции кератиноцитов через каркасный белок p62 / SQSTM1. J Immunol. (2011) 186: 1248–58. DOI: 10.4049 / jimmunol.1001954
PubMed Аннотация | CrossRef Полный текст | Google Scholar
15. Мартин П., Диаз-Меко М.Т., Москат Дж. Сигнальный адаптер p62 является важным медиатором функции Т-хелперных клеток 2 и аллергического воспаления дыхательных путей. EMBO J. (2006) 25: 3524–33. DOI: 10.1038 / sj.emboj.7601250
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16.Чжан Х, Джин Джи, Ву Дж, Цинь Х, Стрейлин Р., Холл Р.П. и др. RNA-Seq и ChIP-Seq показывают, что SQSTM1 / p62 является ключевым медиатором подавления JunB NF-kappaB-зависимого воспаления. J Invest Dermatol. (2015) 135: 1016–24. DOI: 10.1038 / jid.2014.519
PubMed Аннотация | CrossRef Полный текст | Google Scholar
17. Образец А, Чжао Б., Цян Л., Хэ Й. Адаптерный белок p62 способствует росту опухоли кожи и метастазированию и индуцируется УФА-излучением. J Biol Chem. (2017) 292: 14786–95.DOI: 10.1074 / jbc.M117.786160
PubMed Аннотация | CrossRef Полный текст | Google Scholar
18. Квон И, Ким И, Эом С., Ким М., Пак Д., Ким Х и др. Петля микроРНК-26a / -26b-COX-2-MIP-2 регулирует повышенный канцерогенный и метастатический потенциал раковых клеток, вызванный аллергическим воспалением и вызванным аллергическим воспалением. J Biol Chem. (2015) 290: 14245–66. DOI: 10.1074 / jbc.M115.645580
PubMed Аннотация | CrossRef Полный текст | Google Scholar
19. Кульшрешта А., Ахмад Т., Агравал А., Гош Б.Провоспалительная роль экзосом, происходящих из эпителиальных клеток, в аллергическом воспалении дыхательных путей. J Allergy Clin Immunol. (2013) 131: 1194–203, 1203.e1191-1114. DOI: 10.1016 / j.jaci.2012.12.1565
PubMed Аннотация | CrossRef Полный текст | Google Scholar
20. Бурдонне Э., Заслона З., Пенке Л. Р., Спет Дж. М., Шнайдер Д. Д., Пшибрановски С. и др. Трансклеточная доставка везикулярных белков SOCS от макрофагов к эпителиальным клеткам подавляет воспалительную передачу сигналов. J Exp Med. (2015) 212: 729–42. DOI: 10.1084 / jem.20141675
PubMed Аннотация | CrossRef Полный текст | Google Scholar
21. Но К., Ким М., Ким И, Ким Х, Ким Х, Бюн Дж и др. Ось miR-122-SOCS1-JAK2 регулирует клеточные взаимодействия, вызванные аллергическим воспалением и аллергическим воспалением. Oncotarget. (2017) 8: 63155–76. DOI: 10.18632 / oncotarget.19149
PubMed Аннотация | CrossRef Полный текст | Google Scholar
22. Хессвик Н.П., Овербай А., Брех А., Торгерсен М.Л., Якобсен И.С., Сандвиг К. и др.Ингибирование PIKfyve увеличивает высвобождение экзосом и индуцирует секреторную аутофагию. Cell Mol Life Sci. (2016) 73: 4717–37. DOI: 10.1007 / s00018-016-2309-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
23. Торрегроса Паредес П., Эссер Дж., Адмир С., Норд М., Рахман К.К., Лукич А. и др. Экзосомы жидкости бронхоальвеолярного лаважа способствуют выработке цитокинов и лейкотриенов при аллергической астме. Аллергия. (2012) 67: 911–9. DOI: 10.1111 / j.1398-9995.2012.02835.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
24. Гон Й, Маруока С., Иноуэ Т., Курода К., Ямагиши К., Козу Ю. и др. Избирательное высвобождение miRNA через внеклеточные везикулы связано с воспалением дыхательных путей, вызванным аллергеном клеща домашней пыли. Clin Exp Allergy. (2017) 47: 1586–98. DOI: 10.1111 / CEA.13016
PubMed Аннотация | CrossRef Полный текст | Google Scholar
25. Eom S, Kim Y, Kim M, Park D, Lee H, Lee YS и др.Петля трансглутаминаза II / микроРНК-218 / -181a регулирует положительную обратную связь между аллергическим воспалением и метастазированием опухоли. J Biol Chem. (2014) 289: 29483–505. DOI: 10.1074 / jbc.M114.603480
PubMed Аннотация | CrossRef Полный текст | Google Scholar
26. Eom S, Kim Y, Park D, Lee H, Lee YS, Choe J, et al. Гистоновая деацетилаза-3 опосредует положительную обратную связь между анафилаксией и метастазированием опухоли. J Biol Chem. (2014) 289: 12126–44.DOI: 10.1074 / jbc.M113.521245
PubMed Аннотация | CrossRef Полный текст | Google Scholar
27. Цян Л., Чжао Б., Мин М., Ван Н., Хэ Т.С., Хван С. и др. Регулирование пролиферации и миграции клеток с помощью p62 посредством стабилизации Twist1. Proc Natl Acad Sci USA. (2014) 111: 9241–6. DOI: 10.1073 / pnas.1322
1PubMed Аннотация | CrossRef Полный текст | Google Scholar
28. Гао Ю., Чжао Ц., Ван В., Цзинь Р., Ли К., Ге К. и др. Сигнал простагландинов E2, опосредованный рецептором подтипа EP2, способствует выработке IgE in vivo и способствует развитию астмы. Научный доклад (2016) 6: 20505. DOI: 10.1038 / srep20505
PubMed Аннотация | CrossRef Полный текст | Google Scholar
29. Де Вейрман К., Ван Дж., Сюй С., Лелеу Х, Химпе Е., Маес К. и др. Индукция miR-146a клетками множественной миеломы в мезенхимальных стромальных клетках стимулирует их проопухолевую активность. Cancer Lett. (2016) 377: 17–24. DOI: 10.1016 / j.canlet.2016.04.024
PubMed Аннотация | CrossRef Полный текст | Google Scholar
30. Pham DL, Ban GY, Kim SH, Shin YS, Ye YM, Chwae YJ, et al.Аутофагия нейтрофилов и ловушки внеклеточной ДНК способствуют воспалению дыхательных путей при тяжелой астме. Clin Exp Allergy. (2017) 47: 57–70. DOI: 10.1111 / cea.12859
PubMed Аннотация | CrossRef Полный текст | Google Scholar
31. Цзян X, Фанг Л., Ву Х, Мэй Х, Хе Ф, Дин П. и др. TLR2 регулирует аллергическое воспаление дыхательных путей и аутофагию через сигнальный путь PI3K / Akt. Воспаление. (2017) 40: 1382–92. DOI: 10.1007 / s10753-017-0581-x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
32.Пун А.Х., Чой Д.Ф., Чуиали Ф., Рамакришнан Р.К., Махбуб Б., Аудуссо С. и др. Повышенная экспрессия 5-гена, связанного с аутофагией, связана с экспрессией коллагена в дыхательных путях у рефрактерных астматиков. Front Immunol. (2017) 8: 355. DOI: 10.3389 / fimmu.2017.00355
PubMed Аннотация | CrossRef Полный текст | Google Scholar
33. Лю Т., Лю Й., Миллер М., Цао Л., Чжао Дж., Ву Дж. И др. Аутофагия играет роль в индуцированном FSTL1 эпителиально-мезенхимальном переходе и ремоделировании дыхательных путей при астме. Am J Physiol Lung Cell Mol Physiol. (2017) 313: L27–40. DOI: 10.1152 / ajplung.00510.2016
PubMed Аннотация | CrossRef Полный текст | Google Scholar
34. Лю Дж.Н., Сух Д.Х., Тринь Х.К., Чвае Й.Дж., Пак Х.С., Шин Ю.С. Роль аутофагии в аллергическом воспалении: новая мишень для тяжелой формы астмы. Exp Mol Med. (2016) 48: e243. DOI: 10.1038 / emm.2016.38
PubMed Аннотация | CrossRef Полный текст | Google Scholar
35. Cheng Z, Wang X, Dai L, Jia L, Jing X, Liu Y, et al.Подавление микроРНК-384 усиливает аутофагию гладкомышечных клеток дыхательных путей у мышей, страдающих астмой. Oncotarget. (2017) 8: 67933–41. DOI: 10.18632 / oncotarget.18913
PubMed Аннотация | CrossRef Полный текст | Google Scholar
36. Тапа П., Ромеро Ароча С., Чунг Дж. Й., Сант-Анджело Д. Б., Шапиро В. С. Гистоновая деацетилаза 3 необходима для развития клеток iNKT. Научный доклад (2017) 7: 5784. DOI: 10.1038 / s41598-017-06102-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
37.Jardim MJ, Dailey L, Silbajoris R, Diaz-Sanchez D. Отчетливая экспрессия микроРНК в клетках дыхательных путей человека астматических доноров позволяет идентифицировать новый ген, связанный с астмой. Am J Respir Cell Mol Biol. (2012) 47: 536–42. DOI: 10.1165 / rcmb.2011-0160OC
PubMed Аннотация | CrossRef Полный текст | Google Scholar
38. Jin J, Zhao L, Zou W, Shen W, Zhang H, He Q. Активация циклооксигеназы-2 с помощью ATF4 во время стресса эндоплазматического ретикулума регулирует аутофагию подоцитов почек, вызванную волчаночным нефритом. Cell Physiol Biochem. (2018) 48: 753–64. DOI: 10.1159 / 000491904
PubMed Аннотация | CrossRef Полный текст | Google Scholar
39. Zhang H, Chen Z, Miranda RN, Medeiros LJ, McCarty N. Передача сигналов TG2 и NF-κB координирует выживание клеток лимфомы из клеток мантии посредством IL6-опосредованной аутофагии. Cancer Res. (2016) 76: 6410–23. DOI: 10.1158 / 0008-5472.CAN-16-0595
PubMed Аннотация | CrossRef Полный текст | Google Scholar
40. Ким Э. Х., Ким Дж. Х., Самивел Р., Бэ Дж. С., Чунг Ю. Дж., Чунг П. С. и др.Интралимфатическая обработка смесью флагеллина и овальбумина уменьшала аллергическое воспаление на мышиной модели аллергического ринита. Аллергия. (2016) 71: 629–39. DOI: 10.1111 / all.12839
PubMed Аннотация | CrossRef Полный текст | Google Scholar
41. Mizutani N, Nabe T., Yoshino S. IL-17A способствует обострению индуцированной IL-33 гиперреактивности дыхательных путей за счет усиления нейтрофильного воспаления через передачу сигналов CXCR2 у мышей. J Immunol. (2014) 192: 1372–84. DOI: 10.4049 / jimmunol.1301538
PubMed Аннотация | CrossRef Полный текст | Google Scholar
42. Валладао А.С., Фреверт CW. STAT6 регулирует развитие эозинофильной астмы по сравнению с нейтрофильной в ответ на alternaria alternata. J Immunol. (2016) 197: 4541–51. DOI: 10.4049 / jimmunol.1600007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
43. Мелилло Р.М., Гуарино В., Авилла Е., Галдьеро М.Р., Лиотти Ф., Превете Н. и др. Тучные клетки играют протуморигенную роль в развитии рака щитовидной железы человека. Онкоген. (2010) 29: 6203–15. DOI: 10.1038 / onc.2010.348
PubMed Аннотация | CrossRef Полный текст | Google Scholar
44. van Battum EY, Verhagen MG, Vangoor VR, Fujita Y, Derijck A, O’Duibhir E. Скрининг miRNA на основе изображений идентифицирует miRNA-135s как регуляторы роста и регенерации аксонов ЦНС, воздействуя на Kruppel-подобный фактор 4. J Neurosci. (2018) 38: 613–30. DOI: 10.1523 / jneurosci.0662-17.2017
PubMed Аннотация | CrossRef Полный текст | Google Scholar
45.Нимпонг Дж. А., Гебрегзиабхер В., Сингх Ю. П., Нагаркатти П., Нагаркатти М., Ходж Дж. И др. Дефицит KLF4 нарушает функцию легких в острой модели аллергической астмы на мышах. Biochem Biophys Res Commun. (2017) 493: 598–603. DOI: 10.1016 / j.bbrc.2017.08.146
PubMed Аннотация | CrossRef Полный текст | Google Scholar
46. Риз I., Хоули Т.С., Хоули Р.Г. Связанная с KLF4-SQSTM1 / p62 аутофагия выживания способствует устойчивости к карфилзомибу в моделях множественной миеломы. Oncotarget. (2015) 6: 14814–31. DOI: 10.18632 / oncotarget.4530
PubMed Аннотация | CrossRef Полный текст | Google Scholar
47. Li Z, Hassan MQ, Volinia S, van Wijnen AJ, Stein JL, Croce CM и др. Сигнатура микроРНК для программы фиксации линии остеобластов, индуцированной BMP2. Proc Natl Acad Sci USA. (2008) 105: 13906–11. DOI: 10.1073 / pnas.0804438105
PubMed Аннотация | CrossRef Полный текст | Google Scholar
48. Фролинг А.Б., Йонкер М.Дж., Брейт Т.М., Фоккенс В.Дж., ван Друнен С.М.Сравнение профилей экспрессии, индуцированных пылевым клещом в эпителии дыхательных путей, выявляет общий путь. Аллергия. (2008) 63: 461–7. DOI: 10.1111 / j.1398-9995.2007.01621.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
49. Валиа Д.С., Шарма М., Равендран В.В., Чжоу Дж., Шарма Р., Стечшульте Д.Д. и др. Тучные клетки человека (HMC-1 5C6) усиливают продукцию интерлейкина-6 покоящимися и стимулированными липополисахаридами эндотелиальными клетками коронарных артерий человека. Медиаторы воспаления. (2012) 2012: 274347. DOI: 10.1155 / 2012/274347
PubMed Аннотация | CrossRef Полный текст | Google Scholar
50. Li XQ, Liu JT, Fan LL, Liu Y, Cheng L, Wang F и др. Экзосомы, полученные из обработанных гефитинибом мутантных клеток рака легких по EGFR, изменяют чувствительность к цисплатину за счет активации аутофагии. Oncotarget. (2016) 7: 24585–95. DOI: 10.18632 / oncotarget.8358
PubMed Аннотация | CrossRef Полный текст | Google Scholar
51. Ван Б., Цзя Х, Чжан Б., Ван Дж., Цзи С., Чжу Х и др.Предварительная инкубация с hucMSC-экзосомами предотвращает индуцированную цисплатином нефротоксичность за счет активации аутофагии. Stem Cell Res Ther. (2017) 8:75. DOI: 10.1186 / s13287-016-0463-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
52. Du YM, Zhuansun YX, Chen R, Lin L, Lin Y, Li JG. Экзосомы мезенхимальных стволовых клеток способствуют иммуносупрессии регуляторных Т-клеток при астме. Exp Cell Res. (2018) 363: 114–20. DOI: 10.1016 / j.yexcr.2017.12.021
PubMed Аннотация | CrossRef Полный текст | Google Scholar
53.Hui WW, Hercik K, Belsare S, Alugubelly N, Clapp B, Rinaldi C и др. Salmonella enterica серовар Typhimurium изменяет внеклеточный протеом макрофагов и приводит к образованию провоспалительных экзосом. Infect Immun. (2018) 86: e00386–17. DOI: 10.1128 / IAI.00386-17
PubMed Аннотация | CrossRef Полный текст | Google Scholar
54. Линосси Е.М., Чандрашекаран И.Р., Колесник Т.Б., Мерфи Дж.М., Уэбб А.И., Уилсон Т.А. и др. Супрессор передачи сигналов цитокинов (SOCS) 5 использует отдельные домены для регуляции JAK1 и взаимодействия с адаптерным белком Shc-1. PLoS ONE. (2013) 8: e70536. DOI: 10.1371 / journal.pone.0070536
PubMed Аннотация | CrossRef Полный текст | Google Scholar
55. Ратледж Х., Баран-Гейл Дж., Де Вильена Ф. П., Чеслер Э. Дж., Черчилль Г. А., Сетупати П. и др. Идентификация микроРНК, связанных с аллергическим заболеванием дыхательных путей, с использованием генетически разнообразной популяции мышей. BMC Genomics. (2015) 16: 633. DOI: 10.1186 / s12864-015-1732-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
5 простых советов по исцелению кишечника и носовых пазух | Дэйн Баркли
Изменения случаются, когда боль оставаться неизменной сильнее, чем боль перемен.
Тони Роббинс
Я часто страдаю сенной лихорадкой каждую весну и лето в течение многих лет, достигнув пика тяжести в возрасте 20 лет. То, что я родился и вырос в Мельбурне, одной из самых горячих точек в мире для страдающих аллергией и сенной лихорадкой, не помогло мне. Оглядываясь назад, я на самом деле рад, что изрядно пострадал, что заставило меня адаптироваться и развиваться в моем здоровье и побудило меня продолжить эту карьеру и осознать мою страсть и одержимость здоровьем и человеческими достижениями.Я надеюсь, что то, чем я делюсь, может быть полезно для вас или кого-то, кого вы любите, и избежать того, что сделал я.
Я ПЫТАЛСЯ ВСЕ…
В начале 2011 года, после нескольких месяцев очередного ужасного сезона сенной лихорадки, я чихнул головой и вылез из орбит в глазах. Мой врач сначала рекомендовал все неинвазивные растворы, включая назальные спреи с кортикостероидами и антигистаминные препараты, без особого успеха и, насколько мне известно, они могли даже нанести больший вред. Я зашла к врачу, чтобы узнать, что еще они могут сделать, чтобы облегчить мои симптомы.Именно тогда я начал делать еженедельные инъекции аллергенной иммунотерапии, пытаясь нейтрализовать причину сенной лихорадки. Это лечение применяется в основном к наиболее серьезным больным сенной лихорадкой, качество жизни которых сильно зависит от сенной лихорадки, и для которых лекарства от аллергического ринита оказываются неэффективными. Который был я в то время!
После нескольких месяцев еженедельных инъекций в кабинете врача и отчаянной потребности в эффективном долгосрочном решении, независимо от стоимости, мой терапевт предложил в качестве последнего средства операцию.Я обсудил это с родителями, и визит к одному из ведущих хирургов Мельбурна уха, носа и горла убедил меня. Я сделал турбинэктомию, ринопластику и септопластику в надежде, что это будет моей спасительной милостью.
Я ошибался.
Только краткосрочное облегчение.
ЕСТЕСТВЕННОЕ ИСЦЕЛЕНИЕ
Когда симптомы вернулись, я отчаянно начал искать альтернативные пути. Именно тогда я познакомился с интегративной функциональной медициной и альтернативной медициной. Я переключил свое мышление на поиск первопричины сенной лихорадки и аллергии, а не просто наложил на нее пластырь.
Это мои 5 лучших, простых и эффективных методов , которые я применял к себе постепенно в течение месяцев и использую до сих пор, чтобы помочь исправить проблемы с кишечником и носовыми пазухами. Ни в коем случае вы не ограничены только этими 5, поскольку в состоянии здоровья так много переменных, я призываю каждого из вас поэкспериментировать с тем, что работает для вас и вашего тела, и провести собственное исследование.
1. ГЛЮТЕН И ЗЕРНЫ
Исключение глютена и злаков из моего рациона заняло несколько месяцев и оказало значительное влияние на восстановление здоровья кишечника, что, в свою очередь, способствовало ослаблению моего хронического воспаления.Все люди разные, и может потребоваться больше или меньше времени.
2. КОСТНЫЙ БУЛЬ
Бульон из куриных и говяжьих костей становится все более доступным сейчас, когда мы начинаем признавать науку, лежащую в основе еды и образа жизни наших предков. Просто погуглите костный бульон и посмотрите, сколько выскакивает.
Краткие сведения о питании: Более 19 легко усваиваемых незаменимых и заменимых аминокислот, коллагена / желатина, которые помогают формировать соединительную ткань и питательные вещества, которые поддерживают функции пищеварения, иммунитет и здоровье мозга.(источник)
3. SALINE
Ежедневно очищайте носовые пазухи натуральным солевым раствором для удаления пыльцы и / или скопившейся пыли.
4. ТУРМЕРИКА
Включите куркуму в свою кулинарию как сильнодействующее противовоспалительное соединение. Либо принимайте его в форме добавки в качестве активного вещества куркумин, для тех, кто серьезно страдает, либо просто добавляйте порошок куркумы в свои продукты.
5. ОКРУЖАЮЩАЯ СРЕДА
Как я уже говорил в моем последнем посте, Можете ли вы перекусить в плохой среде? Ваша окружающая среда имеет значение! Так что используйте советы из этого поста и убедитесь, что вы получаете стабильный и качественный глубокий сон.
Один из лучших советов, которые я могу дать вам, когда дело доходит до поддержания и улучшения вашего здоровья, – это ТЕРПЕНИЕ и ПОСЛЕДОВАТЕЛЬНОСТЬ. Вы не можете просто реализовать все это и рассчитывать на мгновенный результат. Если вы потратили годы, если не десятилетия, пренебрегая своим здоровьем, то на восстановление и улучшение состояния могут уйти месяцы или годы.
Больше всего примите ДЕЙСТВИЯ!
Эпигенетическая регуляция p62 / SQSTM1 преодолевает радиорезистентность клеток рака головы и шеи посредством индукции зависимого от аутофагии старения исследование) были получены из недифференцированного первичного образца рака головы и шеи, изолированного от пациента, проходящего лечение в Медицинском центре Асан
24 , и были подтверждены анализом последовательности коротких тандемных повторов.Клетки культивировали в среде Игла, модифицированной Дульбекко (DMEM; Invitrogen, Grand Island, NY, USA), с добавлением 10% фетальной бычьей сыворотки (FBS; Invitrogen), 100 мкг / мл пенициллина / стрептомицина и 100 мкМ заменимых аминокислот. (Invitrogen) при 37 ° C в увлажненной атмосфере с 5% CO 2 .Реагенты и радиация
Бафиломицин-A1, 5-аза-2′-дезоксицитидин (5-Aza) и MS-275 (Enzo Life Science, Фармингдейл, Нью-Йорк, США) были приобретены у Sigma (Сент-Луис, Миссури). , США).Для облучения использовали пучок фотонов мощностью 6 МВ, генерируемый линейным ускорителем (CLINAC 600 C; Varian, Пало-Альто, Калифорния, США) при мощности дозы 2 Гр / мин.
Клонирование единичных клеток из опухолевых клеток
Собираликлеток HN9 и ресуспендировали в свежей среде для получения суспензии единичных клеток с плотностью ~ 10 клеток / мл. Затем 100 мкл суспензии отдельных клеток вносили в каждую лунку 96-луночного культурального планшета. Каждую лунку проверяли под фазово-контрастным микроскопом и помечали лунки, содержащие только одну клетку.Когда колония достигала слияния, ее переносили в шестилуночный планшет и выдерживали почти до слияния.
Мониторинг скорости роста клеток
Профилирование ответа клеток в зависимости от времени выполняли с использованием системы xCELLigence RTCA DP (ACEA Biosciences, Сан-Диего, Калифорния, США), как описано производителем. Скорость роста клеток измеряли на основании времени удвоения, полученного с использованием системы xCELLigence.
Модель ксенотрансплантата
Для определения онкогенной активности каждого клона ксенотрансплантаты были созданы у самцов бестимусных бестимусных мышей в возрасте от 5 до 6 недель (BALB / c nu / nu ) путем подкожной инъекции 1 × 10 7 сот.Когда опухоли достигли 50–100 мм 3 , мышей с установленными ксенотрансплантатами были стратифицированы по объему опухоли и рандомизированы в группы лечения. Все группы включали от пяти до восьми мышей, которых умерщвляли после двух недель лечения. Эксперименты на животных были одобрены Комитетом по уходу и использованию животных Института наук о жизни Асана.
Анализ выживаемости клоногенных клеток
Клетки, подвергшиеся воздействию различных доз радиации, высевали в двух экземплярах при ограниченном разведении в шестилуночные планшеты и инкубировали в полной среде в течение 14 дней.После окрашивания кристаллическим фиолетовым клоны с> 50 клетками считали положительными колониями. Эффективность посева и фракция выживших клеток, выраженная в процентах, рассчитывалась относительно таковых для необлученных клеток.
Анализ изображения mRFP-GFP / LC3
Репортерная плазмида аутофагии, ptfLC3 (кодирующая mRFP-GFP-MAP1LC3B; # 21074), была приобретена у Addgene (Кембридж, Массачусетс, США). Трансфекцию плазмиды проводили липофектамином 2000 в соответствии с инструкциями производителя.Затем, через 24 часа после трансфекции, клетки предварительно обрабатывали бафиломицином-A1 и облучали, и на конфокальной системе (Zeiss, LSM 780) отображали> 20 клеток на условие.
вирусная инфекция со сверхэкспрессией p62
Ген, кодирующий p62, амплифицировали из pcDNA4 / TO-HA-p62 (# 28027, Addgene) с помощью ПЦР с использованием ДНК-полимеразы Pfu (ELPIS, Сеул, Корея). Амплифицированный фрагмент ДНК очищали и субклонировали в pLenti-suCMV-Rsv-GFP (GenTarget, Сан-Диего, Калифорния, США) с использованием набора EzCloning Kit (Enzynomics, Тэджон, Корея).Конструкцию лентивирусного вектора котрансфицировали с psPAX2 (кодирующей упаковывающую плазмиду; # 12260, Addgene) и pMD2.G (кодирующей обволакивающую плазмиду VSV-G; # 12259, Addgene) в клетки HEK293T с использованием системы трансфекции Neon (Invitrogen). Для контроля и сверхэкспрессии p62 супернатанты, содержащие лентивирус, собирали и инфицировали в клоны HN9-R.
shRNA, заражение лентивирусом
Для создания лентивируса вектор pLKO или DNMT1-shRNA трансфицировали вместе с psPAX2 и pMD2.G в клетки HEK293T. Для преходящей инфекции клетки инфицировали лентивирусом в присутствии 5 мкг / мл полибрена (Sigma). Эффекты DNMT1-shRNA измеряли через 48 часов после трансфекции.
Анализ секвенирования РНК
Анализ последовательности РНК был коммерчески заказан Life is Art of Science (Гимпо, Корея). Различия в экспрессии генов по необработанным данным оценивали Skewer ver. 0.2.2 25 , STAR вер. 2.5 программное обеспечение 26 и программное обеспечение Cufflinks вер.2.2.1 27 . Значения P нескольких тестов были скорректированы с использованием метода Бенджамини-Хохберга, а уровень значимости был установлен на уровне ложного обнаружения (FDR) ≤ 0,05 и | log2 FC | ≥ 0,5. Гены, которые по-разному экспрессировались между клонами, анализировали с использованием точного теста Фишера для определения значительного обогащения путей Киотской энциклопедии генов и геномов (KEGG).
Иммунопреципитация
Для иммунопреципитации клетки лизировали в буфере RIPA непосредственно с последующей обработкой ультразвуком.Осветленные клеточные лизаты инкубировали с указанными антителами в течение ночи и добавляли шарики белка A / G (Santa Cruz Biotechnology, Inc.) в течение 3-5 часов. Гранулы промывали четыре раза буфером RIPA. Белки элюировали в буфере для образцов SDS и подвергали вестерн-блоттингу. Интенсивность полосы определяли количественно с использованием программного обеспечения ImageJ (Национальные институты здравоохранения, Бетесда, Мэриленд, США).
Использовали следующие антитела: LC3B (L7543; Sigma), p62 (M162-3B; MBL International Corporation, Woburn, MA, USA), DNMT1 (ab13537; Abcam), DNMT3A (ab2850; Abcam), DNMT3B (ab16049; Abcam), HDAC1 (sc7872; Santa Cruz Biotechnology Inc.), HDAC2 (sc7899; Santa Cruz Biotechnology Inc.), HDAC3 (sc376957; Santa Cruz Biotechnology Inc.), NCoR (ab24552; Abcam), ацетилированный гистон h4 (06-599; Sigma-Aldrich), гистон h4 (ab1791; Abcam ), Гистон h4K9ac (07-352; Sigma-Aldrich), гистон h4K4me3 (39915; активный мотив), гистон h4K27me3 (ab6002; Abcam), MeCP2 (ab2828; Abcam) и β-актин (A5441; Sigma).
Анализ иммунопреципитации хроматина (ChIP)
Анализ ChIP проводили с использованием набора Pierce ™ Agarose ChIP Kit (Thermo Fisher Scientific, Rockford, США) в соответствии с протоколами производителя.Осажденную ДНК хроматина выделяли и анализировали с помощью ПЦР. Используемые последовательности праймеров для ПЦР: P1 прямой 5′-GCA CTC ACC TTC CAG GAG GTG-3 ‘, обратный 5′-ATT GTC AAT TCC TCG TCA CTG-3′ или P2 прямой 5’-TGT TAT TGA GCT GTA ACT GAA- 3 ‘, обратный 5′-CAT GGC CTG TCC ACA CAA CAG-3’.
Анализ с мягким агаром
Клетки (10 5 клеток / лунку) смешивали с 0,4% агарозой в среде для выращивания, высевали поверх затвердевшего слоя 0,5% агарозы в среде для выращивания в шестилуночном планшете. и подкармливают каждые 3 дня питательной средой.Через 3–4 недели колонии окрашивали кристаллическим фиолетовым (0,01% раствор) и подсчитывали с помощью программного обеспечения OpenCFU (http://opencfu.sourceforge.net/).
Статистический анализ
Все значения были представлены как среднее ± стандартная ошибка. Статистические различия оценивали с использованием двустороннего непарного теста Стьюдента t для независимой выборки или дисперсионного анализа с поправкой Бонферрони с использованием программного обеспечения Microsoft Excel или Prism. Для анализа клоногенной выживаемости использовали лог-ранговый тест.Порог статистической значимости был установлен на уровне p <0,05. Размеры выборки для всех экспериментов были предопределены расчетами, основанными на нашем опыте. Ни один образец не был исключен из анализа. Исследователи не были закрыты для распределения групп во время эксперимента и оценки результатов. Значения значимости и количество повторов были указаны в легенде каждого рисунка.
Развитие и иммунопатологические характеристики мышиной модели хронического риносинусита, индуцированного альтернариозом
Реферат
Переносимые по воздуху грибы связаны с воспалительными заболеваниями верхних и нижних дыхательных путей. Alternaria обычно обнаруживается в выделениях носа и вызывает выработку химических медиаторов слизистой оболочкой носовых пазух. Это исследование было направлено на создание модели мышей с хроническим риносинуситом (CRS), индуцированным Alternaria , и определение влияния аллергического фона хозяина на иммунопатологические характеристики CRS. Мышей BALB / c использовали для создания модели CRS. Alternaria вводили интраназально в течение 8 или 16 недель с пресенсибилизацией овальбумином (OVA) или без нее.Уровни общего сывороточного IgE и Alternaria -специфического IgE измеряли с помощью иммуноферментного анализа (ELISA). Уровни интерлейкина (IL) -4, IL-10, интерферона (IFN) -γ и фактора некроза опухоли (TNF) -α в жидкости носового лаважа (NLF) и спленоцитах измеряли с помощью ELISA и их мРНК и уровней связанных факторов транскрипции. в слизистой оболочке носовых пазух определяли с помощью количественной полимеразной цепной реакции с обратной транскриптазой (ОТ-ПЦР). Окрашивание гематоксилином-эозином и периодическое окрашивание кислотой-Шиффом проводили для оценки гистологических изменений.Общий сывороточный IgE был повышен как при аллергическом, так и при неаллергическом СВК. IL-4 сильно экспрессировался в NLF как при аллергическом, так и при неаллергическом CRS через 16 недель, и не только эозинофилы, но также нейтрофилы были увеличены в NLF неаллергических CRS мышей. Уровни цитокинов Th2, Th3 и Treg и мРНК факторов транскрипции были значительно увеличены в слизистой оболочке носовых пазух неаллергических мышей CRS. И инфильтрация воспалительных клеток, и гиперплазия бокаловидных клеток были увеличены у мышей CRS. Повторная интраназальная инстилляция Alternari a приводит к воспалению придаточных пазух носа с инфильтрацией воспалительных клеток.Было показано, что иммунные ответы слизистой оболочки носовых пазух против Alternaria различаются в зависимости от аллергического фона хозяина.
Образец цитирования: Shin S-H, Ye M-K, Lee D-W, Chae M-H, Choi S-Y (2020) Разработка и иммунопатологические характеристики модели мышей с хроническим риносинуситом, индуцированным Alternaria . PLoS ONE 15 (6): e0234731. https://doi.org/10.1371/journal.pone.0234731
Редактор: Хайнц Ференбах, Forschungszentrum Borstel Leibniz-Zentrum fur Medizin und Biowissenschaften, ГЕРМАНИЯ
Поступила 13 ноября 2019 г .; Одобрена: 2 июня 2020 г .; Опубликовано: 16 июня 2020 г.
Авторские права: © 2020 Shin et al.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Все соответствующие данные находятся в документе и его файлах с вспомогательной информацией.
Финансирование: Эта работа была поддержана грантом Национального исследовательского фонда Кореи (NRF), финансируемым правительством Кореи (Министерство науки и ИКТ) (2019R1F1A1047757) для PI, SH Shin.
Конкурирующие интересы: Авторы заявили, что никаких конкурирующих интересов не существует.
Введение
Хронический риносинусит (ХРБ) включает гетерогенную группу заболеваний, которые можно классифицировать как эозинофильные или неэозинофильные ХРС на основе доминирующих типов воспалительных клеток. CRS также можно разделить на Th2, Th3 и Th27 доминантные CRS на основании присутствия лимфоцитарных эффекторных клеток в тканях носовых пазух. [1] Хотя этиология и патогенез CRS полностью не изучены, CRS характеризуется хроническим воспалением слизистой оболочки носовых пазух с гетерогенной группой воспалительных реакций на аллергены, бактерии, грибки и вирусы.СВК считали инфекционным заболеванием, при этом основное внимание уделялось выявлению патогенных микробных организмов. Однако недавние исследования показали, что СВК не может быть связан с иммуноопосредованными заболеваниями, участие которых может вызвать обострение местных воспалительных реакций.
Грибы повсеместно распространены в природе, но относительно небольшое количество видов причастно к болезням человека. Alternaria , Aspergillus , Penicillium и Cladosporium обычно обнаруживаются в носовых выделениях не только при СВК, но и у здоровых людей.[2] Грибы все чаще признаются важными патогенами у пациентов с синуситом; Однако, их роль в патогенезе CRS остается спорной. Компоненты грибов, такие как белки и ферменты, вызывают иммунные ответы и приводят к выработке химических медиаторов за счет взаимодействия рецепторов клеточных мембран. [3, 4] Экстракты Alternaria и Aspergillus активируют эпителиальные клетки верхних и нижних дыхательных путей и усиливают продукцию нескольких медиаторов воспаления; они считаются факторами риска развития астмы, аллергического ринита и СВК.[5–8]
Alternaria alternata вызывает аллергическое воспаление дыхательных путей с повышенной экспрессией в легких цитокинов 2 типа и эозинофилов. [9] Было показано, что при травме слизистой оболочки носовых пазух прививка Alternaria и Aspergillus вызывает воспаление носовых пазух с инфильтрацией воспалительных клеток, утолщением эпителия и гиперплазией бокаловидных клеток. [10, 11] Интраназальное заражение Aspergillus плюс овальбумин может вызвать аллергическое воспаление в слизистой оболочке носовых пазух с развитием модели эозинофильного СВК.[12] Сравните с Aspergillus , Alternaria сильно усиливает продукцию химических посредников в эпителиальных клетках носа и влияет на иммунные ответы Th. [13] Аллергический ринит и СВК представляют собой воспалительные заболевания слизистой оболочки носовых пазух. Связь между аллергическим ринитом и СВК противоречива. Было высказано предположение, что медиаторы воспаления, связанные с носовой аллергией, вызывают развитие СВК. [14] Однако доказательств связи аллергии с СВК довольно мало. [15] Целью этого исследования было оценить, может ли Alternaria вызывать воспалительные иммунные реакции в слизистой оболочке носовых пазух и узнать, может ли аллергический статус хозяина повлиять на развитие воспаления слизистой оболочки, вызванного грибами.Таким образом, мы создали модель CRS на мышах путем повторной интраназальной инстилляции Alternaria с пресенсибилизацией овальбумином (OVA) или без нее и сравнили их иммунопатологические характеристики.
Материалы и методы
Модель мыши CRS, индуцированная Alternaria ,Самок мышей BALB / c (возраст 6 недель) были приобретены у Hyosung Science Inc. (Тэгу, Южная Корея). Их содержали в стандартных условиях в клетке, свободной от патогенов. Это исследование было проведено в соответствии с руководящими принципами Национального института здоровья и одобрено Институтом наблюдательного совета экспериментов на животных Медицинского центра католического университета Тэгу (DCIAFCR-180718-11).
Внутрибрюшинное введение овальбумина (OVA, 75 мкг) в 200 мкл фосфатно-солевого буфера (PBS), содержащего 2 мг гидроксида алюминия (Sigma Aldrich, Сент-Луис, Миссури, США), выполнялось в дни 0, 7, 14, и 21 – развитие аллергической предрасположенности. Затем мышам интраназально вводили 50 мкг / мл Alternaria alternata ; культивировать экстракты фильтрата в PBS в течение 8 или 16 недель для развития аллергической модели CRS Alternaria . Экстракты Alternaria alternata (Лот №: 312142, Greer Lab, Ленуар, Северная Каролина, США) концентрировали, диализовали и лиофилизировали из жидкой среды, в которой грибы культивировали с экстракцией белков в среду.Внутрибрюшинная инъекция PBS с последующей интраназальной инстилляцией Alternaria в течение 8 или 16 недель была разработана для создания неаллергической модели CRS Alternaria . Внутрибрюшинная инъекция только PBS с последующей интраназальной инстилляцией PBS в течение 8 или 16 недель была разработана для создания мышей отрицательного контроля. Экспериментальных мышей умерщвляли через 24 часа после последнего заражения, как показано на рис. 1.
Рис. 1. Схематическая диаграмма модели мыши с хроническим риносинуситом, вызванной Alternaria .
Внутрибрюшинная инъекция овальбумина (OVA), а затем интраназальная инстилляция Alternaria в течение 8 или 16 недель была разработана в качестве модели аллергического СВК. Внутрибрюшинные инъекции фосфатно-солевого буфера (PBS), а затем интраназальные инстилляции Alternaria в течение 8 или 16 недель были разработаны в качестве неаллергической модели CRS. Внутрибрюшинная инъекция PBS, а затем интраназальная инстилляция PBS в течение 8 или 16 недель была разработана в качестве мышей отрицательного контроля.
https: // doi.org / 10.1371 / journal.pone.0234731.g001
Оценка химических медиаторов в жидкости для промывания носа (NLF)
NLF собирали через 24 часа после последнего заражения через 8 или 16 недель. Катетер калибра 21 был введен через место частичной резекции трахеи в направлении верхних дыхательных путей в носоглотку. Один мл холодного PBS аккуратно перфузировали в носовую полость и собрали в пробирку. NLF центрифугировали при 2000 об / мин в течение 7 минут при 4 ° C. Супернатант собирали для определения уровней интерлейкина (IL) -4, IL-10, интерферона (IFN) -γ и фактора некроза опухоли (TNF) -α с использованием наборов для иммуноферментного анализа (ELISA) (R&D Systems, Minneapolis). , Миннесота, США).Осадок ресуспендировали в PBS и окрашивали красителем May-Grunwald-Giemsa, и клетки дифференцировались в эозинофилы, нейтрофилы, лимфоциты и другие клетки. Среднее количество клеток в пяти полях с высоким увеличением было определено хорошо обученным исследователем, у которого не было экспериментальной информации на слайдах.
Измерение общего сывороточного IgE
Образцы крови были взяты из нижней полой вены через 24 часа после последней интраназальной провокации. Сыворотку получали центрифугированием, и общий IgE измеряли с помощью ELISA (Pharmingen, San Diego, CA, USA).
Измерение мРНК цитокинов и факторов транскрипции в слизистой оболочке носовых пазух
Суммарную РНК экстрагировали из слизистой оболочки носовых пазух с использованием реагента Trizol (Invitrogen, Carlsbad, CA, USA). Чистоту и концентрацию РНК измеряли с помощью спектрофотометра (Beckman, Mountain View, CA, USA). Комплементарную ДНК получали из 1 мкг РНК с использованием амплификации с использованием полимеразной цепной реакции с обратной транскрипцией (RT-PCR) с помощью термоциклера PerkinElmer (Norwalk, CT, USA). Количественную полимеразную цепную реакцию с амплифицированной кДНК проводили с использованием основного набора SYBR Green PCR (PE Applied Biosystems, Foster City, CA, USA).Уровни экспрессии мРНК измеряли методом порога цикла (2 -ΔΔ CT) и нормализовали до β-актина . В таблице S1 показаны праймеры, использованные в этом исследовании. Первоначальную денатурацию проводили при 95 ° C в течение 2 минут, затем следовали 40 циклов, состоящих из денатурации при 94 ° C в течение 10 секунд, отжига при 60 ° C в течение 10 секунд и элонгации при 72 ° C в течение 45 секунд. Для исследования мРНК были приготовлены две технические повторы и 3-4 биологические реплики.
Активация спленоцитов
AlternariaТкани селезенки выделяли от мышей и разделяли на отдельные клетки с использованием фильтра для клеток 70 мкм.Красные кровяные тельца (эритроциты) удаляли с помощью буфера для лизиса эритроцитов (BioLegend, Сан-Диего, Калифорния, США). Клетки инкубировали в среде Roswell Park Memorial Institute-1640 с добавлением 10% фетальной бычьей сыворотки, 100 Ед / мл пенициллина и 100 мкг / мл стрептомицина (Gibco, Grand Island, NY, США). После стимуляции 100 мкг / мл Alternaria в течение 72 часов супернатант собирали и хранили при -70 ° C до анализа. Уровни IL-4, IL-10, IFN-γ и TNF-α в супернатантах измеряли с использованием наборов ELISA (R&D Systems).
Гистологическое исследование слизистой оболочки носовых пазух
Мышей безболезненно умерщвляли смертельной дозой пентобарбитала натрия, введенного внутрибрюшинно. Образцы декальцинировали в этилендиаминтетрауксусной кислоте и заливали парафином. Ткань разрезали на коронковые срезы толщиной 5 мкм. Были выбраны три анатомически схожие секции, как и в предыдущем исследовании. [12]
Инфильтрацию воспалительных клеток и толщину эпителия определяли в срезах, окрашенных гематоксилином и эозином.Степень инфильтрации подслизистых воспалительных клеток количественно оценивали по четырем категориям следующим образом (0: нет, 1: легкие, случайные рассеянные воспалительные клетки, 2: умеренные, 3: тяжелые, диффузная инфильтрация воспалительных клеток). Количество бокаловидных клеток определяли путем окрашивания периодической кислотой-Шиффом (PAS) при увеличении × 200 и подсчитывали среднее количество бокаловидных клеток с использованием сетки окуляра. Толщину эпителия непосредственно измеряли при увеличении × 400 с помощью видеокамеры (Olympus Optical Co.Ltd., Токио, Япония) и проанализированы с помощью программного обеспечения контроллера DP (версия 2.2.1.227). Все срезы ткани исследовали вслепую относительно источника ткани, и подсчеты определяли на трех различных участках слизистой оболочки для каждого из трех срезов на мышь.
Статистический анализ
Все измеренные параметры выражены как среднее ± стандартное отклонение. Односторонний дисперсионный анализ с последующим тестом Тьюки был проведен для нормально распределенных данных, а тест Крускала-Уоллиса с апостериорным тестом Бонферрони-Данна был выполнен для ненормально распределенных данных (SPSS ver.21, IBM Corp., Армонк, Нью-Йорк, США). Значение вероятности менее 0,05 считалось статистически значимым.
Результаты
Уровень общего сывороточного IgE
Повторная интраназальная инстилляция Alternaria значительно повысила уровень общего сывороточного IgE независимо от пресенсибилизации OVA через 8 и 16 недель. Общий уровень IgE в сыворотке крови через 8 недель был намного выше у пресенсибилизированных мышей (528,2 ± 287,4 нг / мл), чем в несенсибилизированной группе (398.2 ± 160,6 нг / мл), но уровни в этих группах стали примерно одинаковыми через 16 недель (712,3 ± 171,3 нг / мл с пресенсибилизацией, 704,3 ± 431,6 нг / мл без пресенсибилизации) (рис. 2).
Рис. 2. Уровень общего сывороточного IgE через 8 и 16 недель при повторной инстилляции Alternaria .
УровеньIgE был значительно увеличен как на аллергической, так и неаллергической мышиных моделях (n = 7 мышей на группу). NC: отрицательный контроль, ALTwOVA: Alternaria , инстилляция с пресенсибилизацией овальбумином (OVA), ALTsOVA; Alternaria инстилляция без пресенсибилизации овальбумином (OVA).* p <0,05 по сравнению с группой NC.
https://doi.org/10.1371/journal.pone.0234731.g002
Химические медиаторы и клетки воспаления в NLF
Повторная интраназальная инстилляция Alternaria повысила уровень IL-4, IL-10 и TNF-α в NLF мышей с аллергией CRS на 8 (IL-4, 19,4 ± 9,6 пг / мл; IL-10, 2,6 ± 2,3 пг / мл; TNF-α, 7,9 ± 5,9 пг / мл) и 16 недель (IL-4, 19,1 ± 5,9 пг / мл; IL-10, 3,5 ± 1,7 пг / мл; TNF-α, 8,5 ± 5,2 пг) / мл). Без пресенсибилизации OVA повышенный уровень IL-10 составляет 3.2 ± 2,5 пг / мл через 8 недель снизились до 0,4 ± 0,2 пг / мл через 16 недель. Уровень INF-γ не подвергался значительному влиянию интраназальной инстилляции Alternaria (рис. 3).
Рис. 3. Дифференциалы воспалительных клеток и уровни химических посредников в жидкости для носового лаважа (NLF) на мышиной модели Alternaira , вызванной хроническим риносинуситом.
Эозинофилы и нейтрофилы были увеличены в NLF модели неаллергической мыши. Th3, Treg и уровень воспалительных цитокинов сильно экспрессировались в NLF модели аллергических мышей (n = 7 мышей на группу).NC: отрицательный контроль, ALTwOVA: Alternaria , инстилляция с пресенсибилизацией овальбумином (OVA), ALTsOVA; Alternaria инстилляция без пресенсибилизации овальбумином (OVA). * p <0,05 по сравнению с группой NC, † p <0,05 по сравнению с группой OVA или без нее.
https://doi.org/10.1371/journal.pone.0234731.g003
Когда мышей лечили Alternaria в течение 8 и 16 недель, количество эозинофилов и нейтрофилов значительно увеличивалось в NLF у неаллергических мышей с CRS.Только уровень эозинофилов увеличивался через 8 недель в NLF у OVA-сенсибилизированных мышей по сравнению с таковым у мышей отрицательного контроля. Уровни лимфоцитов в NLF существенно не различались между тремя группами (рис. 3).
Производство химического медиатора из спленоцитов.
Клетки селезенки мыши стимулировали Alternaria в течение 72 часов. Продукция IL-4 была значительно увеличена у мышей CRS с аллергией (11,5 ± 4,7 пг / мл) и без аллергии (10,2 ± 5,6 пг / мл) по сравнению с контрольной группой (3.8 ± 2,7 пг / мл) через 8 недель. Однако уровни продукции IL-10, IFN-γ и TNF-α существенно не различались между тремя группами. У мышей, которым вводили интраназально через 16 недель, только продукция IL-10 была значительно увеличена у мышей без аллергии CRS (14,3 ± 7,3 пг / мл) по сравнению с таковой в других группах (сенсибилизированная группа, 8,21 ± 6,5 пг / мл; отрицательный контроль. группа, 6,3 ± 3,7 пг / мл) (рис. 4).
Рис. 4. Продукция химического медиатора из спленоцитов после стимуляции 100 мкг / мл Alteranria в течение 72 часов.
Продукция IL-4 была значительно увеличена у аллергической и неаллергической слюды через 8 недель, а продукция IL-10 была значительно увеличена у неаллергических мышей (n = 7 мышей на группу). NC: отрицательный контроль, ALTwOVA: Alternaria , инстилляция с пресенсибилизацией овальбумином (OVA), ALTsOVA; Alternaria инстилляция без пресенсибилизации овальбумином (OVA). * p <0,05 по сравнению с группой NC, † p <0,05 по сравнению с группой OVA или без нее.
https://doi.org/10.1371 / journal.pone.0234731.g004
Экспрессия мРНК цитокинов слизистой оболочки носа и факторов транскрипции
Мы провели ОТ-ПЦР в реальном времени, чтобы определить влияние интраназальной инстилляции Alternaria на экспрессию мРНК Th-связанных цитокинов и факторов транскрипции подгруппы Т-клеток в слизистой оболочке носовых пазух. После 8 недель инстилляции Alternaria уровни экспрессии мРНК IL-10 и FOXp3 были значительно увеличены как у аллергических, так и у неаллергических мышей CRS.Экспрессия мРНК IL-4, INF-γ, T-bet и GATA3 была значительно увеличена на Alternaria у неаллергических мышей CRS по сравнению с таковой у мышей с аллергическим CRS и отрицательным контролем. После 16 недель инстилляции Alternaria экспрессия только мРНК IL-4 была значительно увеличена в неаллергической группе по сравнению с таковой в аллергической группе и группе отрицательного контроля (фиг. 5).
Рис. 5. Экспрессия мРНК химического посредника и фактора транскрипции в слизистой оболочке носовых пазух на мышиной модели Alternaria , индуцированной хроническим риносинуситом (CRS).
IL-4 и IFN-γ и экспрессия их мРНК фактора транскрипции значительно увеличивались в группе с неаллергическим CRS через 8 недель. Экспрессия мРНК IL-10 и его фактора транскрипции была значительно увеличена как в группе с аллергическим, так и с неаллергическим CRS через 8 недель (3-4 мыши в группе). NC: отрицательный контроль, ALTwOVA: Alternaria , инстилляция с пресенсибилизацией овальбумином (OVA), ALTsOVA; Alternaria инстилляция без пресенсибилизации овальбумином (OVA). * p <0,05 по сравнению с группой NC, † p <0.05 по сравнению с группой OVA или без нее.
https://doi.org/10.1371/journal.pone.0234731.g005
Гистопатологические характеристики
Интраназальная инстилляция Alternaria значительно увеличила инфильтрацию воспалительными клетками подслизистой области с сенсибилизацией OVA или без нее через 8 недель (1,5 ± 0,6 и 1,4 ± 0,5 с или без сенсибилизации) и 16 недель (1,3 ± 0,3 и 1,5 ± 0,5 с или без сенсибилизации) по сравнению с контрольной группой (0.5 ± 0,3 и 0,4 ± 0,3 на 8 и 16 неделях) (рис. 6).
Рис. 6. Гистологические характеристики модели мышей с индуцированным Alternaira хроническим риносинуситом (CRS).
Воспалительная клеточная инфильтрация (A, x400) и периодическая кислота-Шиффо (PAS) положительные клетки (B, x400) были значительно увеличены в слизистой оболочке носовых пазух носовых пазух аллергических и неаллергических CRS-мышей на модели мыши Alternaira , индуцированной хроническим риносинуситом. (3–4 мыши в группе). NC: отрицательный контроль, ALTwOVA: Alternaria , инстилляция с пресенсибилизацией овальбумином (OVA), ALTsOVA; Alternaria инстилляция без пресенсибилизации овальбумином (OVA).* p <0,05 по сравнению с группой NC, † p <0,05 по сравнению с группой OVA или без нее.
https://doi.org/10.1371/journal.pone.0234731.g006
PAS-положительные бокаловидные клетки в слизистой оболочке носовых пазух были значительно увеличены как в аллергической, так и в неаллергической группах СВК на 8 (23,0 ± 13,4 и 13,8 ± 7,5 соответственно ) и 16 недель (29,0 ± 9,7 и 27,0 ± 13,3 соответственно) по сравнению с контрольной группой (6,0 ± 2,5 и 10,5 ± 3,4 на 8 и 16 неделях). Хотя толщина эпителия имела тенденцию к увеличению в группах с инстилляцией Alternaria , между этими тремя группами не было значительных различий (рис. 6).
Обсуждение
Грибы повсеместно распространены в окружающей среде и часто встречаются в секретах дыхательных путей здоровых пациентов и пациентов с СВК. [1, 16] Протеазная активность формы Alternaria индуцирует выработку провоспалительных цитокинов и тимического стромального лимфопоэтина (TSLP) клетками респираторного эпителия и обычно ассоциируется с CRS. [17, 18] Эпителиальные клетки, производные TSLP и секреция IL-33 в дыхательные пути, вызывают воспаление Th3-типа. [17, 19] В этом исследовании мы попытались определить иммунологический эффект Alteranria alternata на воспаление слизистой оболочки носовых пазух и иммунопатологические характеристики мышиной модели Alternaria , вызванной CRS.Повторяющаяся интраназальная стимуляция Alternaria приводит к выраженному воспалению придаточных пазух носа независимо от аллергической предрасположенности. Связь между аллергией и CRS остается дискуссионной и почти равное количество исследований при поддержке или опровергнуть связь аллергии с оба CRS с полипами носа или CRS без носовых полипов. [20] Согласно нашим данным, Alternaria может развить воспаление придаточных пазух носа независимо от аллергического фона хозяина, а Alternaria индуцировал доминантный иммунный ответ Th3 с аллергической предрасположенностью, тогда как иммунные ответы Th2 и Th3 без аллергической предрасположенности.Споры грибов постоянно вдыхаются и откладываются на слизистой оболочке носовых пазух и влияют на иммунный ответ слизистой оболочки. Однако мы использовали фильтрованные в культуре экстракты Alternaria для разработки мышиной модели CRS, поэтому нам необходимо дальнейшее исследование для определения иммунопатологических характеристик мыши CRS, индуцированной спорами Alternaria .
Alternaria развивает аллергическую реакцию дыхательных путей, характеризующуюся повышенной инфильтрацией цитокинов Th3 и эозинофилов и высоким уровнем сывороточного IgE.[21] Интраназальная инстилляция Alternaria вызвала высокий уровень сывороточного IgE независимо от аллергического статуса. Количество эозинофилов увеличивалось в NLF путем интраназальной инстилляции Alternaria через 8 недель, независимо от аллергического статуса. Однако через 16 недель количество эозинофилов увеличивалось только у мышей с неаллергическим CRS. А нейтрофилы увеличиваются только у мышей, не страдающих аллергией CRS. Инфильтрация воспалительными клетками слизистой оболочки носовых пазух не оказывала значительного влияния на аллергический статус мышей.Эти данные свидетельствуют о том, что интраназальная инстилляция Alternaira может вызывать аллергические реакции с высоким уровнем общего IgE в сыворотке, инфильтрацию воспалительных клеток тканей и образование слизи независимо от аллергического статуса. Однако эозинофильные воспалительные реакции, по-видимому, более доминируют у мышей с аллергическим CRS, и как эозинофильные, так и нейтрофильные воспалительные реакции, по-видимому, происходят без аллергической предрасположенности.
Интраназальная инстилляция Alternaria увеличивала концентрацию IL-4 в NLF через 8 и 16 недель у мышей с аллергией CRS.Хотя уровень IL-4 не увеличивался статистически значимо через 8 недель, характер увеличения IL-4 в NLF был аналогичным у неаллергических мышей с CRS. Однако, когда спленоциты стимулировали Alternaria , уровень IL-4 значительно увеличивался через 8 недель, но не через 16 недель. Эти результаты могут быть связаны с тем, что интраназальная установка вызывает ранние местные и системные воспалительные реакции Th3, и со временем системная воспалительная реакция Th3 ослабляется с постоянными местными воспалительными ответами Th3.Цитокин Treg, IL-10 был увеличен в NLF мышей с аллергией CRS на 8 и 16 неделях и в спленоцитах у мышей без аллергии CRS на 16 неделе. Эти данные могут указывать на то, что интраназальная инстилляция Alternaria демонстрирует различные местные и системные иммунные ответы. После 8 недель интраназальной инстилляции развилось местное и системное Th2 и / или Th3 воспаление. Однако через 16 недель местные воспалительные иммунные ответы уменьшились с увеличением системной иммунной толерантности с увеличением продукции IL-10.Согласно предыдущим исследованиям, мышиные модели CRS развили воспалительный иммунный ответ после 4–12 недель стимуляции отдельными патогенами. [10, 12, 22] Когда модель мыши CRS была сделана с множеством переносимых по воздуху аллергенов, воспаление придаточных пазух носа сохранялось более 12 недель. [23] Мы предполагаем, что региональное воздействие единичных аллергенов может сначала вызвать местные и системные воспалительные иммунные реакции, затем местные воспалительные реакции могут уменьшаться с повышением системной иммунной толерантности.Для поддержания или обострения местного и системного воспаления может потребоваться еще одна патогенная стимуляция. Роль грибов в патогенезе в АСБ до сих пор спорным. Однако, если грибковое воспаление придаточных пазух носа сочетается с бактериальной или вирусной инфекцией, местные и системные воспаления могут сохраняться и обостряться в течение более длительного периода времени. Клетки респираторного эпителия являются первыми клетками слизистой оболочки, подвергающимися воздействию внешних раздражителей, таких как переносимые по воздуху аллергены, грибы, вирусы и бактерии.Если врожденная иммунная защита от патогенов по какой-либо причине нарушена, эти патогены могут взаимодействовать, чтобы усугубить местное и системное воспаление. Чтобы определить различия в иммунных ответах против Alternaria , нам необходимо оценить местные и системные воспалительные паттерны в разные интервалы времени и сравнить экспрессию других воспалительных и подавляющих цитокинов в слизистой оболочке носовых пазух.
Цитокин слизистой оболочки носа и характер экспрессии мРНК их фактора транскрипции отличался от концентрации цитокинов в NLF.Цитокины Th2 и Th3 и их мРНК фактора транскрипции были значительно увеличены у мышей с неаллергическим CRS, а мРНК цитокина Treg и фактора транскрипции была значительно увеличена независимо от аллергической предрасположенности. Точная причина не может быть объяснена с помощью этого исследования, но есть некоторые возможности. Уровень мРНК слизистой носовых пазух может отражать концентрацию белка слизистой оболочки носа, но не концентрацию в NLF. К сожалению, мы не измеряли уровень белка Th-цитокинов и напрямую сравнивали уровни мРНК и белка в слизистой оболочке.Экспрессия мРНК IL-4 и фактора транскрипции не показывала статистически значимого увеличения у мышей с аллергией CRS. Однако экспрессия мРНК IL-4 и его фактора транскрипции имела тенденцию к увеличению при значительном увеличении IL-4 в NLF. Эти результаты могут быть связаны с разницей во времени между экспрессией мРНК, продукцией белка и их секрецией в носовую полость.
Заключение
Повторяющиеся интраназальные инстилляции Alternari a приводят к преобладанию иммунного ответа Th3 и эозинофилов в состоянии аллергической предрасположенности.Без аллергического фона повторная стимуляция Alternaria приводит не только к Th3, но также и к Th2- и Treg-иммунному ответу с преобладанием эозинофилов и нейтрофилов. Основываясь на этих результатах, интраназальная инстилляция Alternaria может вызвать воспаление слизистой оболочки носовых пазух с иммунными ответами Th. И иммунные ответы слизистой оболочки носовых пазух против Alternaria были разными в зависимости от различий в аллергическом фоне хозяина и различных временных интервалов.
Ссылки
- 1. Цао П.П., Ван З.С., Шлеймер Р.П., Лю З. Патофизиологические механизмы хронического риносинусита и их роль в новых эндотипах заболеваний. Ann Allergy Asthma Immunol. 2019; 122 (1): 33–40. pmid: 30326322
- 2. Шин Ш., Е. М. К., Ли Й. Х. Посев на грибок из носового секрета пациентов с хроническим риносинуситом: сезонные колебания в Тэгу, Корея. Am J Rhinol. 2007. 21 (5): 556–9. pmid: 17999789
- 3. Баленга Н.А., Кличинский М., Се З., Чан Э.С., Чжао М., Джуд Дж и др.Грибковый аллерген протеазы вызывает гиперчувствительность дыхательных путей при астме. Nat Commun. 2015; 6: 6763. pmid: 25865874
- 4. Wu D, Wei Y, Bleier BS. Новая роль протеаз в патогенезе хронического риносинусита с полипами носа. Front Cell Infect Microbiol. 2017; 7: 538. pmid: 29376037
- 5. Мураи Х., Окадзаки С., Хаяси Х., Кавакита А., Хосоки К., Ясутоми М. и др. Экстракт альтернарии активирует аутофагию, которая вызывает высвобождение IL-18 из эпителиальных клеток дыхательных путей.Biochem Biophys Res Commun. 2015; 464 (4): 969–74. pmid: 26032499
- 6. Lehmann S, Sprunken A, Wagner N, Tenbrock K, Ott H. Клиническая значимость IgE-опосредованной сенсибилизации против плесени Alternaria alternata у детей с астмой. Ther Adv Respir Dis. 2017; 11 (1): 30–9. pmid: 28043213
- 7. Katotomichelakis M, Nikolaidis C, Makris M, Proimos E, Aggelides X, Constantinidis TC и др. Календарь Alternaria и Cladosporium Западной Фракии: связь с симптомами аллергического ринита.Ларингоскоп. 2016; 126 (2): E51–6. pmid: 26371953
- 8. Лоуренс Л.А., Маллиган Дж. К., Роуч С., Паскини В. Н., Солер З. М., Банглавала С. М. и др. Супероксиддисмутаза снижает воспалительную реакцию на Aspergillus и Alternaria в эпителиальных клетках носовых пазух человека, полученных от пациентов с хроническим риносинуситом. Am J Rhinol Allergy. 2015; 29 (2): 89–93. pmid: 25785747
- 9. Ким Х.К., Баум Р., Лунд С., Хоррам Н., Янг С.Л., Чунг К.Р. и др. Нарушение индукции аллергического воспаления легких мутантом Alternaria alternata, гомологом MAPK Fus3.Exp Lung Res. 2013. 39 (9): 399–409. pmid: 24102366
- 10. Ан БХ, Пак Й.Х., Шин Ш. Мышиная модель риносинусита, индуцированного Aspergillus и Alternaria. Auris Nasus Larynx. 2009. 36 (4): 422–6. pmid: 160
- 11. Альт Дж. А., Ли В. Ю., Дэвис Б. М., Сэвидж Дж. Р., Кеннеди Т. П., Прествич Г. Д. и др. Синтетический гликозаминогликан уменьшает воспаление придаточных пазух носа на мышиной модели хронического риносинусита. PLoS One. 2018; 13 (9): e0204709. pmid: 30252910
- 12. Ким ХК, Лим Дж.Й., Ким С., Ким Дж. Х., Чан Й. Дж.Разработка мышиной модели эозинофильного хронического риносинусита с назальным полипом путем интраназальной инстилляции протеазы Aspergillus и овальбумина. Eur Arch Otorhinolaryngol. 2017; 274 (11): 3899–906. pmid: 28828551
- 13. Шин С.Х., Е МК, Ли Д.В., Чае М.Х., Хан Б.Д. Клетки носового эпителия, активированные альтернариозом и клещом домашней пыли, вызывают не только Th3, но и Th2 иммунные ответы. Int J Mol Sci. 2020; 21 (8).
- 14. Кеннеди Дж. Л., Бориш Л. Патофизиология хронического синусита: роль аллергии.Am J Rhinol Allergy. 2013. 27 (5): 367–71. pmid: 23601202
- 15. Wise SK, Lin SY, Toskala E, Orlandi RR, Akdis CA, Alt JA, et al. Заявление о международном консенсусе по аллергии и ринологии: аллергический ринит. Int Forum Allergy Rhinol. 2018. 8 (2): 108–352. pmid: 29438602
- 16. Hirotsu M, Shiozawa A, Ono N, Miwa M, Kikuchi K, Ikeda K. Грибковые экстракты, обнаруженные в эозинофильных хронических риносинуситах, индуцированных цитокинами из клеток назального полипа. Ларингоскоп.2014; 124 (9): E347–53. pmid: 24615892
- 17. Кузаки Х., О’Грейди С.М., Лоуренс С.Б., Кита Х. Протеазы индуцируют выработку стромального лимфопоэтина тимуса эпителиальными клетками дыхательных путей через рецептор-2, активируемый протеазой. J Immunol. 2009. 183 (2): 1427–34. pmid: 19561109
- 18. Matsuwaki Y, Wada K, White T, Moriyama H, Kita H. Грибок Alternaria индуцирует выработку GM-CSF, интерлейкина-6 и интерлейкина-8 и передачу сигналов кальция в эпителии дыхательных путей человека через рецептор 2, активируемый протеазой.Int Arch Allergy Immunol. 2012; 158 Прил. 1: 19–29.
- 19. Нагата Ю., Маруока С., Гон И., Мизумура К., Киши Х., Номура Ю. и др. Экспрессия IL-25, IL-33 и стромального лимфопоэтина тимуса в эпителии протоков носовых полипов у пациентов с хроническим риносинуситом. Am J Rhinol Allergy. 2019; 33 (4): 378–87. pmid: 30873846
- 20. Маркус С., Роланд Л.Т., Делгаудио Ю.М., Мудрый СК. Связь аллергии и хронического риносинусита. Ларингоскоп Исследование Отоларингол.2019; 4 (1): 13–7. pmid: 30828613
- 21. Валладао AC, Фреверт CW, Кох Л.К., Кэмпбелл DJ, Зиглер С.Ф. STAT6 регулирует развитие эозинофильной астмы по сравнению с нейтрофильной астмой в ответ на Alternaria alternata. J Immunol. 2016; 197 (12): 4541–51. pmid: 27815425
- 22.
Ким Д.В., Халмуратова Р., Хур Д.Г., Чон С.И., Ким С.В., Шин Х.В. и др. Энтеротоксин B Staphylococcus aureus способствует индукции полиповидных поражений носа на мышиной модели с аллергическим риносинуситом.
