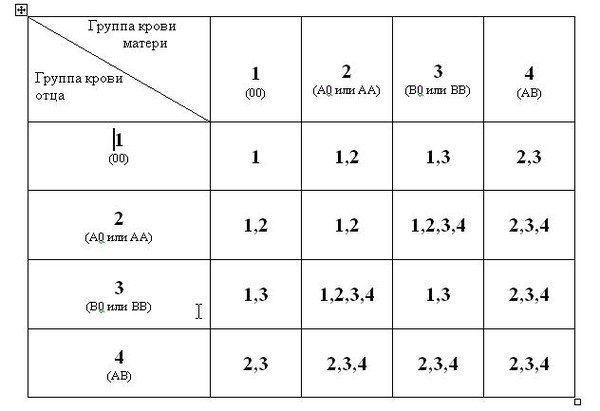
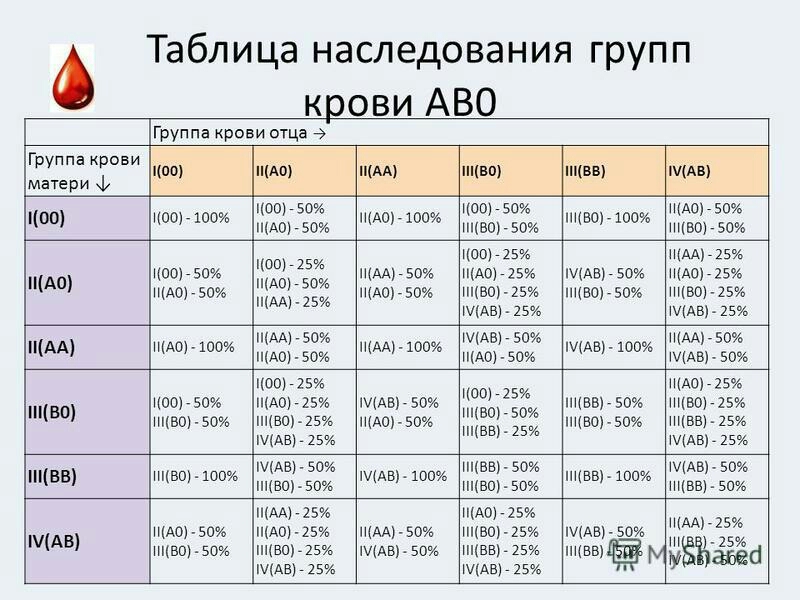
Мама 1 отрицательная папа 2 положительная: Какая группа крови будет у ребенка?
Беременность и роды с ВИЧ
about hiv
С беременностью и родами часто связано много вопросов и переживаний. Когда беременность протекает на фоне ВИЧ-инфекции, вопросов становится еще больше. Если женщина узнает о положительном ВИЧ-статусе и о беременности одновременно, ответы на все эти вопросы нужно найти как можно быстрее. «СПИД.ЦЕНТР» собрал такие вопросы и дает на них понятные ответы.
Неужели при ВИЧ вообще можно иметь детей?!
Разумеется! При приеме антиретровирусных (АРВ) препаратов можно зачать, выносить и родить здорового ребенка — риск передачи ему ВИЧ будет минимальным. Это справедливо и для дискордантных пар (когда только один из партнеров живет с ВИЧ), и для случаев, когда оба партнера ВИЧ-положительные. Ключевой момент — правильно принимать АРВ-терапию и добиться неопределяемой вирусной нагрузки у матери, а также применять другие профилактические меры. Без специальной профилактики риск передачи ВИЧ от матери ребенку составляет 20–40 %, а по некоторым данным, даже до 80 %, но профилактические меры снижают его до 1–2 %.
Как ВИЧ может передаваться от матери к ребенку?
Вирус может передаваться через кровь, влагалищный секрет и грудное молоко. Риск внутриутробной передачи возрастает на поздних сроках беременности и особенно во время родов. При прохождении по родовым путям матери ребенок непосредственно контактирует с ее кровью и влагалищным отделяемым, из которых вирус через микротравмы на коже ребенка может проникнуть в его организм.
ВИЧ плохо проникает через плацентарный барьер и редко передается на ранних сроках беременности. Поэтому, даже если в момент зачатия женщина не принимала АРВТ и имела высокую вирусную нагрузку, это совсем не значит, что ребенок будет инфицирован. Но очень важно начать принимать антиретровирусные препараты как можно раньше, чтобы к поздним срокам беременности и родам добиться неопределяемой вирусной нагрузки. А от грудного вскармливания нужно будет отказаться полностью, даже при приеме АРВТ.
ВИЧ может передаваться от отца?
Новорожденному ребенку ВИЧ может передаваться только от матери при родах, грудном вскармливании или во время беременности. Если на момент зачатия отец ребенка имел ВИЧ-положительный статус, но мать при этом остается ВИЧ-отрицательной, для ребенка риск передачи вируса отсутствует. Однако, если заражение матери в момент зачатия произошло и ВИЧ-инфекция начинает развиваться вместе с беременностью, это может увеличить риск передачи вируса ребенку. На ранних этапах развития ВИЧ-инфекции вирусная нагрузка у матери может быть очень высокой — именно это и увеличивает риск передачи вируса ребенку.
Если на момент зачатия отец ребенка имел ВИЧ-положительный статус, но мать при этом остается ВИЧ-отрицательной, для ребенка риск передачи вируса отсутствует. Однако, если заражение матери в момент зачатия произошло и ВИЧ-инфекция начинает развиваться вместе с беременностью, это может увеличить риск передачи вируса ребенку. На ранних этапах развития ВИЧ-инфекции вирусная нагрузка у матери может быть очень высокой — именно это и увеличивает риск передачи вируса ребенку.
Если женщина имела незащищенный секс с ВИЧ-положительным человеком, нужно обязательно провести курс постконтактной профилактики (ПКП) вне зависимости от наступления беременности.
Что нужно учитывать при зачатии людям, живущим с ВИЧ?
Если оба партнера имеют ВИЧ-положительный статус, принимают АРВ-терапию и имеют неопределяемую вирусную нагрузку, обычно прибегают к зачатию естественным путем. При этом остается потенциальный риск передачи резистентного штамма от одного партнера другому. Чтобы его полностью исключить, можно прибегнуть к рекомендациям для дискордантных пар (см.
Для дискордантных пар, когда ВИЧ-положительный статус есть только у одного партнера, есть особые рекомендации.
Если мать ВИЧ-отрицательная, а отец ВИЧ-положительный
При прочих равных условиях риски ВИЧ-инфекции для принимающего партнера всегда выше. И в этом случае зачатие будет нести риск инфицирования для матери. Устойчивое подавление вирусной нагрузки у отца — обязательное условие для зачатия ребенка. Помимо этого, риск заражения матери можно снизить следующими способами (способы перечислены в порядке увеличения надежности):
-
Практиковать незащищенный секс только в дни овуляции. Такой подход повышает вероятность зачатия и снижает число сексуальных контактов, которые для этого нужны. А со снижением числа незащищенных контактов снижается и риск инфицирования. При этом важно, чтобы у партнеров не было других заболеваний половой сферы (например, ИППП, эрозии шейки матки и т.д.), так как они повышают риск передачи ВИЧ.
Очень важно продолжить использование презервативов уже после зачатия — некоторые пары, практикуя незащищенный секс для зачатия, продолжают так и после, что может привести к заражению ВИЧ-отрицательного партнера в будущем. Этот способ зачатия несет самый высокий потенциальный риск заражения для женщины, и нужно очень тщательно обдумать готовность партнеров к таким рискам.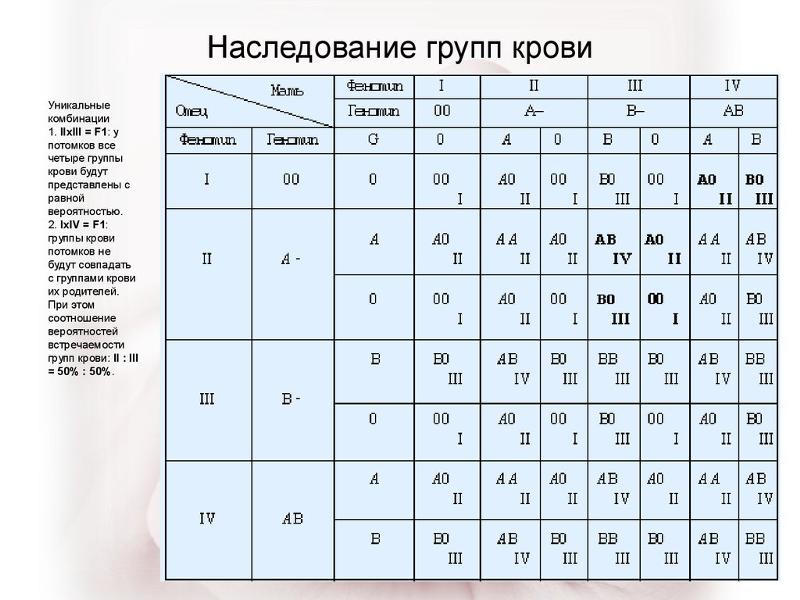
-
Искусственная инсеминация. В этом случае предварительно собранную сперму вводят во влагалище шприцем (без иглы), также в дни овуляции. При этом риск инфицирования немного снижается: нет вагинального секса — нет микротравм слизистой оболочки влагалища, через которые в организм проникают вирусные частицы. Однако этот способ также нельзя назвать надежным для защиты партнера от инфицирования.
-
Очистка спермы. Вирусные частицы содержатся только в семенной жидкости, но не в самих сперматозоидах. Поэтому можно отделить сперматозоиды от семенной жидкости, протестировать их на отсутствие вирусных частиц и после этого ввести во влагалище.
 Такую процедуру проводят в специализированных клиниках, потенциальный риск заражения женщины при этом минимальный, на практике случаев заражения зарегистрировано не было.
Такую процедуру проводят в специализированных клиниках, потенциальный риск заражения женщины при этом минимальный, на практике случаев заражения зарегистрировано не было. -
ЭКО (экстракорпоральное оплодотворение). В этом случае яйцеклетку матери оплодотворяют очищенными сперматозоидами отца «в пробирке» и затем подсаживают в матку полученный эмбрион. При такой процедуре полностью исключается контакт матери с биологическими жидкостями отца, и риски заражения практически отсутствуют.
При использовании любого из этих способов следует помнить, что на 100 % исключить потенциальный риск заражения женщины невозможно. А первые два способа несут довольно высокие риски, и прибегать к ним стоит только в крайнем случае, тщательно обдумав свое решение.
Если мать ВИЧ-положительная, а отец ВИЧ-отрицательный
В этом случае самый простой и при этом безопасный способ — введение спермы во влагалище с помощью обычного пластикового шприца (без иглы).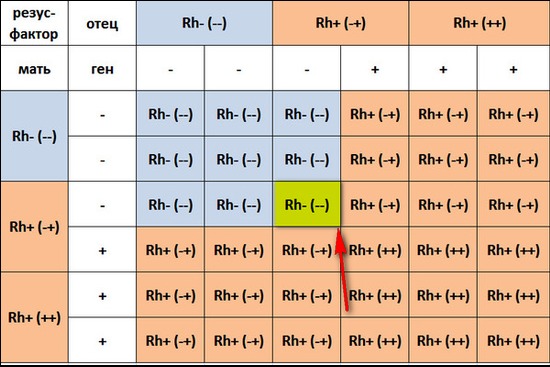 Сперму можно собрать, используя презерватив (без спермицидной смазки!) или чистый пластиковый контейнер для биоматериала. Собранную сперму вводят шприцем глубоко во влагалище в дни овуляции. Риск заражения для отца при этом полностью отсутствует.
Сперму можно собрать, используя презерватив (без спермицидной смазки!) или чистый пластиковый контейнер для биоматериала. Собранную сперму вводят шприцем глубоко во влагалище в дни овуляции. Риск заражения для отца при этом полностью отсутствует.
Опасна ли беременность при ВИЧ-положительном статусе для матери?
К настоящему времени нет никаких данных о том, что беременность ухудшает или ускоряет развитие ВИЧ-инфекции, или протекает тяжелее при ВИЧ-положительном статусе матери. Важно подобрать и правильно принимать адекватную АРВ-терапию, и течение беременности почти ничем не будет отличаться от беременности при ВИЧ-отрицательном статусе.
Насколько безопасна АРВТ при беременности?
К сожалению, абсолютно безопасных лекарств не бывает. И при назначении любого препарата врач всегда исходит из соотношения потенциального риска и потенциальной пользы. Когда речь идет о предотвращении передачи ВИЧ-инфекции, потенциальная польза, безусловно, перевешивает. Терапия современными антиретровирусными препаратами имеет очень хороший профиль безопасности как для матери, так и для ребенка. Если вы сомневаетесь, стоит ли начинать АРВТ при беременности, боитесь побочных эффектов терапии или ее негативного влияния на ребенка, помните, что на другой чаше весов при этом лежит высокий риск передать ВИЧ-инфекцию ребенку — а это многократно опаснее побочных эффектов терапии.
Терапия современными антиретровирусными препаратами имеет очень хороший профиль безопасности как для матери, так и для ребенка. Если вы сомневаетесь, стоит ли начинать АРВТ при беременности, боитесь побочных эффектов терапии или ее негативного влияния на ребенка, помните, что на другой чаше весов при этом лежит высокий риск передать ВИЧ-инфекцию ребенку — а это многократно опаснее побочных эффектов терапии.
Не все антиретровирусные препараты можно назначать беременным. Хорошая новость в том, что после многочисленных клинических исследований для многих АРВ-препаратов была доказана их безопасность при беременности — они не влияют на рост и развитие ребенка и не угрожают нормальному течению беременности. Именно такие препараты и используются в схемах терапии при беременности. Конкретную схему всегда подбирает врач, учитывая другие особенности состояния здоровья матери и течения беременности.
Опасными для ребенка могут быть не только АРВ-препараты сами по себе, но и побочные реакции на терапию у матери, особенно в случае тяжелых побочных реакций или непереносимости препарата.
Современная АРВ-терапия не вредит течению беременности и развитию ребенка и предотвращает передачу вируса от матери, поэтому очень важна для рождения здорового ребенка.
Когда нужно начинать АРВТ?
Если до начала беременности женщина не принимала АРВТ, ее обычно начинают на 13–14 неделях беременности. К этому моменту заканчивается формирование основных органов у плода, и риски влияния АРВ-препаратов на развитие ребенка становятся минимальными. Однако, если у матери очень низкий уровень CD4-клеток (менее 350/мкл) или очень высокая вирусная нагрузка (более 100 тыс. копий на мл), терапию начинают незамедлительно. При низком уровне CD4-клеток существенно повышается риск развития опасных оппортунистических инфекций, которые сами по себе будут серьезной угрозой для беременности и ребенка.
Затягивать начало терапии позже 14-й недели опасно. Чтобы защитить ребенка от ВИЧ-инфекции, к моменту родов нужно добиться устойчиво низкой вирусной нагрузки у матери. После начала терапии вирусная нагрузка снижается постепенно, поэтому, начиная терапию позже 14-й недели, можно не успеть добиться неопределяемой нагрузки к моменту родов.
Если своевременно начать терапию не удалось, это стоит сделать в любом случае, как только появится такая возможность, даже на поздних сроках беременности, даже когда начались схватки. Любое снижение вирусной нагрузки все равно снизит риск передачи инфекции ребенку и будет полезным.
Нужно ли корректировать схему терапии при беременности, если я уже ее принимаю?
Если вы уже принимаете антиретровирусные препараты и планируете беременность, обязательно обсудите это с врачом. Не все антиретровирусные препараты можно принимать беременным, поэтому в некоторых случаях врач предложит поменять схему. Может оказаться, что ваша схема уже состоит из препаратов, разрешенных при беременности, тогда менять ничего не придется.
Может оказаться, что ваша схема уже состоит из препаратов, разрешенных при беременности, тогда менять ничего не придется.
Если схему все же нужно поменять, безопаснее всего будет сначала убедиться в том, что новая схема хорошо переносится и дает устойчивое подавление вирусной нагрузки, и после этого планировать беременность. Обычно это становится понятно в течение 1–3 месяцев после начала приема новой схемы.
Если беременность обнаружили уже на фоне приема АРВТ и на сроке больше 1-го триместра, менять схему большого смысла нет.
Какая схема АРВТ самая лучшая?
Какой-то одной идеальной схемы терапии для всех беременных не существует. Врач подбирает схему индивидуально, учитывая особенности здоровья каждой женщины.
Основой схемы АРВТ для беременных чаще всего становится зидовудин, так как его применение при беременности изучено лучше всего и накоплен большой практический опыт.
В качестве терапии первой линии обычно назначают следующие комбинации: зидовудин (или абакавир, или тенофовир) + ламивудин (или эмтрицитабин) + лапинавир/ритонавир (или атазанавир/ритонавир или эфавиренц).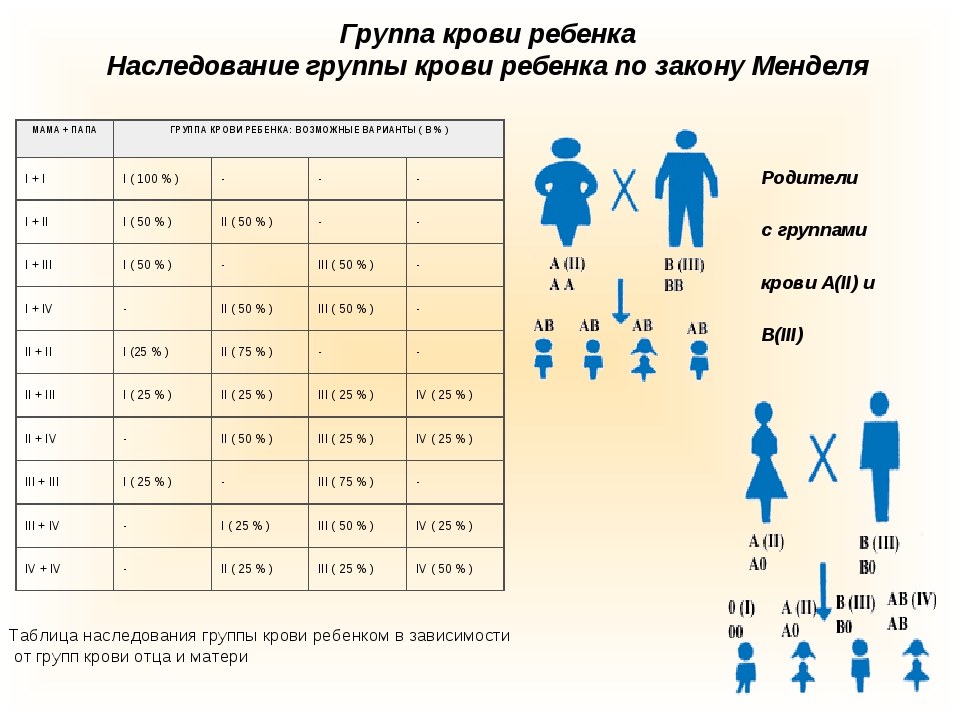
В некоторых случаях возможно применение альтернативных схем, включающих невирапин, фосфазид, дарунавир, саквинавир. Вне зависимости от конкретной комбинации в схеме обязательно используют не менее трех антиретровирусных препаратов. При позднем начале терапии и/или очень высокой вирусной нагрузке врач может добавить ралтегравир как дополнительный компонент.
Некоторые препараты, наоборот, стараются для беременных не применять или назначают с ограничениями. Например, эфавиренз нежелательно использовать до 8–9 недели беременности — есть данные о его негативном влиянии на формирование нервной трубки у плода. Также лучше не назначать диданозин и ставудин или сразу три препарата из группы нуклеозидных ингибиторов обратной транскриптазы (НИОТ) — это повышает риск развития лактацидоза. Не рекомендуется применять индинавир из-за риска развития мочекаменной болезни и повышения уровня билирубина.
Какую бы схему терапии не применяли при беременности, во время родов или при кесаревом сечении обязательно внутривенно вводят зидовудин.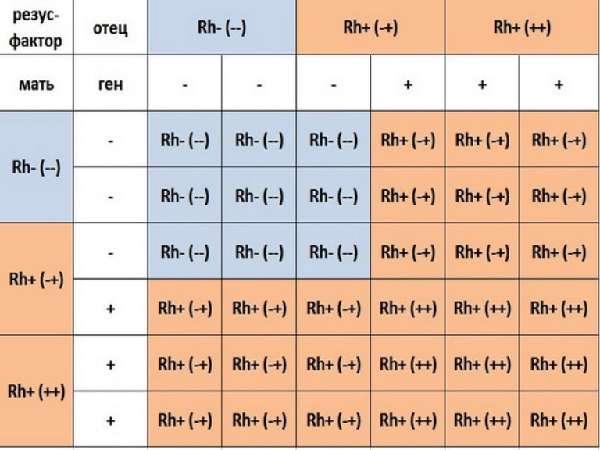
Какие анализы нужно сдавать во время беременности?
Каких-то специальных анализов для ВИЧ-положительных беременных нет. Проводят все обычные исследования как при беременности у ВИЧ-отрицательных женщин, а также стандартное определение вирусной нагрузки и уровня CD4-клеток, на которые регулярно тестируют всех ВИЧ-положительных людей.
Однако при беременности регулярно контролировать вирусную нагрузку особенно важно — ведь ее повышение при неэффективной АРВТ создает прямую угрозу передачи вируса ребенку. Поэтому, чем раньше будет обнаружен рост вирусной нагрузки и скорректирована схема терапии, тем ниже потенциальный риск передачи вируса ребенку. Также важно контролировать некоторые биохимические показатели крови: уровень глюкозы, уровень билирубина, активность ферментов печени, уровень молочной кислоты и так далее. Конкретный набор показателей зависит от назначенной схемы терапии и определяется врачом. Если у беременной начнет развиваться какой-то опасный побочный эффект АРВ-терапии, биохимический контроль позволит обнаружить его на раннем этапе и скорректировать схему АРВТ, пока он не начал угрожать течению беременности или развитию ребенка.
Некоторые исследования могут повышать риск передачи ВИЧ от матери к плоду, и их не стоит делать ВИЧ-положительным беременным. Например, амниоцентез, кордоцентез, биопсия ворсин хориона и другие инвазивные исследования.
Можно перестать принимать терапию после родов?
Всемирная Организация Здравоохранения (ВОЗ) рекомендует подход «test-and-treat» — то есть начинать антиретровирусную терапию сразу после подтверждения ВИЧ-инфекции, независимо от уровня вирусной нагрузки или состояния иммунитета и продолжать на протяжение всей жизни. Беременность этот подход не отменяет, то есть терапию нужно продолжать и после рождения ребенка.
Лишь в некоторых случаях, когда доступ к антиретровирусным препаратам сильно ограничен, терапию можно назначить только на период беременности и родов и затем отменить, если уровень CD-4 клеток у материи более 500/мм3. Но это — исключительные случаи, прерывание терапии всегда несет риск развития резистентности.
Самой рожать или кесарево?
Если к моменту родов неопределяемой вирусной нагрузки достичь не удалось или АРВТ не проводилась вообще, риск передачи ВИЧ-инфекции можно снизить, сделав кесарево сечение. В этом случае ребенок не будет проходить по родовым путям и контактировать с кровью матери, что значительно снижает риски заражения. Важно, чтобы кесарево сечение было плановым, то есть проводилось до начала отхождения околоплодных вод. Если воды уже отошли, проведение кесарева сечения значимо не снизит риск передачи вируса ребенку.
В этом случае ребенок не будет проходить по родовым путям и контактировать с кровью матери, что значительно снижает риски заражения. Важно, чтобы кесарево сечение было плановым, то есть проводилось до начала отхождения околоплодных вод. Если воды уже отошли, проведение кесарева сечения значимо не снизит риск передачи вируса ребенку.
Если во время беременности удалось достичь неопределяемой вирусной нагрузки или снизить ее до уровня менее 1000 копий/мл, можно рожать естественным путем. То есть в этом случае ВИЧ-положительный статус матери никак не влияет на выбор между естественными родами или кесаревым сечением.
Нужна ли какая-то профилактика для ребенка?
Детям, рожденным от ВИЧ-положительных матерей, независимо от вирусной нагрузки матери на момент родов, обычно назначают профилактический прием антиретровирусных препаратов в течение нескольких недель. Терапию начинают сразу после родов, схема и дозировка подбирается врачом индивидуально. Чаще всего используют зидовудин в форме сиропа в течение 28 дней.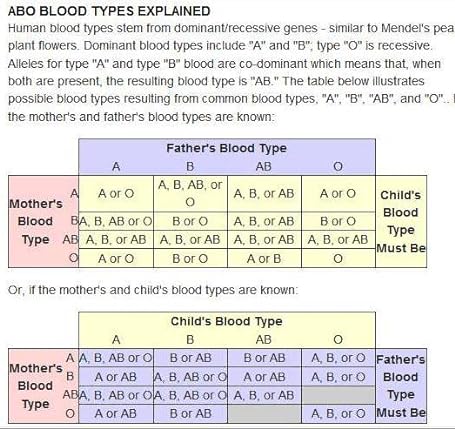
Если есть дополнительные риски, например мать не принимала АРВТ во время беременности или на момент родов была очень высокая вирусная нагрузка, то дополнительно к зидовудину обычно назначают невирапин и ламивудин.
Грудью вообще нельзя кормить?
Категорически — нет. Грудное вскармливание должно быть полностью исключено. ВИЧ содержится в грудном молоке, а также может передаваться ребенку через микротравмы и трещины на сосках. Прикладывать ребенка нельзя и к пустой груди — даже когда молока нет, риск передачи вируса через микротрещины соска остается. Кормить сцеженным молоком тоже нельзя.
Если ВИЧ-инфекция у матери обнаружена уже в период грудного вскармливания, его нужно прекратить. Ребенку назначают профилактический курс антиретровирусных препаратов и проводят анализы на ВИЧ-инфекцию.
Почему нельзя кормить грудью, если принимаешь АРВТ?
Нулевая вирусная нагрузка при приеме АРВТ в крови не гарантирует полного отсутствия вируса в грудном молоке. Поэтому потенциальный риск передачи вируса с грудным молоком остается даже при приеме терапии. Кроме этого, многие антиретровирусные препараты и продукты их метаболизма выделяются с грудным молоком и могут быть вредны для ребенка. Даже если мать принимает препараты, разрешенные для применения у детей, их концентрация в молоке может оказаться опасно высокой для ребенка.
Поэтому потенциальный риск передачи вируса с грудным молоком остается даже при приеме терапии. Кроме этого, многие антиретровирусные препараты и продукты их метаболизма выделяются с грудным молоком и могут быть вредны для ребенка. Даже если мать принимает препараты, разрешенные для применения у детей, их концентрация в молоке может оказаться опасно высокой для ребенка.
Когда можно точно узнать, что ВИЧ-инфекция не передалась ребенку?
«Обычный» анализ на ВИЧ (методом ИФА) у ребенка, рожденного ВИЧ-положительной матерью, в первые месяцы жизни всегда будет положительным. Ведь в этом анализе определяется не сам вирус, а антитела в нему, а у ребенка в крови будут антитела матери. Поэтому детям проводят анализ методом ПЦР — он позволяет обнаружить в крови РНК самого вируса. ПЦР обычно проводят в первые два дня после рождения, затем через месяц и потом — еще через три месяца. Материнские антитела полностью исчезают из крови ребенка к 18 месяцам — в этом возрасте делают ИФА.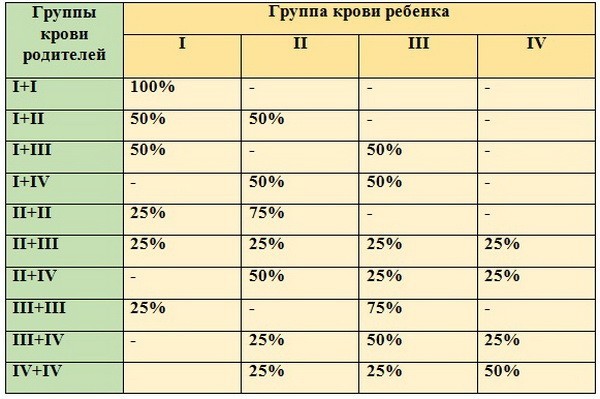
Отрицательный результат ПЦР на второй день после родов говорит о том, что ребенок НЕ заразился во время беременности. Отрицательная ПЦР через месяц указывает на то, что ребенок, скорее всего, НЕ заразился и во время родов. Отрицательная ПЦР в возрасте старше 4 месяцев говорит о том, что ребенок практически наверняка НЕ заразился ВИЧ. Окончательное подтверждение этого дает отрицательный результат ИФА в 1,5 года.
Положительный результат любой ПЦР указывает на возможное заражение ребенка ВИЧ. В этом случае проводят дополнительные исследования для окончательного подтверждения диагноза. Если ВИЧ все же передался ребенку, ему назначают АРВ-терапию, которая позволит прожить долгую полноценную жизнь и иметь собственных детей в будущем.
let’s become friends?
- footer.viber
- read
- join
- read
read also
Диета и ВИЧ: что нужно знать?
Каковы основные принципы здорового питания при ВИЧ. Какие нужно принимать витамины. Что нельзя ес…
Какие нужно принимать витамины. Что нельзя ес…
Как устроена антиретровирусная терапия?
Как работают АРВТ-препараты. Что такое ингибиторы обратной транскриптазы, интегразы, протеазы – и…
Резус-гемолитическая болезнь — StatPearls — NCBI Bookshelf
Программа непрерывного образования
Резус-гемолитическая болезнь развивается в результате зачатия резус-отрицательной женщиной резус-положительного плода и может вызывать у плода широкий спектр симптомов. новорожденный. Ранняя диагностика и профилактика имеют решающее значение в этом состоянии, особенно при известных высоких показателях неонатальной смертности, если оно остается невыявленным. В этом задании описываются патофизиология, оценка и лечение резус-гемолитической болезни, а также роль межпрофессиональной команды в уходе за такими пациентами и улучшении результатов в отношении здоровья во всем мире.
Цели:
Опишите этиологию резус-гемолитической болезни.

Рассмотрите клиническую картину пациентов с резус-гемолитической болезнью.
Опишите тактику ведения пациентов с резус-гемолитической болезнью.
Обобщить важность сотрудничества и коммуникации между межпрофессиональной командой для улучшения координации лечения пациентов с резус-гемолитической болезнью.
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Введение
Резус-фактор (резус-фактор) представляет собой поверхностный антиген эритроцитов. Термин «резус» был придуман после того, как он был впервые обнаружен у макак-резусов. Система группы крови Rh состоит из нескольких антигенов (более 50), но D, C, c, E и e являются наиболее распространенными идентифицированными антигенами.[1] Антиген D в основном ответственен за резус-инфекцию из-за его высокой иммуногенности. Человек может быть резус-положительным или резус-отрицательным в зависимости от наличия или отсутствия антигена D на поверхности эритроцитов соответственно.
Резус-гемолитическая болезнь, также известная как резус-несовместимость, представляет собой состояние, которое возникает, когда женщина с резус-отрицательной группой крови подвергается воздействию резус-положительных клеток крови, что приводит к выработке анти-D-антител посредством процесса, называемого изоиммунизацией. . После этой сенсибилизации эти материнские аллоантитела (иммуноглобулины IgG) могут сохраняться на всю жизнь и свободно перемещаться через плаценту в кровоток плода во время последующих беременностей, где они приводят к разрушению эритроцитов плода после образования комплексов антиген-антитело с их поверхностным D-антигеном. Это приводит к аллоиммунной гемолитической анемии у плода, известной как фетальный эритробластоз. Тяжесть заболевания во многом зависит от количества иммуноглобулинов, гестационного возраста и ферментативной активности плода.[2]
При невыявленном заболевании высока смертность новорожденных, составляющая 24%. Универсальный родительский скрининг на резус-фактор и профилактическое лечение иммуноглобулином с резус-фактором значительно снизили уровень неонатальной смертности [3].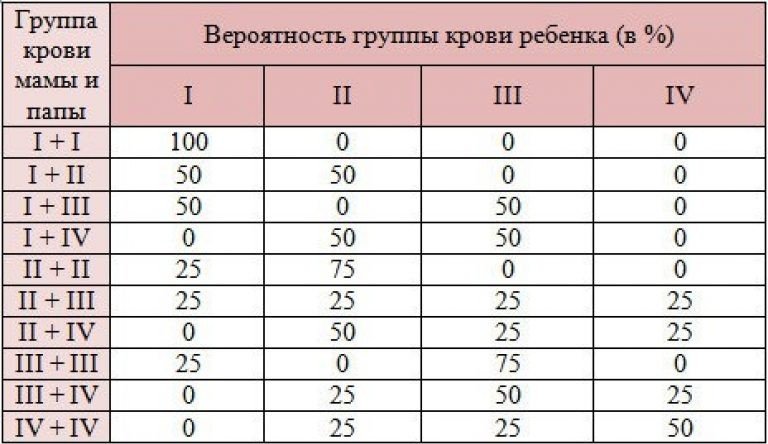
Этиология
Существуют две основные причины резус-гемолитической болезни. Во-первых, контакт резус-отрицательной беременной матери с резус-положительными эритроцитами плода из-за фетоматеринского кровотечения во время беременности, вызванного нормальными родами, самопроизвольным или искусственным абортом, внематочной беременностью, предлежанием плаценты, отсутствием дородового ухода, инвазивными акушерскими процедурами (кордоцентез). , забор ворсин хориона, амниоцентез), наружный головной вариант, кесарево сечение или травма.
После сенсибилизации матери в связи с образованием анти-D IgG иммуноглобулинов при будущих беременностях существует риск развития гемолитической болезни новорожденных (ГБН) из-за резус-несовместимости, если плод является резус-положительным.[ 4] Эти IgG-антитела могут проникать через плаценту и вызывать гемолиз, вызывая тяжелую анемию плода и гипербилирубинемию, что может привести к неврологическому повреждению или смерти. Во-вторых, менее распространенной причиной резус-несовместимости является переливание резус-положительной крови резус-отрицательной женщине, особенно в экстренных случаях.
Эпидемиология
Различная распространенность людей с отрицательным резус-фактором по всему миру оказала значительное влияние на заболеваемость во всем мире. 15 % белых (североамериканцы и европейцы) оказываются резус-отрицательными, в то время как только 4–8 % африканцев и от 0,1 до 0,3 % азиатов имеют резус-отрицательную группу крови. Несмотря на значительное снижение зарегистрированных случаев резус-гемолитической болезни благодаря надлежащему пренатальному скринингу и профилактике, 276 новорожденных на 100 000 живорождений в год по-прежнему страдают во всем мире, особенно в развивающихся странах.[5]
На юго-западе США уровень заболеваемости в 1,5 раза выше, чем в среднем по стране, вероятно, из-за иммиграционных факторов. Риск смерти и мертворождений составляет 24% и 11% соответственно среди этих пораженных новорожденных, в то время как у 13 % пораженных новорожденных развивается ядерная желтуха с самыми высокими зарегистрированными показателями смертности в регионе Восточной Европы/Центральной Азии: 38 смертей на 100 000 живорождений.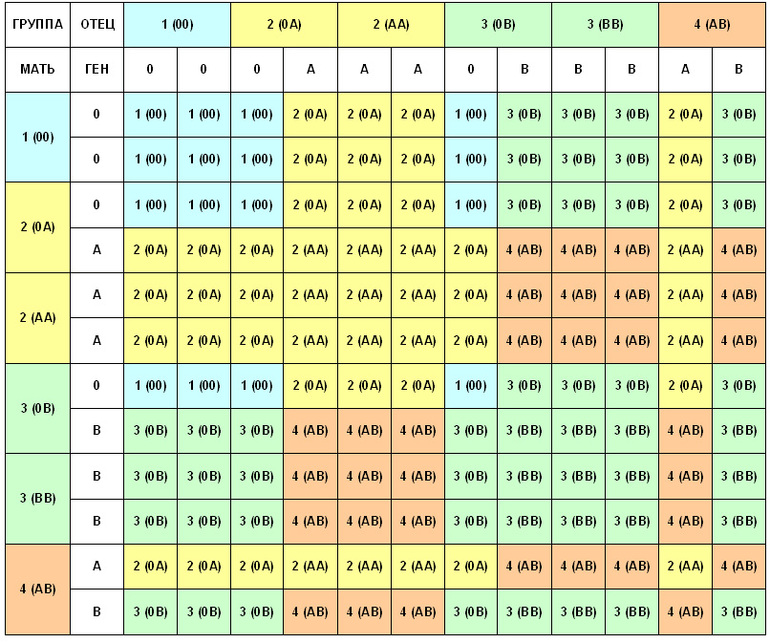 [6] ] Наличие сосуществующей несовместимости по системе АВО резко снижает заболеваемость этой гемолитической болезнью из-за присутствия анти-А/анти-В антител против плода в материнской сыворотке.
[6] ] Наличие сосуществующей несовместимости по системе АВО резко снижает заболеваемость этой гемолитической болезнью из-за присутствия анти-А/анти-В антител против плода в материнской сыворотке.
Патофизиология
Сенсибилизация матери зависит от множества факторов, включая объем трансплацентарного кровотечения, степень материнского иммунного ответа и одновременное наличие АВО-несовместимости. Он поражает 17% беременных женщин с 1 мл резус-положительных клеток и 70% после воздействия 250 мл резус-положительных клеток.[7] Когда резус-положительные эритроциты плода попадают в кровообращение матери после разрыва хориона эмбриона, который обычно разделяет кровообращение плода и матери, иммунная система резус-отрицательных женщин рассматривает эти клетки как чужеродные и вызывает первичный иммунный ответ, первоначально продуцируя IgM-антитела.
Как правило, при первой беременности при Rh-D-опосредованном заболевании не наблюдается никаких эффектов, поскольку IgM представляет собой большой пентамер, который не может преодолевать плацентарный барьер. Однако во время следующих беременностей последующее воздействие всего 0,03 мл резус-положительных клеток может привести к образованию иммуноглобулинов анти-D IgG, которые свободно проникают через плаценту и связываются с эритроцитами плода, содержащими D-поверхностный антиген. Эти покрытые антителами клетки распознаются ретикулоэндотелиальной системой плода, и разрушение этих клеток вызывает выброс большого количества билирубина в кровоток плода. В антенатальном периоде материнские ферменты конъюгации удаляют избыток билирубина, но после рождения из-за ранней недостаточности ферментативной активности глюкуронилтрансферазы у новорожденных возникают желтуха или ядерная желтуха и тяжелая гемолитическая анемия.
Однако во время следующих беременностей последующее воздействие всего 0,03 мл резус-положительных клеток может привести к образованию иммуноглобулинов анти-D IgG, которые свободно проникают через плаценту и связываются с эритроцитами плода, содержащими D-поверхностный антиген. Эти покрытые антителами клетки распознаются ретикулоэндотелиальной системой плода, и разрушение этих клеток вызывает выброс большого количества билирубина в кровоток плода. В антенатальном периоде материнские ферменты конъюгации удаляют избыток билирубина, но после рождения из-за ранней недостаточности ферментативной активности глюкуронилтрансферазы у новорожденных возникают желтуха или ядерная желтуха и тяжелая гемолитическая анемия.
Histopathology
In Rh-hemolytic disease of the newborn, the following changes are seen in the peripheral blood smear:
Polychromasia
Anisocytosis
Erythroblasts
No spherocytes
Анамнез и медицинский осмотр
Подробный анамнез относительно резус-группы крови матери и отца, предшествующих переливаний крови, предыдущих беременностей, особенно с резус-гемолитической болезнью в анамнезе, травм или инвазивных акушерских процедур, самопроизвольных или искусственных абортов и введения резус-IgG. осторожно. Физикальное обследование зависит от тяжести заболевания.
осторожно. Физикальное обследование зависит от тяжести заболевания.
Новорожденные с легкой резус-гемолитической болезнью проявляют только легкую желтуху в течение первых нескольких дней постнатальной жизни. Они восстанавливаются без каких-либо последующих повреждений. Младенцы с умеренным поражением могут иметь анемию и желтуху одновременно. У новорожденных с тяжелым поражением через несколько дней после родов развивается ядерная желтуха из-за отложения неконъюгированного билирубина в тканях центральной нервной системы. Ядерная желтуха характеризуется потерей ранних неврологических рефлексов, например, рефлекса Моро, рефлекса позы, выпячиванием родничка, выгибанием головы и пяток назад в виде лука, вялым телом, пронзительным криком, плохим питанием и генерализованными тонико-клоническими судорогами. Недоношенные дети более склонны к развитию неврологических нарушений при резус-несовместимости.[8] Примерно у 83% новорожденных с ядерной желтухой в более позднем возрасте развиваются необратимые неврологические нарушения.
Тяжелая резус-гемолитическая болезнь также может вызывать опасное для жизни состояние у младенцев, называемое эритробластозом плода, характеризующееся желтухой и тяжелой гемолитической анемией. Водянка плода — наиболее тяжелая форма эритробластоза плода, которая развивается у младенцев с выраженной бледностью, гематокритом менее 5 и связана с более чем 50% смертностью.[9][10] У новорожденных с данной патологией отмечаются следующие симптомы: генерализованные отеки, плевральный или перикардиальный выпот, сердечная недостаточность высокого выброса, экстрамедуллярное кроветворение.
Оценка
Первым шагом в оценке является определение резус-группы крови у каждой беременной женщины в соответствии с рекомендациями Целевой группы профилактических служб США (USPSTF).
Если женщина резус-положительна, дальнейшее тестирование не требуется. Если женщина резус-отрицательна, вторым этапом является определение наличия анти-D-антител в сыворотке крови матери сначала с помощью качественного теста с розеткой, а затем с помощью количественного теста Клейхауэра-Бетке. Это подтверждающий тест для количественного определения титров антител, особенно при большом кровотечении (> 30 мл крови), рекомендованный Американским колледжем акушеров и гинекологов (ACOG). Тест Кумбса используется для подтверждения, если титры антител положительны. Уровень титров антител должен быть менее 1:16, более высокий уровень требует дальнейшего серийного амниоцентеза, начатого уже в 16-20 недель, для определения резус-статуса плода.
Это подтверждающий тест для количественного определения титров антител, особенно при большом кровотечении (> 30 мл крови), рекомендованный Американским колледжем акушеров и гинекологов (ACOG). Тест Кумбса используется для подтверждения, если титры антител положительны. Уровень титров антител должен быть менее 1:16, более высокий уровень требует дальнейшего серийного амниоцентеза, начатого уже в 16-20 недель, для определения резус-статуса плода.
Наблюдение за плодом зависит от резус-положительного плода. Обычно это делается с помощью серийных УЗИ органов малого таза, доплеровской допплерографии пупочной артерии и средней мозговой артерии (СМА) для наблюдения за ростом плода, если резус-отрицательная мать вынашивает резус-положительный плод. Допплер МСА в основном используется для скрининга анемии у резус-положительных плодов. Обычно его проводят каждые 1-2 недели, начиная с 24-й недели беременности, с использованием пиковой систолической скорости (ПСС) в качестве основного параметра, поскольку она увеличивается у анемичных плодов. [11] Уровень ПСВ >1,5 мес требует дальнейшего изучения.
[11] Уровень ПСВ >1,5 мес требует дальнейшего изучения.
Отрицательный результат тестирования на антитела также требует тестирования отца на резус-фактор. Если отец резус-отрицательный, то больше никаких анализов не требуется. Наоборот, если отец является гетерозиготным резус-положительным, вероятность того, что плод будет резус-отрицательным или положительным, составляет 50%. Таким образом, в таких случаях или когда группировка по отцовскому резус-фактору невозможна, требуется генотипирование резус-фактора плода либо неинвазивными, либо инвазивными методами. Неинвазивное генотипирование RHD плода проводится в первые 12 недель беременности путем взятия образца крови матери, и эта процедура оказалась 97% точности со специфичностью и чувствительностью 93% и 100% соответственно при определении резус-статуса.[12] Амниоцентез и биопсия ворсин хориона являются предпочтительными инвазивными процедурами для анализа ДНК плода с целью разработки плана лечения в будущем.[13]
Если женщина поступает в отделение неотложной помощи для родов без каких-либо предварительных пренатальных исследований, то берутся образцы крови из пуповины младенца для определения группы крови и резус-типа, измерения гематокрита, уровня гемоглобина и анализа сывороточного билирубина. Прямая проба Кумбса также проводится для подтверждения диагноза гемолитической анемии, вызванной антителами, которая чаще возникает из-за резус-несовместимости, чем из-за несовместимости по системе АВО. Повышенный билирубин, низкий гематокрит и высокое количество ретикулоцитов могут указывать на необходимость раннего обменного переливания крови.
Прямая проба Кумбса также проводится для подтверждения диагноза гемолитической анемии, вызванной антителами, которая чаще возникает из-за резус-несовместимости, чем из-за несовместимости по системе АВО. Повышенный билирубин, низкий гематокрит и высокое количество ретикулоцитов могут указывать на необходимость раннего обменного переливания крови.
Визуализирующие исследования включают в основном УЗИ органов малого таза, которое может показать признаки асцита плода, отек мягких тканей, отек скальпа, плевральный и перикардиальный выпот, кардиомегалию и гепатомегалию с портальной гипертензией в случае тяжело пораженного плода.
Лечение/управление
Иммуноглобулины Rh (RhIVIG), введенные около пятидесяти лет назад, доказали свою исключительную эффективность в качестве основного профилактического лечения при резус-несовместимости. После этого изобретения в 19 г.68, наблюдалось значительное снижение заболеваемости резус-гемолитической болезнью наряду со снижением уровня смертности на две трети в общенациональном эпиднадзоре.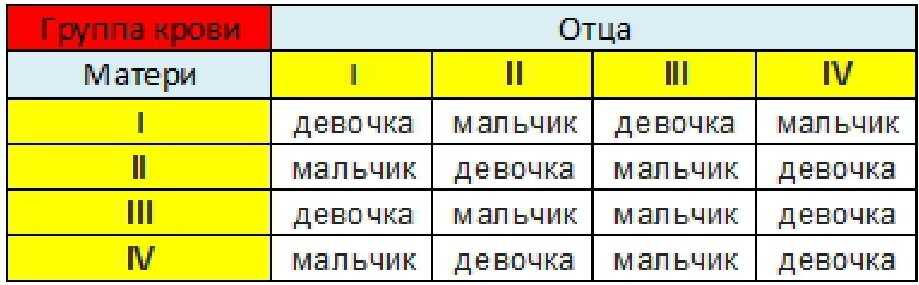 [14] Как обсуждалось ранее, его вводят всем резус-отрицательным женщинам только в том случае, если аллоиммунизация не проводилась, а вынашивание резус-положительного плода осуществляется либо с профилактической целью, либо после аборта или внутриутробного кровотечения. Он обладает способностью покрывать эритроциты плода, имеющие поверхностный антиген D, образуя комплексы антиген-антитело, которые перемещаются через плаценту до активации иммунной системы матери. Имея короткий период полувыведения — 3 месяца, его вводят однократно в течение 28–32 недель антенатально, а затем в послеродовом периоде в течение 72 часов после рождения ребенка в стандартной дозе 300 мкг (1500 МЕ) на каждые 30 мл цельная кровь плода, подвергающаяся воздействию материнского кровообращения. Тем не менее, дозу можно корректировать в зависимости от степени кровоизлияния путем оценки фетальных эритроцитов в материнском кровотоке с помощью теста Кляйхауэра-Бетке, поскольку гемоглобин F устойчив к кислотному вымыванию [15].
[14] Как обсуждалось ранее, его вводят всем резус-отрицательным женщинам только в том случае, если аллоиммунизация не проводилась, а вынашивание резус-положительного плода осуществляется либо с профилактической целью, либо после аборта или внутриутробного кровотечения. Он обладает способностью покрывать эритроциты плода, имеющие поверхностный антиген D, образуя комплексы антиген-антитело, которые перемещаются через плаценту до активации иммунной системы матери. Имея короткий период полувыведения — 3 месяца, его вводят однократно в течение 28–32 недель антенатально, а затем в послеродовом периоде в течение 72 часов после рождения ребенка в стандартной дозе 300 мкг (1500 МЕ) на каждые 30 мл цельная кровь плода, подвергающаяся воздействию материнского кровообращения. Тем не менее, дозу можно корректировать в зависимости от степени кровоизлияния путем оценки фетальных эритроцитов в материнском кровотоке с помощью теста Кляйхауэра-Бетке, поскольку гемоглобин F устойчив к кислотному вымыванию [15]. В случае аборта (<13 недель) следует ввести мини-дозу 50 мкг (250 МЕ) и полную стандартную дозу в случае выкидыша.
В случае аборта (<13 недель) следует ввести мини-дозу 50 мкг (250 МЕ) и полную стандартную дозу в случае выкидыша.
Фототерапия может использоваться для лечения желтухи. Однако использование высоких доз ВВИГ значительно сократило продолжительность лечения фототерапией.[16] [17]
Внутриутробное переливание крови зависит от тяжести анемии у плода, которая может быть точно оценена антенатально с помощью допплерографии ПСВ средней мозговой артерии, которая имеет чувствительность и специфичность в прогнозировании любой степени анемии 88,46% и 98,27% соответственно.[11] Постнатальный уровень гематокрита <30% является показанием к переливанию крови. Эти переливания могут быть выполнены внутрисосудистым путем, предпочтительно, или внутрибрюшинным путем в качестве альтернативы.
Дифференциальный диагноз
Резус-гемолитическая болезнь проявляется клинически желтухой, анемией, а сыворотка указывает на неконъюгированную гипербилирубинемию. Билирубин конъюгирован для выведения из организма с помощью UDP-глюкуронозилтрансферазы (UGT) 1A1. Дефицит фермента UGT1A1 или избыточное производство билирубина ответственны за это состояние.[18] Таким образом, первым шагом является дифференцирование физиологической желтухи от других причин патологической желтухи. Физиологическая желтуха, проявляющаяся на второй или третий день постнатальной жизни, имеет уровень билирубина менее 12 мг/дл, что на 20% чаще встречается у недоношенных детей, и обычно проходит в течение первой недели без каких-либо последствий. Желтуха в первые 24 часа после рождения или при значительном повышении уровня билирубина является патологией и требует детального исследования.
Дефицит фермента UGT1A1 или избыточное производство билирубина ответственны за это состояние.[18] Таким образом, первым шагом является дифференцирование физиологической желтухи от других причин патологической желтухи. Физиологическая желтуха, проявляющаяся на второй или третий день постнатальной жизни, имеет уровень билирубина менее 12 мг/дл, что на 20% чаще встречается у недоношенных детей, и обычно проходит в течение первой недели без каких-либо последствий. Желтуха в первые 24 часа после рождения или при значительном повышении уровня билирубина является патологией и требует детального исследования.
Наиболее распространенной причиной патологической гипербилирубинемии является желтуха, вызванная грудным молоком, из-за вероятного дефицита калорий у этих детей, находящихся на грудном вскармливании, и влияния грудного молока на ферментную систему УДФ-глюкуронилтрансферазы.[19]
Другими важными причинами этой физиопатологии являются несовместимость по системе АВО, наследственный сфероцитоз, наследственный дефицит ферментов, материнское кровотечение, трансфузионный синдром близнецов, талассемия, особенно альфа-талассемия, и тромботические микроангиопатии. Исследования для дифференциации этих состояний от резус-несовместимости включают общий анализ крови с дифференциалом, мазок периферической крови, уровни конъюгированного и неконъюгированного билирубина, функциональные пробы печени (сывороточная аланинаминотрансфераза, аспартатаминотрансфераза, гамма-глутамилтрансфераза, щелочная фосфатаза и уровень альбумина), сыворотка крови. маркеры крови для дифференциации причин внутрисосудистого гемолиза от внесосудистых (например, уровень лактатдегидрогеназы, уровень гемосидерина в крови и моче, уровень гаптоглобина), количество ретикулоцитов, RDW (ширина распределения эритроцитов), а также прямой и непрямой тест Кумбса.
Исследования для дифференциации этих состояний от резус-несовместимости включают общий анализ крови с дифференциалом, мазок периферической крови, уровни конъюгированного и неконъюгированного билирубина, функциональные пробы печени (сывороточная аланинаминотрансфераза, аспартатаминотрансфераза, гамма-глутамилтрансфераза, щелочная фосфатаза и уровень альбумина), сыворотка крови. маркеры крови для дифференциации причин внутрисосудистого гемолиза от внесосудистых (например, уровень лактатдегидрогеназы, уровень гемосидерина в крови и моче, уровень гаптоглобина), количество ретикулоцитов, RDW (ширина распределения эритроцитов), а также прямой и непрямой тест Кумбса.
Прогноз
Введение Rho (D) иммуноглобулина значительно снизило заболеваемость резус-гемолитической болезнью. Согласно исследованию, уровень заболеваемости этой гемолитической болезнью снизился с 40,5% до 14,3% на 10 000 рождений в течение первого десятилетия введения ВВИГ.[20]
Доступность расширенного антенатального скрининга, современных диагностических методов и ультрасовременных учреждений интенсивной терапии, особенно в развитых странах, таких как США, снизили распространенность резус-гемолитической болезни и связанную с ней смертность до минимальный уровень. Однако, как упоминалось ранее, показатели по-прежнему относительно выше в развивающихся странах и составляют около 276 младенцев и новорожденных на 100 000 живорождений. Смертность у новорожденных с отечными признаками относительно выше, чем у новорожденных без отечности.
Однако, как упоминалось ранее, показатели по-прежнему относительно выше в развивающихся странах и составляют около 276 младенцев и новорожденных на 100 000 живорождений. Смертность у новорожденных с отечными признаками относительно выше, чем у новорожденных без отечности.
Осложнения
Ранний выкидыш или внутриутробная гибель плода из-за гидропических изменений плода[21] реакцию материнского организма. Это приводит к снижению насыщения кислородом и задержке созревания легких в пренатальном периоде и цианозу с высоким выбросом сердечной недостаточности в постнатальном периоде за счет компенсаторных изменений кардиомиоцитов вследствие снижения кислородной емкости крови.
Ядерная желтуха может развиться, поскольку неконъюгированный билирубин может откладываться в центральной нервной системе новорожденного, вызывая неврологическую дегенерацию, которая может сохраняться в более позднем возрасте даже у 83% новорожденных после разрешения анемии и желтухи.
 [6]
[6]Потенциальный рецидив осложнений у будущих детей матери
Сдерживание и обучение пациентов
Связь предотвратимой резус-болезни с высокой внутриутробный скрининг и иммунопрофилактика в третьем триместре, чтобы этого избежать. Улучшение доступа к медицинскому обслуживанию облегчило специалистам здравоохранения раннюю диагностику резус-статуса родителей, и это сильно изменило общий результат.
Улучшение результатов медицинского обслуживания
Для улучшения результатов лечения необходимы крепкие отношения между врачом и пациентом. Сотрудничество между членами межпрофессиональной бригады, в которую в основном входят акушер-гинеколог, главный врач и медсестры. Предотвратимый характер этого заболевания требует от специалистов точного обследования и скрининга как матери, так и отца в течение первого триместра, а также тщательного контроля титров антител резус-отрицательных женщин. Эти уровни антител должны быть <1:16, и если они превышают это, проводится инвазивное тестирование для соответствующего лечения. Критическое наблюдение за плодом с помощью допплерографии СМА дает точное представление об анемии плода, указывая на необходимость внутриутробного переливания или нет [22].
Критическое наблюдение за плодом с помощью допплерографии СМА дает точное представление об анемии плода, указывая на необходимость внутриутробного переливания или нет [22].
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Каталожные номера
- 1.
Avent ND, Reid ME. Система резус-групп крови: обзор. Кровь. 2000 15 января; 95 (2): 375-87. [PubMed: 10627438]
- 2.
Nassar GN, Wehbe C. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 27 июня 2022 г. Эритробластоз плода. [В паблике: 30020664]
- 3.
Ципурский А. Всеобщая профилактика резус-иммунизации. Клин Обстет Гинекол. 1971 Сентябрь; 14 (3): 869-84. [PubMed: 5003669]
- 4.
Urbaniak SJ, Greiss MA. RhD-гемолитическая болезнь плода и новорожденного. Blood Rev. 2000 март; 14(1):44-61.
 [PubMed: 10805260]
[PubMed: 10805260]- 5.
Зипурский А., Павел В.К. Глобальное бремя резус-болезни. Arch Dis Child Fetal Neonatal Ed. 2011 март; 96 (2): F84-5. [В паблике: 21037283]
- 6.
Бхутани В.К., Зипурски А., Бленков Х., Ханна Р., Сгро М., Эббезен Ф., Белл Дж., Мори Р., Слашер Т.М., Фахми Н., Пол В.К., Ду Л., Около А.А., де Алмейда М.Ф. , Олусанья Б.О., Кумар П., Кузенс С., Лоун Д.Э. Неонатальная гипербилирубинемия и резус-болезнь новорожденных: оценки заболеваемости и нарушений на 2010 г. на региональном и глобальном уровнях. Педиатр Рез. 2013 декабрь; 74 Приложение 1 (Приложение 1): 86-100. [Бесплатная статья PMC: PMC3873706] [PubMed: 24366465]
- 7.
Хартвелл Э.А. Использование резус-иммуноглобулина: практический параметр ASCP. Американское общество клинических патологов. Ам Джей Клин Патол. 1998 г., сен; 110 (3): 281–92. [PubMed: 9728602]
- 8.
CROSSE VM, MEYER TC, GERRARD JW. Ядерная желтуха и недоношенность.
 Арч Дис Чайлд. 1955 Декабрь; 30 (154): 501-8. [Бесплатная статья PMC: PMC2011823] [PubMed: 13275980]
Арч Дис Чайлд. 1955 Декабрь; 30 (154): 501-8. [Бесплатная статья PMC: PMC2011823] [PubMed: 13275980]- 9.
Hendrickson JE, Delaney M. Гемолитическая болезнь плода и новорожденного: современная практика и будущие исследования. Transfus Med Rev. 2016 Oct;30(4):159-64. [PubMed: 27397673]
- 10.
Czernik C., Proquitté H, Metze B, Bührer C. Hydrops fetalis – произошли ли изменения в диагностическом спектре и смертности? J Matern Fetal Neonatal Med. 2011 фев; 24 (2): 258-63. [PubMed: 20446894]
- 11.
Андрей С, Владаряну Р. Значение референтных диапазонов пиковой систолической скорости средней мозговой артерии при ведении резус-аллоиммунизированных беременностей. Медика (Букур). 2012 Январь;7(1):14-9. [Бесплатная статья PMC: PMC3484790] [PubMed: 23118814]
- 12.
Cardo L, García BP, Alvarez FV. Неинвазивное генотипирование плода RHD в I триместре беременности. Clin Chem Lab Med. 2010 авг; 48 (8): 1121-6.
 [PubMed: 20482298]
[PubMed: 20482298]- 13.
Страуструп А., Плафкин С., Савиц Д.А. Влияние осведомленности врача на диагностику фетоматеринского кровотечения. Неонатология. 2014;105(4):250-5. [Бесплатная статья PMC: PMC4012333] [PubMed: 24526231]
- 14.
Высовски Д.К., Флинт Дж.В., Голдберг М.Ф., Коннелл Ф.А. резус-гемолитическая болезнь. Эпидемиологический надзор в США с 1968 по 1975 год. JAMA. 1979 г., 28 сентября; 242(13):1376-9. [PubMed: 113567]
- 15.
Ким Ю.А., Макар Р.С. Выявление фетоматеринского кровотечения. Am J Гематол. 2012 г., апрель 87(4):417-23. [PubMed: 22231030]
- 16.
Готтштейн Р., Кук Р.В. Систематический обзор внутривенного иммуноглобулина при гемолитической болезни новорожденных. Arch Dis Child Fetal Neonatal Ed. 2003 г., январь; 88 (1): F6-10. [Бесплатная статья PMC: PMC1755998] [PubMed: 12496219]
- 17.
Каккар Б., Агравал С., Чоудхри М., Мутукумаравел П.
 Дж., Макру Р.Н., Такур Великобритания. Обменное переливание крови при неонатальной гипербилирубинемии: опыт одного центра из Северной Индии. Transfus Apher Sci. 2019 дек;58(6):102655. [PubMed: 31636029]
Дж., Макру Р.Н., Такур Великобритания. Обменное переливание крови при неонатальной гипербилирубинемии: опыт одного центра из Северной Индии. Transfus Apher Sci. 2019 дек;58(6):102655. [PubMed: 31636029]- 18.
Yueh MF, Chen S, Nguyen N, Tukey RH. Влияние развития, генетики, диеты и ксенобиотиков на неонатальную гипербилирубинемию. Мол Фармакол. 2017 май;91(5):545-553. [Бесплатная статья PMC: PMC5416747] [PubMed: 28283555]
- 19.
Osborn LM, Reiff MI, Bolus R. Желтуха у доношенного новорожденного. Педиатрия. 1984 г., апрель; 73 (4): 520-5. [PubMed: 6709433]
- 20.
Бергер Г.С., Кейт Л. Использование профилактики резус-фактора. Клин Обстет Гинекол. 1982 июнь; 25 (2): 267-75. [PubMed: 6179676]
- 21.
Зипурский А., Бутани В.К. Влияние резус-болезни на глобальную проблему билирубин-индуцированной неврологической дисфункции. Semin Fetal Neonatal Med. 2015 фев; 20(1):2-5. [В паблике: 25582277]
- 22.
Lee L, Nasser J. Допплеровская ультразвуковая оценка анемии плода при аллоиммунизированной беременности. Australas J Ультразвуковая медицина. 2010 ноябрь;13(4):24-27. [Бесплатная статья PMC: PMC5024878] [PubMed: 28191093]
Информация о несовместимости Rh | Гора Синай
Резус-индуцированная гемолитическая болезнь новорожденных; Эритробластоз плода
Резус-несовместимость – это состояние, которое развивается, когда у беременной женщины резус-отрицательная кровь, а у ребенка в ее утробе – резус-положительная кровь.
Антитела от резус-отрицательной матери могут попасть в кровоток ее будущего резус-положительного ребенка, повреждая эритроциты (эритроциты). В ответ младенец увеличивает выработку эритроцитов и выпускает незрелые эритроциты, в которых еще есть ядра. На этой фотографии показаны нормальные эритроциты, поврежденные эритроциты и незрелые эритроциты, которые все еще содержат ядра.
В ответ младенец увеличивает выработку эритроцитов и выпускает незрелые эритроциты, в которых еще есть ядра. На этой фотографии показаны нормальные эритроциты, поврежденные эритроциты и незрелые эритроциты, которые все еще содержат ядра.
Желтуха новорожденных (вызывающая пожелтение кожи) может иметь множество причин, но у большинства таких младенцев наблюдается состояние, называемое физиологической желтухой, естественное явление у новорожденных из-за незрелой печени. Этот тип желтухи является кратковременным, как правило, длится всего несколько дней. Желтуха должна оцениваться врачом до тех пор, пока в крови не будет измерено снижение или нормальный уровень билирубина.
Антигены — это большие молекулы (обычно белки) на поверхности клеток, вирусы, грибки, бактерии и некоторые неживые вещества, такие как токсины, химические вещества, лекарства и инородные частицы. Иммунная система распознает антигены и вырабатывает антитела, которые разрушают вещества, содержащие антигены.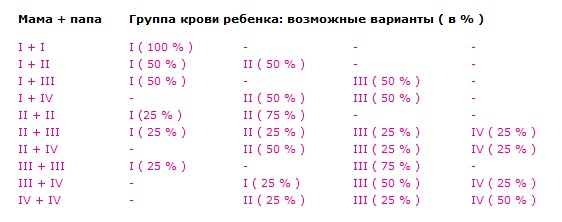
Использование билилайтов — это терапевтическая процедура, проводимая новорожденным или недоношенным детям для снижения повышенного уровня билирубина. Если уровень билирубина в крови становится слишком высоким, билирубин начинает растворяться в тканях организма, вызывая характерную желтуху глаз и кожи. Билирубин также имеет сродство к тканям головного мозга, где он может накапливаться и вызывать необратимое повреждение головного мозга.
Резус-несовместимость возникает, когда группа крови матери имеет отрицательный резус, а группа крови плода положительная.
Причины
Во время беременности эритроциты будущего ребенка могут попасть в кровь матери через плаценту.
Если мать резус-отрицательна, ее иммунная система воспринимает резус-положительные клетки плода как чужеродное вещество. Организм матери вырабатывает антитела против клеток крови плода.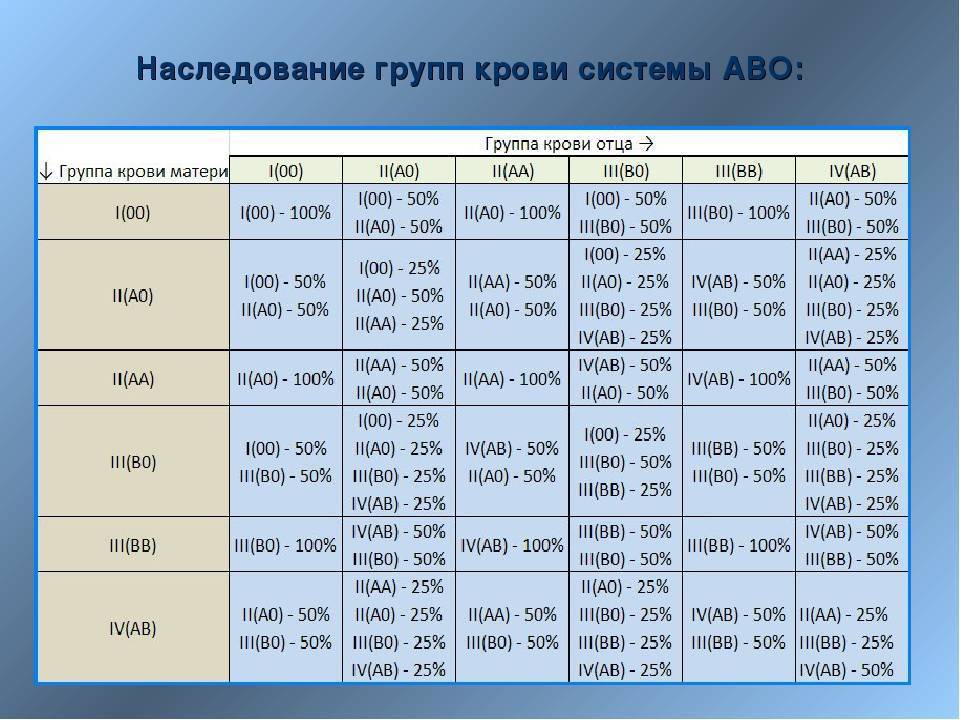 Эти антитела могут вернуться через плаценту к развивающемуся ребенку. Они разрушают циркулирующие эритроциты ребенка.
Эти антитела могут вернуться через плаценту к развивающемуся ребенку. Они разрушают циркулирующие эритроциты ребенка.
При разрушении эритроцитов образуется билирубин. Это приводит к тому, что младенец становится желтым (желтушным). Уровень билирубина в крови младенца может колебаться от умеренного до опасно высокого.
Первенцы часто не болеют, если у матери в прошлом не было выкидышей или абортов. Это повысит чувствительность ее иммунной системы. Это связано с тем, что для выработки антител у матери требуется время. Все дети, которые у нее будут позже, также резус-положительны, могут быть затронуты.
Резус-несовместимость развивается только тогда, когда мать резус-отрицательна, а ребенок резус-положителен. Эта проблема стала менее распространенной в местах, где предоставляется хороший дородовой уход. Это связано с тем, что обычно используются специальные иммунные глобулины, называемые RhoGAM.
Симптомы
Резус-несовместимость может вызывать симптомы от очень легких до смертельных.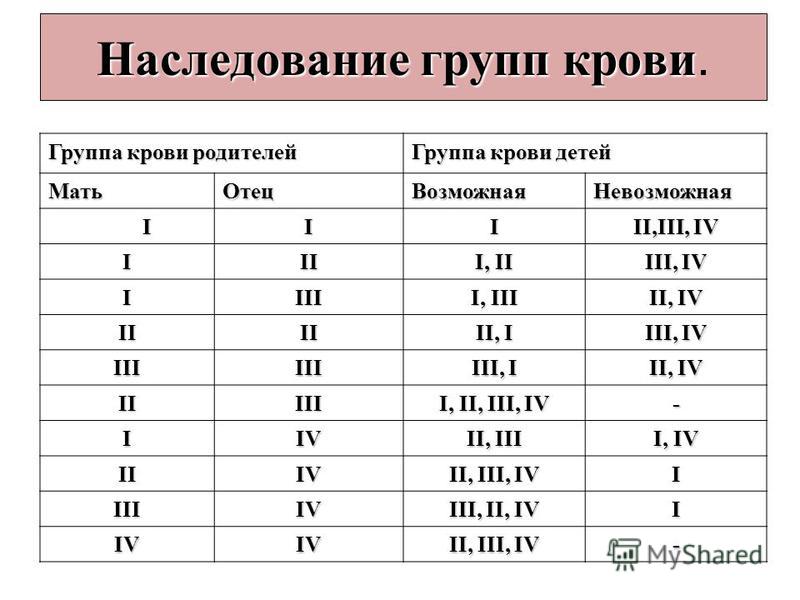 В самой легкой форме резус-несовместимость вызывает разрушение эритроцитов. Других эффектов нет.
В самой легкой форме резус-несовместимость вызывает разрушение эритроцитов. Других эффектов нет.
После рождения у младенца могут быть:
- Пожелтение кожи и белков глаз (желтуха)
- Низкий мышечный тонус (гипотония) и вялость
Обследования и тесты
Перед родами у матери может быть больше амниотической жидкости вокруг ее будущего ребенка (многоводие).
Возможны:
- Положительный результат прямой пробы Кумбса
- Повышение уровня билирубина в пуповинной крови ребенка выше нормы
- Признаки разрушения эритроцитов в крови ребенка
Лечение
Резус-несовместимость можно предотвратить с помощью RhoGAM. Поэтому профилактика остается лучшим лечением. Лечение младенца, который уже поражен, зависит от тяжести состояния.
Поэтому профилактика остается лучшим лечением. Лечение младенца, который уже поражен, зависит от тяжести состояния.
Новорожденных с легкой резус-несовместимостью можно лечить с помощью фототерапии с использованием билирубиновых ламп. Также можно использовать внутривенный иммуноглобулин. Для младенцев с тяжелым поражением может потребоваться обменное переливание крови. Это необходимо для снижения уровня билирубина в крови.
Прогноз (прогноз)
Полное выздоровление ожидается при легкой резус-несовместимости.
Возможные осложнения
Осложнения могут включать:
- Повреждение головного мозга из-за высокого уровня билирубина (ядерная желтуха)
- Скопление жидкости и отек у ребенка (водянка плода)
- Проблемы с психической функцией, движением, слухом, речью и изъятия
Когда обращаться к медицинскому работнику
Позвоните своему поставщику медицинских услуг, если вы думаете или знаете, что беременны, но еще не посещали врача.
Профилактика
Резус-несовместимость практически полностью предотвратима. Медицинские работники должны внимательно следить за резус-отрицательными матерями во время беременности.
Специальные иммунные глобулины, называемые RhoGAM, в настоящее время используются для предотвращения резус-несовместимости у матерей с отрицательным резус-фактором.
Если отец младенца резус-положительный или его группа крови неизвестна, матери делают инъекцию RhoGAM во втором триместре. Если ребенок резус-положительный, мать получит вторую инъекцию в течение нескольких дней после родов.
Эти инъекции предотвращают выработку антител против резус-положительной крови. Тем не менее, женщины с резус-отрицательной группой крови должны получать инъекции:
- Во время каждой беременности
- После выкидыша или аборта
- После пренатальных тестов, таких как амниоцентез и биопсия ворсин хориона
- После травмы живота во время беременности
Каплан М.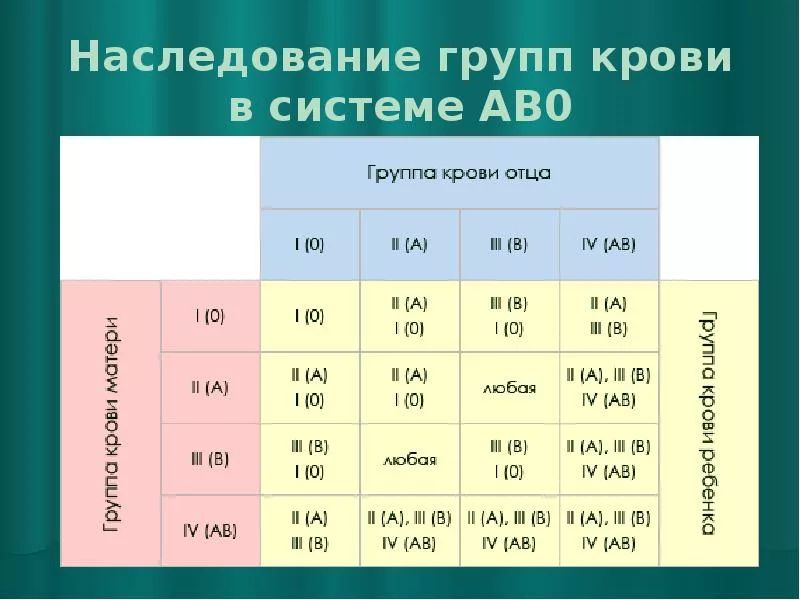 , Вонг Р.Дж., Бергис Дж.К., Сибли Э., Стивенсон Д.К. Желтуха новорожденных и заболевания печени. В: Мартин Р.Дж., Фанарофф А.А., Уолш М.К., ред. Неонатальная и перинатальная медицина Фанарова и Мартина . 11-е изд. Филадельфия, Пенсильвания: Elsevier; 2020: глава 91.
, Вонг Р.Дж., Бергис Дж.К., Сибли Э., Стивенсон Д.К. Желтуха новорожденных и заболевания печени. В: Мартин Р.Дж., Фанарофф А.А., Уолш М.К., ред. Неонатальная и перинатальная медицина Фанарова и Мартина . 11-е изд. Филадельфия, Пенсильвания: Elsevier; 2020: глава 91.
Клигман Р.М., Сент-Геме Д.В., Блюм Н.Дж., Шах С.С., Таскер Р.К., Уилсон К.М. Заболевания крови. В: Kliegman RM, St. Geme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM, eds. Учебник Нельсона по педиатрии . 21-е изд. Филадельфия, Пенсильвания: Elsevier; 2020: глава 124.
Мойзе К.Дж. Аллоиммунизация эритроцитов. В: Landon MB, Galan HL, Jauniaux ERM и др., ред. Акушерство Габбе: нормальная и проблемная беременность . 8-е изд. Филадельфия, Пенсильвания: Elsevier; 2021: глава 40.
Последнее рассмотрение: 02.02.2021
Рецензировал: Нил К. Канеширо, доктор медицинских наук, MHA, клинический профессор педиатрии Медицинской школы Вашингтонского университета, Сиэтл, Вашингтон.