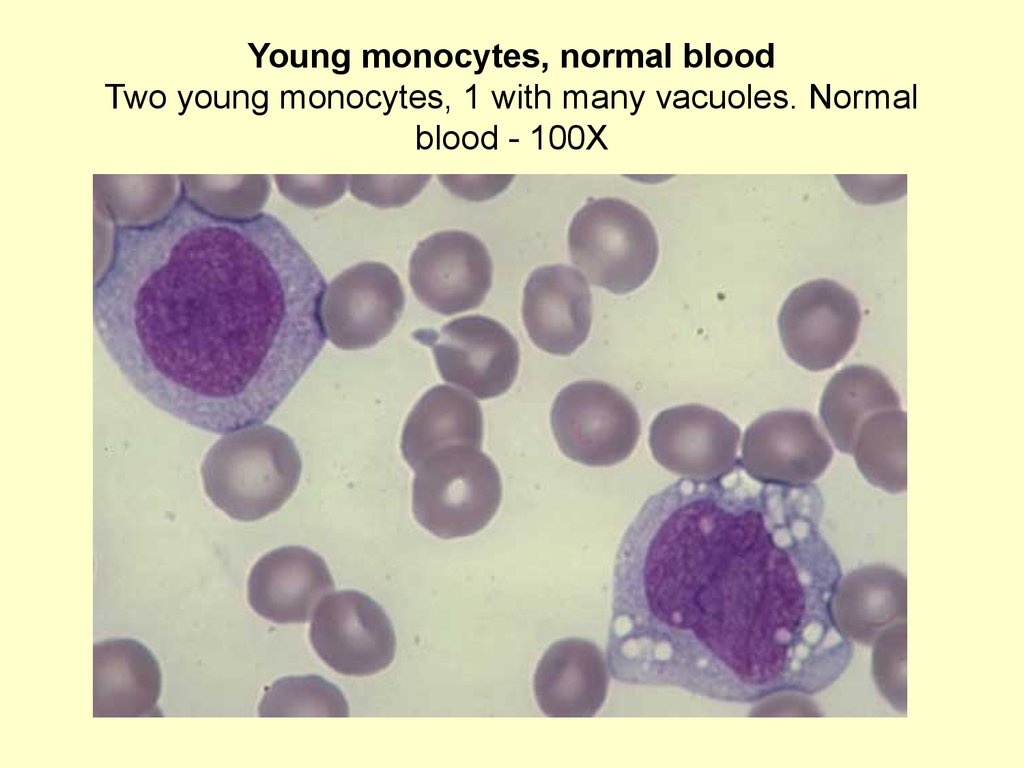
Мононуклеары фото под микроскопом: Мононуклеары в крови фото | Самоцвет
Исследование синовиальной жидкости | Клиническая ревматологическая больница №25
Исследование синовиальной жидкости | Клиническая ревматологическая больница №25Данная процедура проводится для диагностики различных воспалительных заболеваний суставов и дистрофических процессов. Костные и хрящевые образования суставов выстланы синовиальной оболочкой, состоящей из соединительной ткани. Клетки этой оболочки продуцируют и выделяют в полость сустава жидкость – синовиальную, которой присущи такие функции, как метаболическая, локомоторная, трофическая и барьерная, играющие важную роль в реализации функций сустава. Она отражает процессы, происходящие в хрящевой ткани и синовиальной оболочке, быстро реагирует при наличии воспаления в суставе. Синовиальная жидкость является важным компонентом сустава и, в значительной степени, определяет его морфофункциональное состояние.
В норме синовиальной жидкости в суставе умеренное количество, однако при некоторых заболеваниях суставов образуется суставной выпот, который и подвергается исследованию.
Стандартная диагностика синовиальной жидкости включает в себя макроскопический анализ (объем, цвет, вязкость, мутность, муциновый сгусток), подсчет количества клеток, микроскопию нативного препарата, цитологическое исследование окрашенного препарата.
В норме отмечается соломенно-желтый (светло-желтый) цвет жидкости, при этом окраска может оставаться желтой при артритах, анкилозирующем спондилоартрите. При воспалении цвет синовиальной жидкости меняется в зависимости от характера изменений в синовиальной оболочке. Стоит отметить, что при ревматоидном и псориатическом артритах окраска колеблется от желтого до зеленого цветов. При бактериальных или травматических повреждениях окраска синовиальной жидкости может иметь цвет «мясных помоев».
В здоровом суставе синовиальная жидкость является прозрачной. При ревматоидном, псориатическом или септических артритах происходит её помутнение.
Вязкость может значительно колебаться в зависимости от рН, концентрации солей, наличия раннее вводимых в сустав препаратов, а также степени полимеризации гиалуроновой кислоты. Высокий уровень вязкости отмечается при травматических изменениях и системной красной волчанке, а снижение данного показателя чаще отмечается при ревматизме, синдроме Рейтера, ревматоидном, подагрическом и псориатическом артритах, артрозах, анкилозирующем спондилоартрите.
Важная особенность синовиальной жидкости – способность к образованию муцинового сгустка после смешивания с уксусной кислотой, при этом рыхлый сгусток чаще определяется при воспалении в суставе.
В то же время ведущим в определении патологии сустава является микроскопическое исследование синовиальной жидкости.
Важное диагностическое значение имеет подсчет числа клеток в препарате (в норме до 200 клеток/мкл). Увеличение количества клеток (цитоз) позволяет дифференцировать воспалительные и дистрофические заболевания и оценивать динамику воспалительного процесса.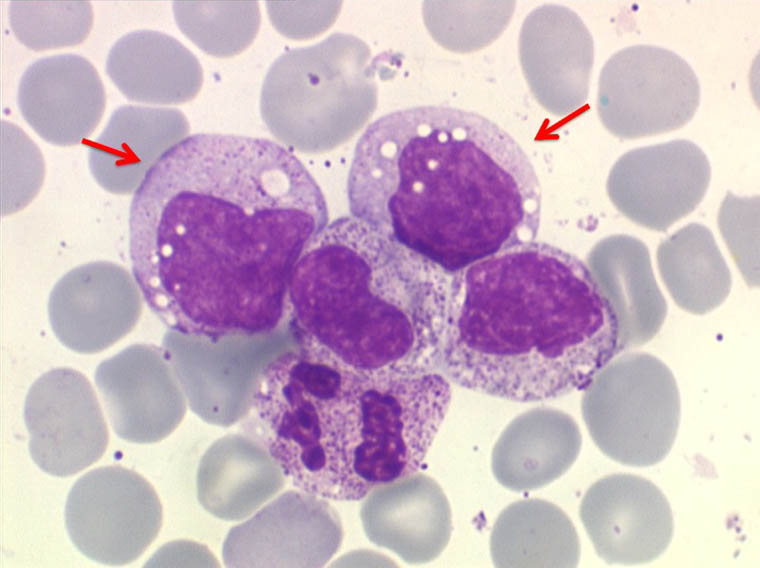 Выраженный цитоз (30.000-50.000) характерен для острого периода воспаления при любых артритах, умеренный цитоз (до 20-30.000) отмечен при псевдоподагре, синдроме Рейтера, псориатическом артрите. Незначительный цитоз характерен преимущественно для микрокристаллических артритов. Цитоз более 50.000 в большинстве случаев указывает на наличие бактериального артрита.
Выраженный цитоз (30.000-50.000) характерен для острого периода воспаления при любых артритах, умеренный цитоз (до 20-30.000) отмечен при псевдоподагре, синдроме Рейтера, псориатическом артрите. Незначительный цитоз характерен преимущественно для микрокристаллических артритов. Цитоз более 50.000 в большинстве случаев указывает на наличие бактериального артрита.
В синовиальной жидкости может быть идентифицировано большое количество разнообразных кристаллов. Однако диагностическую ценность представляют только два типа из них. Кристаллы урата натрия являются признаком подагры, а кристаллы дигидропирофосфата кальция обнаруживаются при псевдоподагре. Эти кристаллы могут быть выявлены при поляризационной микроскопии.
В норме в синовиальной жидкости обнаруживаются и клетки тканевого происхождения (синовиоциты, гистиоциты), а также элементы крови. Это преимущественно лимфоциты, реже – нейтрофилы и моноциты. При воспалении в синовиальной жидкости могут встречаться особые формы нейтрофилов – рагоциты.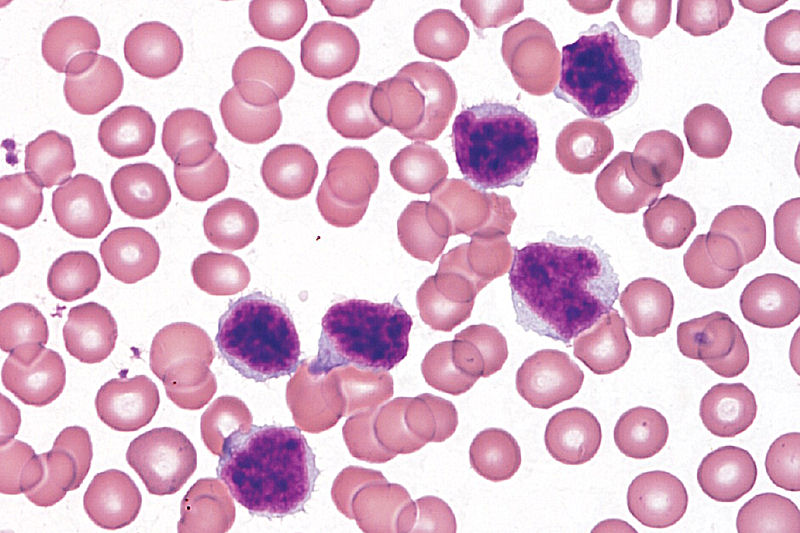 Их клетки имеют “ячеистый” вид за счет включения иммунных комплексов в цитоплазму. Это наиболее характерный признаки при ревматоидном артрите. При некоторых состояниях (аллергические синовиты, туберкулезный процесс, артриты на фоне новообразований) в синовиальной жидкости преобладают мононуклеары.
Их клетки имеют “ячеистый” вид за счет включения иммунных комплексов в цитоплазму. Это наиболее характерный признаки при ревматоидном артрите. При некоторых состояниях (аллергические синовиты, туберкулезный процесс, артриты на фоне новообразований) в синовиальной жидкости преобладают мононуклеары.
Содержание белка в синовиальной жидкости заметно меньше нежели в крови и составляет (10-20г/л). При остеоартрозе и посттравматических артритах значимого повышения протеина не обнаруживается. При воспалительных артропатиях уровень белка в синовиальной жидкости повышается более 20 г/л. Вместе с этим можно отметить повышение уровня лактатдегидрогиназы, острофазовых показателей при воспалительных заболеваниях суставов (чаще С-реактивного белка).
Менее чувствительным маркеров воспаления в суставе является снижение уровня глюкозы, при этом значимое снижение чаще всего отмечается при бактериальных артритах.
При микроскопическом исследовании мазка можно выявить гонококки, хламидии, а также грам-положительные кокки..jpg) Также при микроскопии можно выявить наличие грибкового процесса. Иногда приходиться прибегать к посеву синовиальной жидкости на патогенную микрофлору для уточнения характера инфекционного процесса и определения чувствительности к антибиотикам.
Также при микроскопии можно выявить наличие грибкового процесса. Иногда приходиться прибегать к посеву синовиальной жидкости на патогенную микрофлору для уточнения характера инфекционного процесса и определения чувствительности к антибиотикам.
Исследование синовиальной жидкости остается одним из самых важных диагностических методов при воспалительных заболеваниях суставов. Однако интерпретация данных этого метода должна осуществляться врачом-ревматологом с учетом данных анамнеза, осмотра, а также инструментальных и лабораторных
методов исследования.
Проведение пункции воспаленных суставов и последующее исследование синовиальной жидкости должно проводиться только после консультации ревматолога, которую можно пройти в нашей больнице.
Найти:
Доступная среда
Единый портал
Внимание!
Правила приема передач для пациентов (в строго указанные часы):
понедельник-пятница: с 16:00 до 19:00;суббота-воскресенье: с 10:00 до 12:00 и с 16:00 до 19:00Передачи принимаются в целлофановом пакете.
СанПиН 2.1.3.2630-10 «Санитарно-эпидемиологические требования к организациям, осуществляющим медицинскую деятельность».
СанПиН 2.3.2.1324-03 «Гигиенические требования к срокам годности и условиям хранения пищевых продуктов»)
Администрация СПб ГБУЗ «КРБ № 25»
Телефон отделения платных услуг
670-30-80
пн-пт с 09:00 до 17:00
Время забора крови в отделении платных услуг пн-чт с 09:30 до 14:00
пятница с 09:30 до 13:00.
Имеется возможность проведения обследования за одно посещение. Необходимо предварительно записаться по телефонам отделения платных услуг
Объявление!
Специалистам
Отделения
Наши услуги
Мы лечим
Своевременное обращение к ревматологу способствует более быстрому снижению активности заболевания, снижает вероятность развития осложнений и увеличивает возможность сохранения трудоспособности.
Вы спрашивали…
Версия для слабовидящих
Стационар
Информация о персональных данных авторов обращений, направленных в электронном виде, хранится и обрабатывается с соблюдением требований Российского законодательства о персональных данных. Подробнее…
Администрация Губернатора Санкт-Петербурга проводит комплексный опрос бизнес сообщества в целях оценки условий ведения бизнеса в Санкт-Петербурге и определения направлений совершенствования работы исполнительных органов власти. Подробнее…
Диагностика
Услуги
В Клинической ревматологической больнице №25 вы можете получить медицинскую помощь на платной основе Подробнее…
Микроскопическое исследование синовиальной жидкости
Исследование синовиальной жидкости с описанием ее физико-химических свойств и характеристикой клеточных элементов, котороепроводится для диагностики различных воспалительных заболеваний суставов и дистрофических процессов.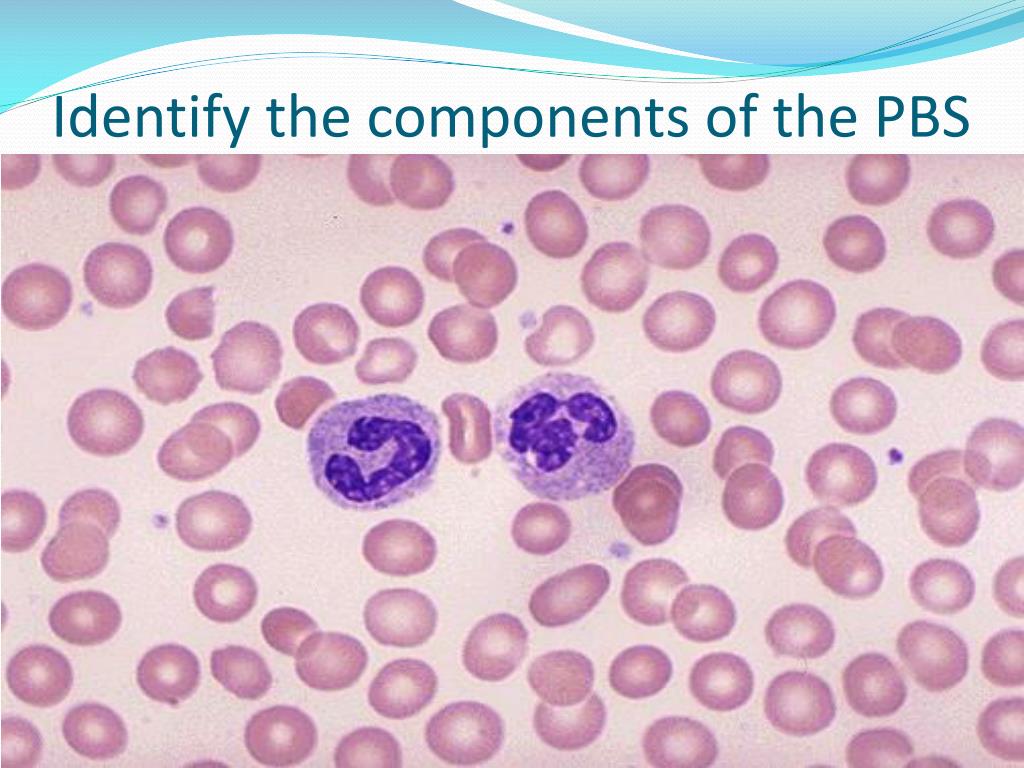
Синонимы русские
- Пункция сустава
- Диагностика артритов
Синонимы английские
- Microscopic examination of synovial fluid
- Synovial fluid examination – Pathology Test
Метод исследования
Микроскопия.
Какой биоматериал можно использовать для исследования?
Синовиальную жидкость.
Общая информация об исследовании
Анализ показан больным с поражением одного или нескольких суставов неясного генеза, проявляющихся болезненностью суставов и их отечностью, в случае когда исследование синовиальной жидкости (СЖ) поможет в постановке диагноза. Анализ включает в себя определение физико-химических свойств жидкости и микроскопическое исследование клеточных элементов. Наиболее серьезным основанием для его назначения является необходимость исключить инфекционный процесс в суставе.
Синовиальная жидкость служит “смазкой” для хрящей и связок. По изменению ее клеточного состава и физико-химических свойств можно судить о патологических процессах в суставе. Например, известно, что синовиальная жидкость в суставах, пораженных остеоартрозом, имеет более низкую вязкость и эластичность, чем синовиальная жидкость в здоровых суставах.
В частности, одним из критериев такого воспалительного заболевания суставов, как подагра, является обнаружение кристаллов мочевой кислоты в синовиальной жидкости. Причем определение мочевой кислоты в синовиальной жидкости имеет большее прогностическое значение, чем анализ сыворотки крови, так как концентрация мочевой кислоты в сыворотке в период острого приступа может быть в пределах нормы, а кристаллы мочевой кислоты в синовиальной жидкости обнаруживаются даже в межприступном периоде.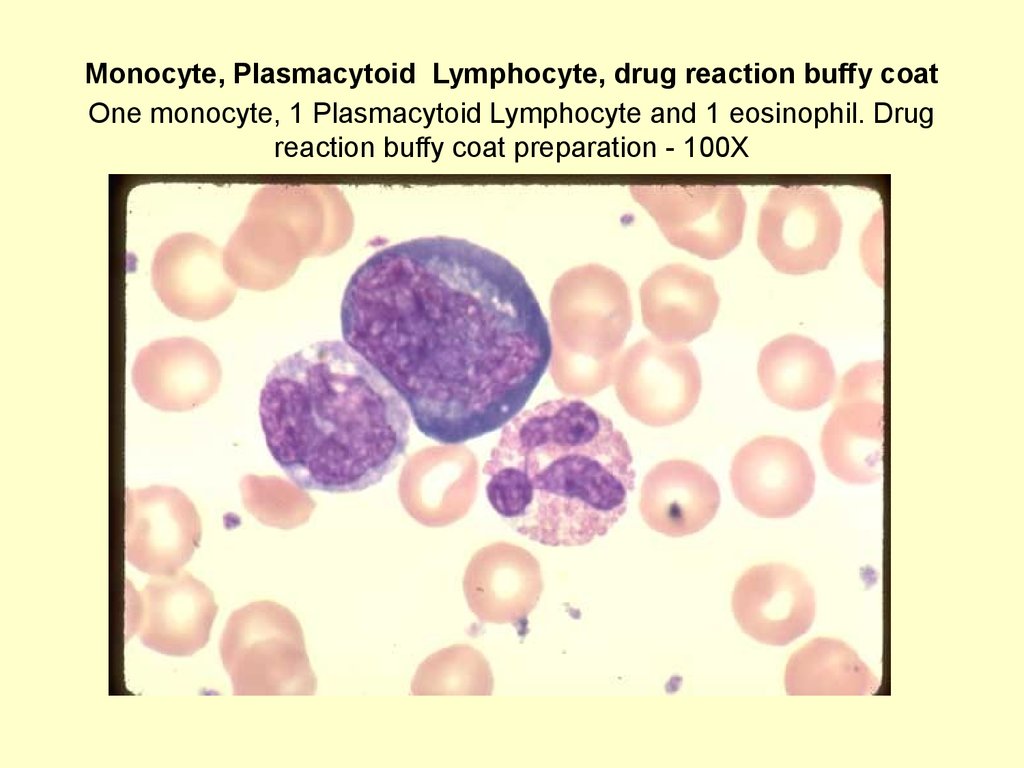
У больных с ревматоидным артритом исследование синовиальной жидкости имеет большое значение для подтверждения диагноза и определения местной активности воспалительного процесса. При ревматоидном артрите количество лейкоцитов в синовиальной жидкости повышается до 25 000 в 1 мкл за счет нейтрофилов (25-90 %), содержание белка достигает 40-60 г/л. В цитоплазме лейкоцитов обнаруживают включения, вакуоли, похожие на кисть винограда (рагоциты). Эти клетки содержат фагоцитированный материал – липидные или белковые вещества, ревматоидный фактор, иммунные комплексы, комплемент. Рагоциты обнаруживают и при других заболеваниях – ревматическом, псориатическом артритах, системной красной волчанке, бактериальных артритах, подагре, – но не в таком количестве, как при ревматоидном артрите.
Наиболее выраженные изменения в синовиальной жидкости обнаруживают при бактериальных артритах. Внешне синовиальная жидкость может иметь вид гноя; содержание клеток достигает 50 000-100 000 в 1 мкл, из них нейтрофилы составляют более 80 %. Иногда в первые 24-48 ч. острого артрита количество клеточных элементов может быть меньше 25 000 в 1 мкл.
Иногда в первые 24-48 ч. острого артрита количество клеточных элементов может быть меньше 25 000 в 1 мкл.
Для чего используется исследование?
- Для диагностики (в том числе дифференциальной) заболеваний суставов,
- для оценки эффективности вне- и внутрисуставной терапии,
- для того чтобы установить степень местной воспалительной активности и характер воспалительного процесса,
- для наблюдения за динамикой патологического процесса в суставах.
Когда назначается исследование?
- При распознавании суставных заболеваний и особенностей их течения, когда синовиальная жидкость есть в избыточных количествах: при выраженной боли в суставах и затрудненности движения, видимом поражении сустава (опухании).
Что означают результаты?
В здоровом суставе синовиальная жидкость является прозрачной. При ревматоидном, псориатическом или септическом артрите происходит ее помутнение.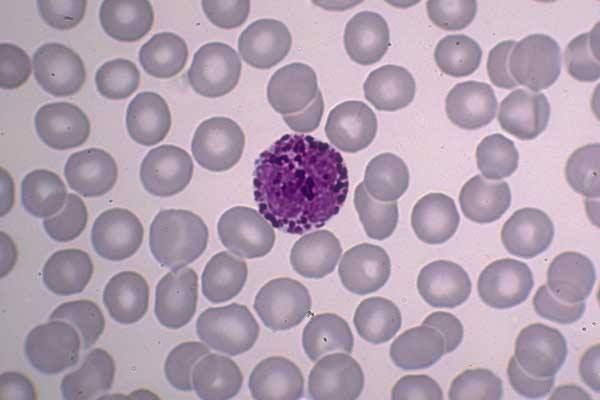
Цвет жидкости в норме светло-желтый. При воспалении он меняется в зависимости от характера изменений в синовиальной оболочке, например, при ревматоидном и псориатическом артрите окраска колеблется от желтого до зеленого цветов.
Число клеток в препарате в норме – до 200 клеток/мкл. Увеличение количества клеток (цитоз) позволяет дифференцировать воспалительные и дистрофические заболевания и оценивать динамику воспалительного процесса. Выраженный цитоз (30 000 – 50 000) характерен для острого периода воспаления при любых артритах, умеренный цитоз (до 20 000 – 30 000) отмечен при псевдоподагре, синдроме Рейтера, псориатическом артрите. Незначительный цитоз характерен преимущественно для микрокристаллических артритов. Цитоз более 50 000 в большинстве случаев указывает на наличие бактериального артрита.
В синовиальной жидкости может быть идентифицировано большое количество разнообразных кристаллов. Однако диагностическую ценность представляют только два типа из них. Кристаллы урата натрия являются признаком подагры, а кристаллы дигидропирофосфата кальция обнаруживаются при псевдоподагре.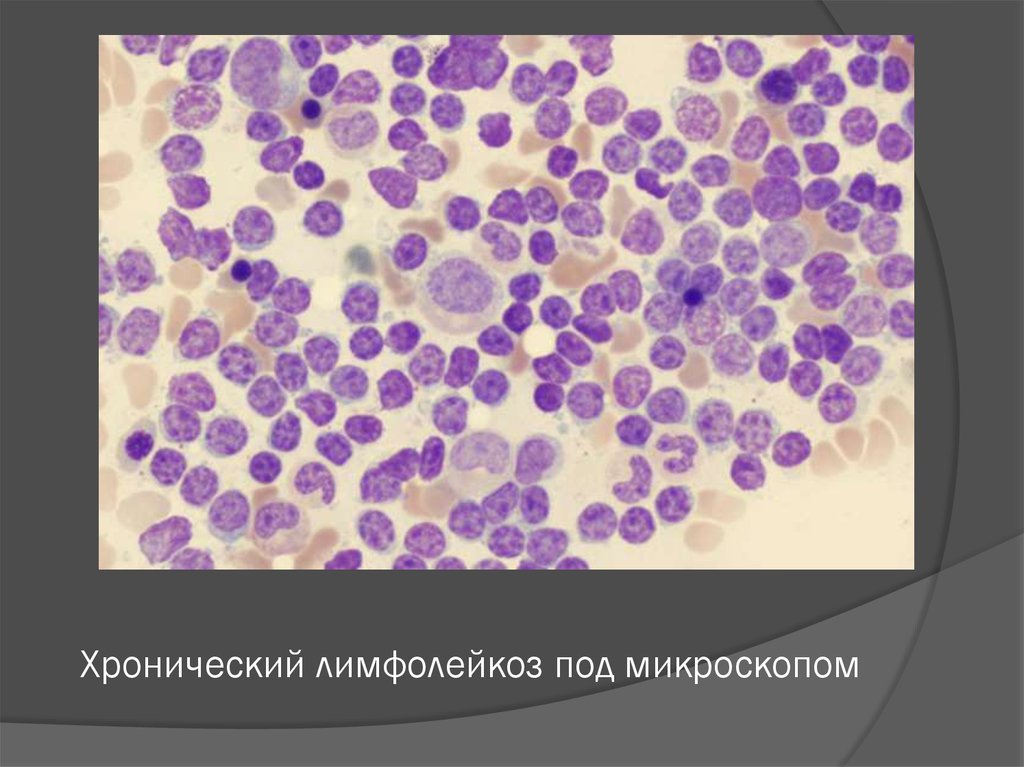 Эти кристаллы могут быть выявлены при поляризационной микроскопии.
Эти кристаллы могут быть выявлены при поляризационной микроскопии.
В норме в синовиальной жидкости обнаруживаются и клетки тканевого происхождения (синовиоциты, гистиоциты), а также элементы крови. Это преимущественно лимфоциты, реже – нейтрофилы и моноциты. При воспалении в синовиальной жидкости могут встречаться особые формы нейтрофилов – рагоциты. Их клетки имеют “ячеистый” вид за счет включения иммунных комплексов в цитоплазму. Это наиболее характерные признаки при ревматоидном артрите. При некоторых состояниях (аллергические синовиты, туберкулезный процесс, артриты на фоне новообразований) в синовиальной жидкости преобладают мононуклеары.
Изменения синовиальной жидкости при различных патологических процессах
|
Признак |
Тип изменений |
||
|
Невоспалительный |
Воспалительный |
Септический |
|
|
Цвет |
Соломенно-желтый |
Желтый |
Варьируется |
|
Прозрачность |
Прозрачная |
Полупрозрачная |
Мутная |
|
Лейкоциты, в 1 мкл |
200 – 2 000 |
2 000 – 75 000 |
> 75 000 |
|
Нейтрофилы, % |
40-75 |
> 75 |
|
|
Кристаллы |
Нет |
Иногда |
Нет |
|
Бактериологическое исследование |
Отрицательное |
Отрицательное |
Иногда положительное |
|
Заболевания |
Остеоартроз, травматический артроз, асептический некроз, системная красная волчанка |
Ревматоидный артрит, подагра, псевдоподагра, системная красная волчанка, серонегативные спондилоартропатии |
Гонококковый артрит, туберкулезный артрит, инфекционный артрит (стафилококковый и стрептококковый) |
Изменения синовиальной жидкости при артрите и артрозе
|
Признак |
Артрит |
Артроз |
|
Количество клеток |
> 10 000 в 1 мкл |
|
|
Доминирующий тип клеток |
Полинуклеары, плазмоциты |
Лимфоциты, моноциты, плазмоциты |
|
Фагоциты |
6-80 % и выше |
Меньше 5 % |
|
Концентрация белка |
Значительно повышена |
Умеренно повышена |
|
|
(> 6 г/ %) |
( |
Важные замечания
- Окончательные выводы для постановки диагноза необходимо делать, исходя из комплексного учета все данных, включающего сопоставление результатов лабораторных анализов и клинической картины в целом.
Также рекомендуется
- Клинический анализ крови: общий анализ, лейкоцитарная формула, СОЭ (с микроскопией мазка крови при выявлении патологических изменений)
- С-реактивный белок, количественно (метод с нормальной чувствительностью)
- Мочевая кислота в сыворотке
- Выявление гена гистосовместимости HLA-B27. Определение предрасположенности к развитию спондилоартропатий (в т.ч. анкилозирующего спондилита – болезнь Бехтерева)
Кто назначает исследование?
Ортопед, хирург, ревматолог, артролог.
Литература
- Tercic D & Bozic B: The basis of the synovial fluid analysis. Clin Chem Lab Med 2001; 39(12):1221-1226.
- Garcia-De La Torre I: Advances in the management of septic arthritis. Rheum Dis Clin North Am 2003; 29:61-73.
- Захарова М.М. Исследования синовиальной жидкости. В кн.: Ревматология. Национальное руководств. Под ред.
.jpg) академика РАМН Е.Л. Насонова и академика РАМН В.А. Насоновой. М., “ГЭОТАР-Медиа”, 2008, с. 62-66.
академика РАМН Е.Л. Насонова и академика РАМН В.А. Насоновой. М., “ГЭОТАР-Медиа”, 2008, с. 62-66.
Мебель Оренбург Каталог Фото – Telegraph
👉🏻👉🏻👉🏻 ВСЯ ИНФОРМАЦИЯ ДОСТУПНА ЗДЕСЬ, ЖМИТЕ 👈🏻👈🏻👈🏻
Мебельный центр “М3” вся мебель Оренбурга! – Оренбург
Мебельная Фабрика «Новая Мебель», Г .оренбург . Pdf Каталог
Шкафы в Оренбурге каталог, цены и фото
Комоды и тумбы в Оренбурге каталог, цены и фото
Мебельный магазин Громада
Мягкая мебель, каталог мягкой мебели в Оренбурге, купить . . .
Каталог Икеа – Все Товары И Цены По Разделам – Ikea
АРИКА МЕБЕЛЬ г . Оренбург | ВКонтакте
Интернет-магазин мебели «ШАТУРА» — каталог с фото и ценами . . .
Sv Мебель – Официальный Сайт – Каталог 2021 – Цены
Как Красиво Оформить Фото В Инстаграм
Летний День Фото
Ремонт Кухни В Доме Фото
Так вот, спасибо за особенное внимание и отзывчивость нашего продавца Анны (г . Оренбург, Мебельный центр М3), она как и в прошлый раз, помогла оформить все быстро и четко .
Сотрудничество с фабрикой . Наша фабрика для продажи в Ваших салонах готова предоставить мебель, как серийного модельного ряда, так и мебель, разработанную по индивидуальным чертежам .
orenburg .mebelcena .ru › catalog › shkaf
23000 р . Шкаф – часть неотъемлемая любого помещения . Очень важно, чтобы этот предмет домашнего обихода был вместительным, функциональным и в тоже время очень стильным . На портале Мебельцена .рф . . .
orenburg .mebelcena .ru › catalog › komodi
Длина (мм) 450 мм . Нравится . 12000 р . быстрый просмотр . приобрести товар . Прикроватные комоды, тубы – хорошее решение для интерьера вашей спальни . Выбор этих важных мебельных элементов начиняется . . .
www .gromada56 .ru
Оренбург, ТК XXL пр . Автоматики, 28 А +7 (3532) 99-45-45 доб . 664 и 665 office@stroylandiya .ru . . . Каталог . Мягкая мебель;
Мягкая мебель: преимущества и особенности выбора . Если вы решили купить мягкую мебель, наш интернет-магазин сможет предложить вам широкий ассортимент диванов и кресел хорошего качества .
Полный каталог товаров ikea, в котором легко найти мебель и товары для дома . Фото, актуальные цены и условия доставки по России на сайте официального интернет-магазина ИКЕА
Собственное производство мягкой мебели : Фабрика “Арика” г .Уфа МЦ Громада г . Оренбург проезд Автоматики 28А
Интернет-магазин недорогой и качественной мебели в Москве . Уже более полувека мебельная компания «Шатура» входит в число бесспорных лидеров рынка, выпуская мебель высокого качества по доступным ценам .
sv-mebel .site
«sv-мебель» – официальный сайт: каталог 2021, цены и фото коллекций . Спальни, кухни, гостиные, прихожие и детские по низким ценам . Прямые поставки от производителя . Гарантия 3 года .
Картинка С Добрыми Словами Мужчине
Украина Г Сумы Фото
Мастер И Маргарита Патриаршие Пруды Фото
Женские Брюки Фото Цены
Синупрет Фото Упаковки
Машина Бизнес Класса Фото
Добрый День И Утро Картинки Прикольные Смешные
Провокационное Фото У Храма
Черный Цвет Фото Однотонный
Полку Своими Руками Фото
Подпись К Фото Следуй За Мной
Картинки Разные Поезда
Просмотр Фотографий Обновить
Порно Фото Мира
Ретро Фото Жены
Фото Девочек 12 Лет Домашних Условиях
Жены Секси Голые Фото
Отделка Коридора Декоративным Камнем Фото
Фото Девушки Брюнетки Дома Реальное В Пижаме
Оказание Первой Помощи Картинки Для Презентации
Фотографии Парней 17
Картинки Защита Растений
Мононуклеары Фото Под Микроскопом
Клубника Кармен Описание Сорта Фото Отзывы
Листья Эвкалипта Картинки
Стол Компьютерный Брянск Фото
Фото Модных Мужских Коротких Причесок
Картинки На Любовь И Удачу
Печеночники С Рисом Рецепт С Фото
Самые Красивые Пары Фотографии
Фотографии Из Мультика Аниме
Раздеть По Фотографии До Гола Девушку
Плитка Для Пола Прихожей Фото Цены
Показать Белгород Фото
Формат Фото Для Вайлдберриз
Фото Толстые На Природе
Минет Между Сисек Фото
Отель Утопия Турция Фото
Скачать Смешное Фото Про Спортивную Зарядку
Шкаф Напольный В Ванную Комнату Фото
Штурманские Часы Фото
7 Ноября Картинки
Открытки 1 Сентября День Знаний Картинки
Шоколадки С Фотографиями На Заказ Тюмень
Серая Кожа На Фото
Стоит Голая Частное Фото
Как Выглядит Рентген Здоровых Легких Фото
Сорт Яблок Коричное Полосатое Фото И Описание
Скачать Приложение Сделать Видео Из Фотографий
Капуста Мегафон Описание Сорта Фото
Эротика Ног Фото
Красивые Золотые Браслеты Женские Фото
Ванная Комната 3 Кв Метра Фото
Коричневые Унитазы Фото
Фотографии Невской Кошки
День Сердца Красивые Картинки
Кухни Без Окон Фото
Пистолет Вальтер Фото Все Виды
Интимные Порно Фото Домашнее
Все Злодеи Человека Паука Список С Картинками
Красивые Фото На Аву В Ватсап
Дети Киры Найтли Фото
Киров Фото 2022
Ногти Перепелиное Яйцо Фото
Фото Из Видео Способы
Спасибо Лилия Картинки
Картинки Раскраски Скачать Бесплатно Формат А4
Фото 5 Августа
Ред Ридинг Худ Тюльпан Фото
Парящие Натяжные Потолки С Подсветкой Фото
Голая Русская Женщина Фото Вконтакте
Анастасия Ягайлова Фото
Лазерная Депиляция Глубокое Бикини Фото
Тула Картинки Города Фото
Фото Узкого Шкафа Купе В Комнату
Картинки На Стекле На Стену
Найти Интимные Фото По Фотографии
Русская Теща Домашнее Порно Фото
Бенито Альварадо 19 Век Испания Биография Фото
Настоящие Фото Планет Солнечной Системы
Григорьева Лариса Хочу Любви Фото Г Москва
Шведки Фото Девушек 18
Виды Морских Рыб С Фото
Слитые Фото Со Вписок
Столики Под Телевизор Фото
5 Камерное Пластиковое Окно Фото
Хризантема Многолетник Фото
Фото Кристины Тихоновой
Фото Парков В Тольятти
Браслеты Пандора Каталог И Цены Фото Женские
Как Сохранить Картинку На Ноутбуке С Яндекса
Буква М Картинки Прописи
Одежда Для Женщин 55 Лет Фото
Наруто Плачет Фото
Девочка Под Зонтиком Картинки
Моцарелла Мини Фото
Русская Философия Картинки
Лисичка Лесная Фото
Фото Нарощенных Ресниц 2д Изгиб
Бандитский Саратов Фото
Мебель Оренбург Каталог Фото
Как делать качественные микроскопические изображения
Когда дело доходит до первичной клеточной культуры, картинка стоит тысячи слов. Качественное изображение может передать информацию о морфологии клеток, их здоровье, чистоте и плотности культуры. Различные типы методов двумерной микроскопии, такие как фазово-контрастная, рельефно-контрастная и флуоресцентная микроскопия, могут дать бесценную информацию о ваших культурах при одновременном использовании.
Качественное изображение может передать информацию о морфологии клеток, их здоровье, чистоте и плотности культуры. Различные типы методов двумерной микроскопии, такие как фазово-контрастная, рельефно-контрастная и флуоресцентная микроскопия, могут дать бесценную информацию о ваших культурах при одновременном использовании.
Фазово-контрастная микроскопия повышает контрастность путем перевода толщины клеток в уровни оттенков серого. Более толстые области клетки, такие как ядро, будут выглядеть темнее по сравнению с более тонкими областями клетки, такими как цитоплазма. Этот метод полезен для оценки морфологии клеток и, следовательно, чистоты культуры. Это также может указывать на здоровье клеток, поскольку потемневшая цитоплазма иногда указывает на поврежденные или умирающие клетки. Рисунок 1 демонстрирует, как морфология эндотелиальных клеток, кератиноцитов и фибробластов человека различается с помощью фазово-контрастной микроскопии.
Рельефная контрастная микроскопия (известная также как модуляционный контраст Хоффмана) создает эффект затененного псевдорельефа, который также можно использовать для оценки морфологии клеток и чистоты культуры. Он особенно полезен для различения более плоских типов клеток (например, фибробластов) и более толстых и округлых клеток (например, эпителиальных клеток), как показано на рисунке 2.
Он особенно полезен для различения более плоских типов клеток (например, фибробластов) и более толстых и округлых клеток (например, эпителиальных клеток), как показано на рисунке 2.
Флуоресцентная микроскопия, напротив, использует ультрафиолетовое излучение УФ) свет и фильтры возбуждения/излучения для выборочного освещения и визуализации флуорофора. Он используется с клетками, экспрессирующими флуоресцентные белки, или с иммунофлуоресценцией, методом, при котором антитела флуоресцентно метят интересующий белок. Иммунофлуоресценция используется для маркировки маркеров, специфичных для типа клеток, и, таким образом, является одним из лучших способов оценки чистоты культуры. Изображения на рисунке 3 демонстрируют, как иммунофлуоресценция определяет тип клеток и чистоту культуры. На первом изображении показано несколько положительных по бета-тубулину III нейронов среди двух ненейрональных клеток с дапи-положительными ядрами (красные стрелки). На втором изображении HUVEC показана чрезвычайно чистая культура, о чем свидетельствует повсеместное окрашивание продуцента эндотелиальных клеток CD31. Третье изображение астроцитов человека также очень чистое, о чем свидетельствует распространенное положительное окрашивание GFAP.
Третье изображение астроцитов человека также очень чистое, о чем свидетельствует распространенное положительное окрашивание GFAP.
Несмотря на то, что эти методы микроскопии дают несколько разные типы информации, использование всех трех методов в сочетании — отличный способ получить максимум информации о здоровье и чистоте вашей культуры.
Советы по получению качественных изображений
Для получения наилучших и наиболее информативных изображений с помощью этих методов учитывайте следующие основные элементы: конфигурация микроскопа, фокус и экспозиция.
Конфигурация микроскопа
Чрезвычайно важно понимать свой микроскоп. Если вы новичок в этом инструменте, попросите кого-нибудь с опытом показать вам его правильное использование или прочтите руководство по эксплуатации. В микроскопах много движущихся частей, и достаточно одной неправильной настройки, чтобы не получить качественное изображение. Понимание различных настроек и правильных световых путей также будет иметь большое значение при устранении неполадок в будущем.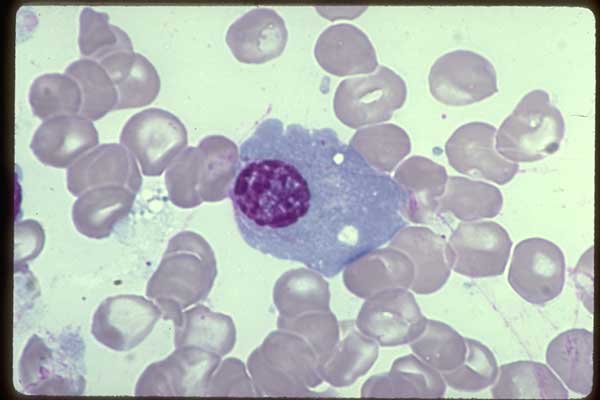
Фокусировка
Четкая фокусировка является наиболее важной характеристикой хорошего изображения, но добиться ее непросто. Хотя клетки in vitro обычно выращивают на 2-мерной поверхности, клетки на самом деле являются 3-мерными. Итак, на какой области клетки следует сосредоточиться? Для контраста фазы и рельефа, которые используют проходящий свет для просмотра всей клетки, вы часто хотите сфокусироваться на самой тонкой части (рис. 4A), а не на теле клетки (рис. 4B). Для этого посмотрите на внешний периметр ячейки и отрегулируйте ручку точной фокусировки, пока эта область не станет резкой. На флуоресцентных изображениях фокус ядерного пятна (синий) может быть выше в области z, чем цитоплазматический или адгезивный белок. Поэтому крайне важно перефокусироваться с каждым цветом, чтобы обеспечить резкость интересующей области. Это гарантирует абсолютно четкое изображение после слияния цветов.
Экспозиция
Экспозиция соответствует тому, сколько света попадает на изображение.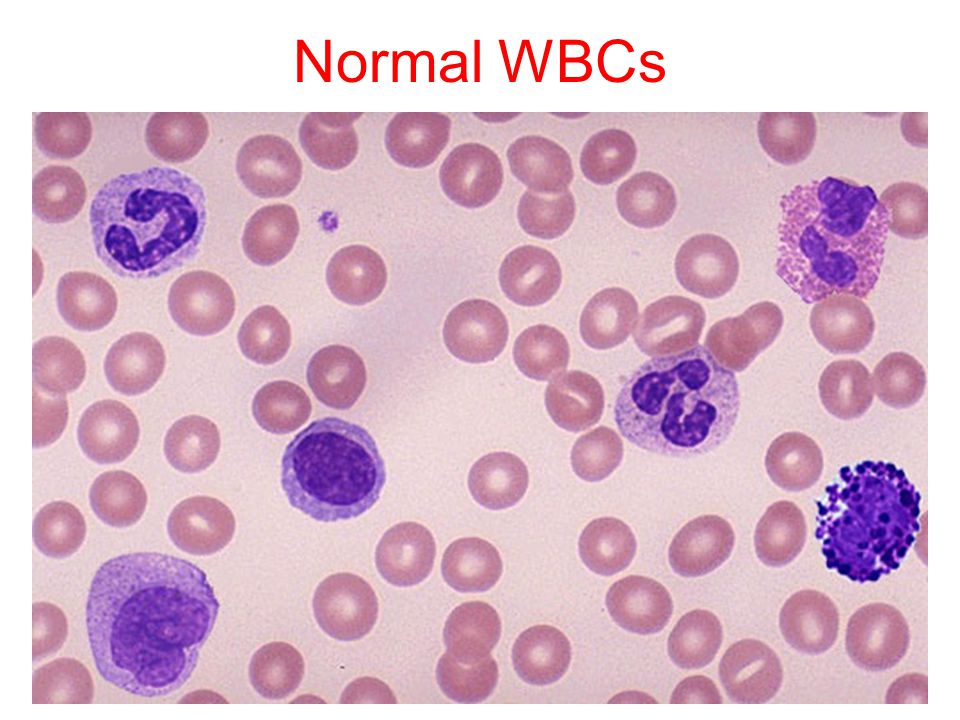 Для фазового и рельефного контраста этим можно управлять, уменьшая яркость проходящей лампы или регулируя время экспозиции в программном обеспечении вашей камеры. Слишком большая экспозиция приведет к насыщению или ярким областям без изменения интенсивности (рис. 5). Слишком низкая экспозиция затрудняет визуализацию клеток (рис. 5).
Для фазового и рельефного контраста этим можно управлять, уменьшая яркость проходящей лампы или регулируя время экспозиции в программном обеспечении вашей камеры. Слишком большая экспозиция приведет к насыщению или ярким областям без изменения интенсивности (рис. 5). Слишком низкая экспозиция затрудняет визуализацию клеток (рис. 5).
Экспозиция особенно важна для флуоресцентной визуализации и контролируется программным обеспечением захвата изображения. Цель состоит в том, чтобы получить сильный сигнал без насыщения по интенсивности (рис. 6). Программное обеспечение для обработки изображений можно использовать для регулировки контрастности изображения и уменьшения фоновой флуоресценции, но в начале требуется разумный сигнал. Однако программное обеспечение для обработки изображений нельзя использовать для устранения насыщения. Также стоит отметить, что не следует слишком сильно обрабатывать изображение, чтобы оно искажало оригинал.
В заключение, получение высококачественных изображений ваших клеток с использованием различных методов микроскопии является бесценным способом документирования роста клеток и сбора данных для ваших экспериментов. Поначалу создание высококачественных изображений может быть сложной задачей, однако знания и практика могут привести к успеху!
Поначалу создание высококачественных изображений может быть сложной задачей, однако знания и практика могут привести к успеху!
Кровь: Руководство по гистологии
Лейкоциты
Лейкоциты встречаются гораздо реже, чем эритроциты. Существует пять типов лейкоцитов (лейкоцитов). Они делятся на два основных класса
- Гранулоциты (включая нейтрофилы, эозинофилы и базофилы)
- Агранулоциты (включая лимфоциты и моноциты).
Эта классификация зависит от того, можно ли различить гранулы в их цитоплазме с помощью светового микроскопа и обычных методов окрашивания).
Все лейкоциты способны двигаться как амебы и могут мигрировать из кровеносных сосудов в окружающие ткани.
Примечание. Различные лейкоциты в мазках крови легко перепутать. Чтобы идентифицировать их, вам нужно посмотреть на форму ядра и сравнить их размер с размером эритроцита. После того, как вы просмотрели приведенные ниже примеры — попробуйте сами — нажмите здесь и посмотрите, сможете ли вы идентифицировать «загадочные» ячейки.
Гранулоциты:
Показывает нейтрофил в мазке крови. Нейтрофилы имеют диаметр 12-14 мкм и поэтому выглядят больше, чем окружающие эритроциты. Имеется одно ядро, которое является многодольчатым и может иметь от 2 до 5 долей.
Хроматин в ядре конденсирован. Это означает, что нет синтеза белка. В цитоплазме мало органоидов.
Нейтрофилы
Нейтрофилы являются наиболее распространенным типом лейкоцитов, обнаруживаемым в мазке крови. Они составляют 60-70% от общего количества лейкоцитов.
Нейтрофилы имеют 3 типа гранул:
- лазурные гранулы (лизосомы),
- секреторные гранулы в цитоплазме лососево-розового цвета, антимикробные ферменты.
- содержат гликопротеины и желатиназу.
Функция:
Нейтрофилы рождаются в костном мозге. Они циркулируют в крови в течение 6-10 часов, а затем попадают в ткани. Они подвижны и фагоцитируют и разрушают поврежденные ткани и бактерии. Они самоуничтожаются после одного всплеска активности.
Они важны при воспалительных реакциях.
На этом снимке показан эозинофил в мазке крови. Эти клетки имеют диаметр 12–17 мкм — больше, чем нейтрофилы, и примерно в 3 раза больше размера эритроцита. Вы можете видеть, что эозинофилы имеют только две доли ядра.
Эти клетки имеют крупные специфические ацидофильные гранулы, которые окрашиваются в ярко-красный или красновато-фиолетовый цвет. Эти гранулы содержат белки, которые являются «разрушительными» и токсичными.
Эозинофилы
Эозинофилы довольно редко обнаруживаются в мазках крови и составляют 1-6% от общего числа лейкоцитов.
Функция :
Эти клетки рождаются в костном мозге и через несколько часов мигрируют из системы периферической крови в рыхлую соединительную ткань дыхательных и желудочно-кишечных путей. Они фагоцитируют комплексы антиген-антитело. Они также продуцируют гистаминазу и арилсульфатазу В, два фермента, которые инактивируют два воспалительных агента, выделяемых тучными клетками.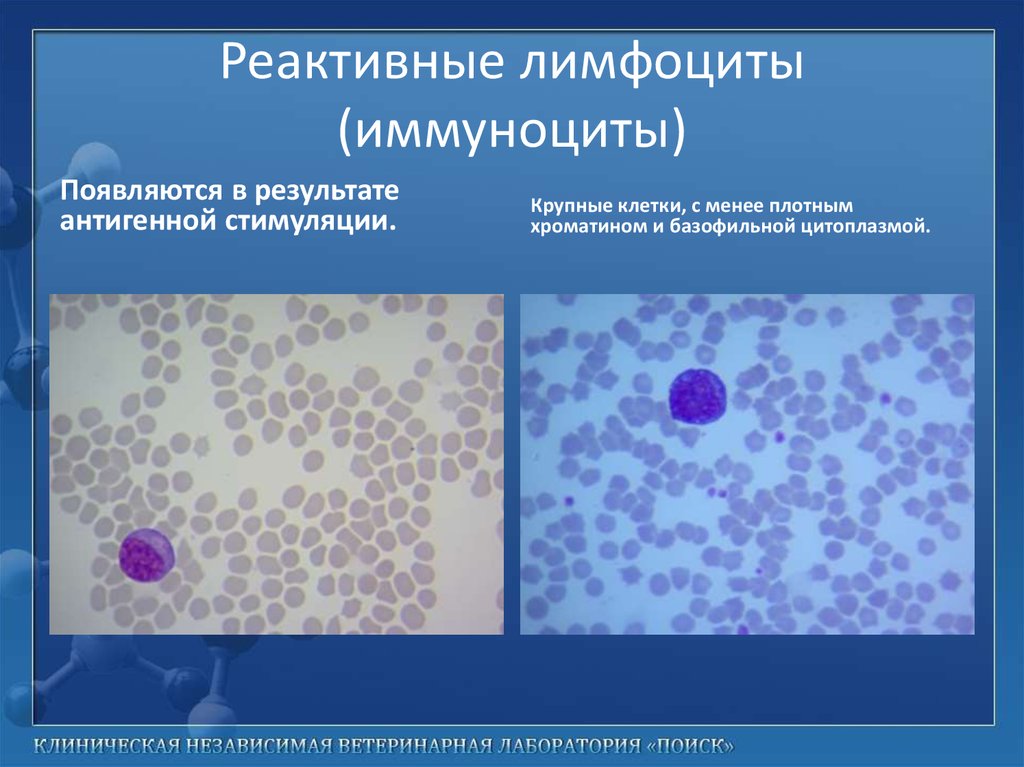 Высокий уровень эозинофилов в крови может свидетельствовать об аллергической реакции.
Высокий уровень эозинофилов в крови может свидетельствовать об аллергической реакции.
Эозинофилы также играют важную роль в уничтожении паразитических червей.
На этой фотографии изображен базофил. Они имеют диаметр 14-16 мкм, содержат большое количество темно-синих окрашенных гранул (основные) и двудольное ядро. Гранулы содержат гепарин, гистамин и серотонин. простагландины и лейкотриены.
Базофилы
Базофилы — самый редкий тип лейкоцитов, составляющий всего 1% лейкоцитов, обнаруживаемых в мазке крови.
Функция :
Эти клетки участвуют в иммунных реакциях на паразитов. У них есть рецепторы IgE, и гранулы высвобождаются, когда клетки связывают IgE. Эти клетки также накапливаются в местах инфекции, а высвобождение простагландинов, серотонина и гистамина способствует увеличению притока крови к области повреждения в рамках воспалительной реакции. Дегрануляция – высвобождение гистамина также играет роль в аллергических реакциях, таких как сенная лихорадка.
Агранулоциты:
Это фотография лимфоцита в мазке крови. Большинство лимфоцитов мелкие; немного больше, чем эритроциты, около 6-9мкм в диаметре,
Остальные (около 10%) крупнее, около 10-14 мкм в диаметре. Эти более крупные клетки имеют больше цитоплазмы, больше свободных рибосом и митохондрий. Лимфоциты могут выглядеть как моноциты, за исключением того, что лимфоциты не имеют ядра в форме фасоли, а лимфоциты обычно меньше. Большие лимфоциты обычно являются активированными лимфоцитами.
Они имеют маленькое сферическое ядро и обильное темное окрашивание конденсированного хроматина. Цитоплазмы не так много, и она базофильная (бледно-голубое/фиолетовое окрашивание).
Лимфоциты
Это вторые по распространенности лейкоциты (20-50%), и их легко обнаружить в мазках крови.
Хотя клетки выглядят одинаково, существует два основных типа: В-клетки и Т-клетки.
В-клетки развиваются в костном мозге. Т-клетки рождаются в костном мозге, но созревают в тимусе. Подробнее об этом будет рассказано в разделе об иммунной системе.
Подробнее об этом будет рассказано в разделе об иммунной системе.
Функция :
В-клетки превращаются в плазматические клетки, которые вырабатывают антитела. Т-клетки атакуют вирусы, раковые клетки и трансплантаты.
Это фотография моноцита в мазке крови.
Это самый крупный тип лейкоцитов, его диаметр может достигать 20 мкм.
У них большое эксцентрично расположенное ядро, имеющее форму фасоли.
Они имеют обильную цитоплазму и несколько мелких розово-фиолетовых гранул в цитоплазме.
Моноциты
Моноциты являются третьим наиболее распространенным типом лейкоцитов; около 2-10% лейкоцитов составляют моноциты.
Функция:
Моноциты в кровотоке являются предшественниками тканевых макрофагов, которые активно фагоцитируют. Моноциты циркулируют в крови 1-3 дня, затем мигрируют в ткани организма, где трансформируются в макрофаги. Они будут фагоцитировать мертвые клетки и бактерии. Некоторые моноциты также могут трансформироваться в остеокласты.
Моноциты играют важную роль в воспалительной реакции.
Анализ клеточных изображений и визуализация методом проточной цитометрии
- Список журналов
- Рукописи авторов HHS
- PMC2034394
Clin Lab Med. Авторская рукопись; доступно в PMC 2008 Sep 1.
Опубликовано в окончательной редакции как:
Clin Lab Med. 2007 сен; 27(3): 653–viii.
doi: 10.1016/j.cll.2007.05.008
PMCID: PMC2034394
NIHMSID: NIHMS29623
PMID: 17658411
Дэвид А. Басиджи, доктор философии, Уильям Э. Ортин, Лучуан Лян, доктор философии, Видья Венкатачалам, доктор философии, и Филип Моррисси информация Отказ от ответственности
Проточная цитометрия с визуализацией сочетает в себе статистическую мощность и флуоресцентную чувствительность стандартной проточной цитометрии с пространственным разрешением и количественной морфологией цифровой микроскопии.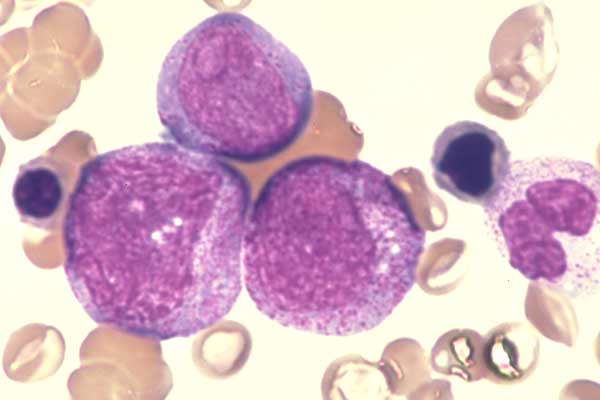 Этот метод хорошо подходит для клинических применений, предоставляя удобные средства для визуализации и анализа клеток непосредственно в жидкостях организма. Приведены примеры различения раковых и нормальных эпителиальных клеток молочной железы и высокопроизводительного количественного анализа FISH-зондов в мононуклеарных клетках периферической крови человека. Приложение FISH будет дополнительно усовершенствовано за счет интеграции технологии визуализации расширенной глубины резкости с существующей оптической системой.
Этот метод хорошо подходит для клинических применений, предоставляя удобные средства для визуализации и анализа клеток непосредственно в жидкостях организма. Приведены примеры различения раковых и нормальных эпителиальных клеток молочной железы и высокопроизводительного количественного анализа FISH-зондов в мононуклеарных клетках периферической крови человека. Приложение FISH будет дополнительно усовершенствовано за счет интеграции технологии визуализации расширенной глубины резкости с существующей оптической системой.
Ключевые слова: визуализация, поток, цитометрия, флуоресценция, светлое поле, темное поле, мультиспектральная
Количественная оценка клеточной структуры в норме и заболевании
Эукариотическая клетка представляет собой высокоструктурированный трехмерный объект, содержащий широкий спектр молекулярных видов. Размер, форма и структура клетки, а также обилие, расположение и совместное расположение любой из этих составляющих биомолекул могут иметь значение в любой конкретной клинической ситуации или исследовательском приложении. Например, в гемопоэзе, когда клетки дифференцируются и созревают, экспрессируются различные подмножества молекул, которые отражают специализированную функциональную способность для этого уникального типа клеток (например, гранулоциты против лимфоцитов). В общем, характеристика этого набора составляющих молекул с помощью визуализации или проточной цитометрии дает представление о физиологической функции любой конкретной клетки или, альтернативно, о патологических изменениях, которые могли произойти или накопились. В клинической практике и в условиях исследований оценка клеток с помощью технологий визуализации и проточной цитометрии дает важную информацию, отражающую конкретный клеточный фенотип, как нормальный, так и патологический. Микроскопия дает огромное количество информации, но скорость сбора данных низкая, а анализ, как правило, субъективен. В проточной цитометрии сбор данных происходит быстро и лучше подходит для оценки патологий, присутствующих с низкой частотой, но данные основаны только на интенсивности, поэтому отсутствует морфология, которая действительно придает анализу достоверность.
Например, в гемопоэзе, когда клетки дифференцируются и созревают, экспрессируются различные подмножества молекул, которые отражают специализированную функциональную способность для этого уникального типа клеток (например, гранулоциты против лимфоцитов). В общем, характеристика этого набора составляющих молекул с помощью визуализации или проточной цитометрии дает представление о физиологической функции любой конкретной клетки или, альтернативно, о патологических изменениях, которые могли произойти или накопились. В клинической практике и в условиях исследований оценка клеток с помощью технологий визуализации и проточной цитометрии дает важную информацию, отражающую конкретный клеточный фенотип, как нормальный, так и патологический. Микроскопия дает огромное количество информации, но скорость сбора данных низкая, а анализ, как правило, субъективен. В проточной цитометрии сбор данных происходит быстро и лучше подходит для оценки патологий, присутствующих с низкой частотой, но данные основаны только на интенсивности, поэтому отсутствует морфология, которая действительно придает анализу достоверность.
Кроме того, оценка образцов клеток с помощью методов визуализации и проточной цитометрии осложняется рядом факторов. Например, изменения в типе клеток или фенотипические изменения в клеточной субпопуляции часто происходят в гетерогенных смесях клеток; среди популяций существует фенотипическая изменчивость, особенно в клинических условиях человека; и представляющая интерес клеточная популяция может присутствовать с очень низкой частотой. В этом контексте будут обсуждаться относительные преимущества технологий для оценки клеток и клеточных популяций.
Каждая форма цитологического инструментария представляет собой компромисс. Как правило, существует компромисс между скоростью сбора данных, чувствительностью флуоресценции и информативностью. Например, конфокальный микроскоп может создавать высокодетализированные флуоресцентные изображения клеток, в том числе трехмерные изображения клеток на основе нескольких сложенных изображений, но для получения трехмерного изображения с высоким разрешением одной клетки может потребоваться несколько минут. Абсолютная чувствительность флуоресценции также обычно ниже в конфокальной микроскопии, чем в других методах, потому что сигналы не в фокусе отклоняются конфокальной оптической системой, а также потому, что изображение строится последовательно из отдельных измерений в каждом месте клетки, что сокращает количество времени. доступны для сбора сигнала. Чувствительность одного изображения может быть увеличена за счет пребывания над клеткой в течение более длительного периода времени, но это может вызвать чрезмерное фотообесцвечивание за пределами плоскости фокуса, что затруднит трехмерное изображение. Особенности конструкции, связанные с конфокальной микроскопией, делают ее подходящей для приложений, требующих точного анализа субклеточных особенностей в гомогенных образцах, но плохо подходящей для обнаружения слабых флуоресцентных зондов или оценки статистически значимого количества клеток в гетерогенных образцах. Хотя трехмерные изображения клеток с высоким разрешением с помощью конфокальной визуализации могут быть полезны в определенных областях клинических исследований, конфокальная визуализация не получила широкого распространения в клинической оценке или диагностике.
Абсолютная чувствительность флуоресценции также обычно ниже в конфокальной микроскопии, чем в других методах, потому что сигналы не в фокусе отклоняются конфокальной оптической системой, а также потому, что изображение строится последовательно из отдельных измерений в каждом месте клетки, что сокращает количество времени. доступны для сбора сигнала. Чувствительность одного изображения может быть увеличена за счет пребывания над клеткой в течение более длительного периода времени, но это может вызвать чрезмерное фотообесцвечивание за пределами плоскости фокуса, что затруднит трехмерное изображение. Особенности конструкции, связанные с конфокальной микроскопией, делают ее подходящей для приложений, требующих точного анализа субклеточных особенностей в гомогенных образцах, но плохо подходящей для обнаружения слабых флуоресцентных зондов или оценки статистически значимого количества клеток в гетерогенных образцах. Хотя трехмерные изображения клеток с высоким разрешением с помощью конфокальной визуализации могут быть полезны в определенных областях клинических исследований, конфокальная визуализация не получила широкого распространения в клинической оценке или диагностике. 1 , 2
1 , 2
Функциональной противоположностью конфокальной микроскопии является проточная цитометрия. Наиболее очевидное различие между методами заключается в том, что проточная цитометрия требует, чтобы клетки находились в суспензии, а не на предметных стеклах. Кроме того, проточная цитометрия полностью жертвует визуализацией в пользу высокой скорости сбора данных и чувствительности к флуоресценции. В проточной цитометрии каждое событие обнаружения (клетка) связано с несколькими численными измерениями интенсивности флуоресценции и степени прямого и бокового рассеяния лазерного света. Прямое рассеяние примерно коррелирует с размером клетки, а боковое рассеяние дает представление о зернистости клетки, но проточная цитометрия не дает средств локализации внутриклеточной флуоресценции. Сила проточной цитометрии заключается в том, что она позволяет проводить быстрый анализ больших популяций клеток. Типичная аналитическая производительность составляет 5000 клеток в секунду, что означает, что даже редкие клеточные популяции (то есть менее 1 клетки на 10 000) могут быть обнаружены в статистически значимом количестве за разумный период времени.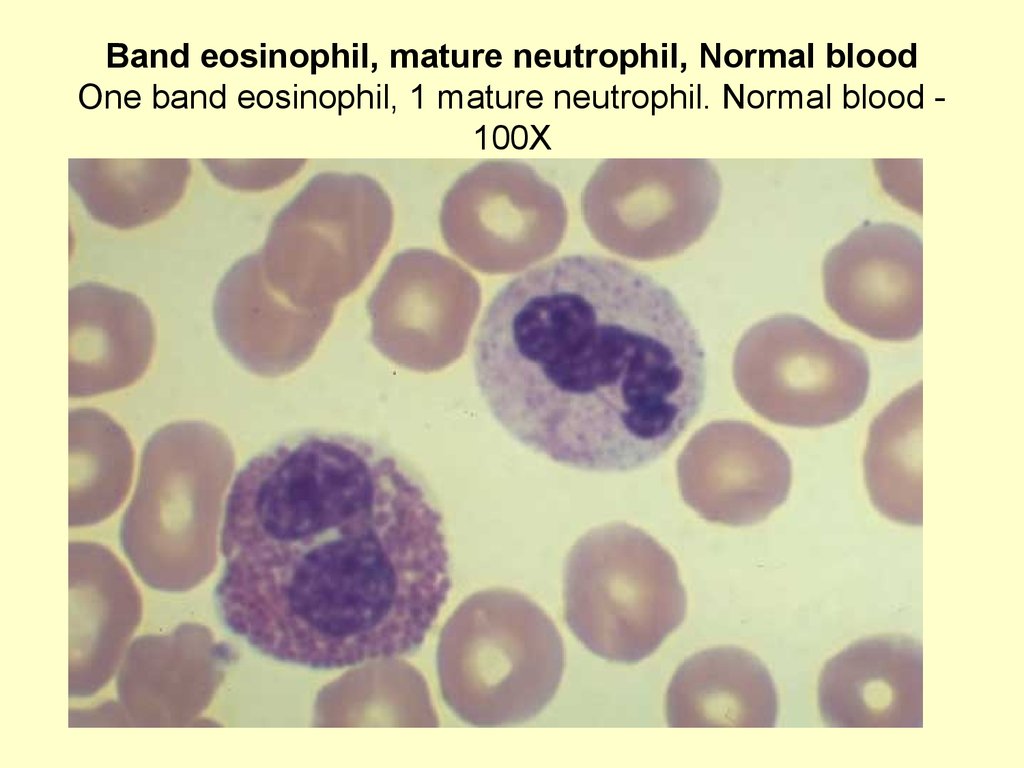 Пределы обнаружения флуоресценции часто составляют менее 100 молекул на клетку. Сочетание высокой скорости и высокой количественной флуоресцентной чувствительности делает этот метод подходящим для таких ситуаций, как эктопическая экспрессия ZAP-70 при ХЛЛ, что является прогностическим показателем. 3
Пределы обнаружения флуоресценции часто составляют менее 100 молекул на клетку. Сочетание высокой скорости и высокой количественной флуоресцентной чувствительности делает этот метод подходящим для таких ситуаций, как эктопическая экспрессия ZAP-70 при ХЛЛ, что является прогностическим показателем. 3
Третьим примером методов клеточного анализа является стандартная микроскопия. В отличие от конфокальной микроскопии стандартная микроскопия может отображать клетки в различных режимах (проходящий свет, рассеянный свет, флуоресценция, фазовый контраст и т. д.), каждый из которых дает четкую и дополняющую информацию о клетке. При заданной частоте визуализации чувствительность флуоресценции, как правило, лучше, чем у конфокальной микроскопии, а при наличии достаточного времени для интегрирования сигнала чувствительность может даже превосходить проточную цитометрию. В автоматизированной форме стандартная микроскопия может быть как количественной, так и относительно быстрой, с типичной пропускной способностью в несколько сотен клеток в секунду. Хотя пространственное разрешение стандартной микроскопии не такое хорошее, как у конфокальной микроскопии, оно достаточно для разрешения многих субклеточных компартментов и структур, что делает его стандартным методом клинической цитологической оценки.
Хотя пространственное разрешение стандартной микроскопии не такое хорошее, как у конфокальной микроскопии, оно достаточно для разрешения многих субклеточных компартментов и структур, что делает его стандартным методом клинической цитологической оценки.
Частично из-за ограничений, налагаемых их инструментами, многие клиницисты используют экспертную, но субъективную оценку нескольких сотен изображений клеток с помощью стандартной микроскопии в сочетании с отдельным проточным цитометрическим анализом для количественной оценки клеточного фенотипа и клеточного цикла. . Это означает, что образец должен быть разделен и обработан с использованием двух различных протоколов. Если первичный клеточный образец находится в суспензии (например, кровь, лаважи и т. д.), его несложно подготовить для проточной цитометрии, но для микроскопической оценки образец клеток должен быть размазан, подвергнут цитоспрядению или иным образом приклеен на предметное стекло или твердый субстрат перед окрашиванием и визуальным исследованием, что связано с риском изменчивости окрашивания или изменения морфологии клеток. И наоборот, с первичными образцами твердых тканей подготовка предметного стекла для микроскопической оценки относительно проста, но для проточной цитометрии образец должен быть дезагрегирован до окрашивания и сбора данных. Таким образом, клиницист вынужден использовать сочетание высокоинформативных данных изображения относительно небольшого числа клеток и высококоличественных, но ограниченных данных из статистически значимых клеточных популяций, часто полученных в разное время и/или подвергающихся различным систематическим ошибкам при подготовке и сборе данных.
И наоборот, с первичными образцами твердых тканей подготовка предметного стекла для микроскопической оценки относительно проста, но для проточной цитометрии образец должен быть дезагрегирован до окрашивания и сбора данных. Таким образом, клиницист вынужден использовать сочетание высокоинформативных данных изображения относительно небольшого числа клеток и высококоличественных, но ограниченных данных из статистически значимых клеточных популяций, часто полученных в разное время и/или подвергающихся различным систематическим ошибкам при подготовке и сборе данных.
В идеале клиницист должен использовать единый протокол подготовки образцов и иметь доступ к изображениям стольких клеток, сколько необходимо, чтобы обеспечить надежный количественный анализ клеточных характеристик, предполагающий ограниченное число возможных диагнозов. Для клеток в биологических жидкостях, которые находятся во взвешенном состоянии благодаря методу отбора проб (например, тонкоигольной биопсии), высокоскоростная цифровая визуализация клеток в потоке в сочетании с программным обеспечением, способным к количественному анализу изображений на большом количестве клеток, позволяет достичь этой цели.
Ряд методов был разработан для визуализации клеток в потоке, начиная с очень скоро после появления обычной проточной цитометрии. Подходы включали методы стробирующего освещения, сканирование летающих пятен, отслеживание зеркала и проточную цитометрию со щелевым сканированием. 4 , 5 Проблемы, связанные с визуализацией клеток в потоке, включают достижение достаточной чувствительности флуоресценции, получение изображений с высоким пространственным разрешением, комбинирование изображений флуоресценции с другими режимами визуализации, такими как светлое поле (проходящий свет) или темное поле (рассеянный свет). и визуализацию всех клеток в потоке. До недавнего времени ни один метод не мог сочетать в себе все эти черты, но достижения последних 10 лет в технологии ПЗС-камер, оптической фильтрации и цифровых вычислений сделали его практичным.
Система ImageStream ® представляет собой коммерчески доступный проточный цитометр с визуализацией, в котором используются преимущества этих технологических достижений. Система сочетает в себе точный метод электронного отслеживания движущихся клеток с системой мультиспектральной визуализации высокого разрешения для получения нескольких изображений каждой клетки в различных режимах визуализации. Текущий коммерческий вариант одновременно получает шесть изображений каждой клетки с чувствительностью флуоресценции, сравнимой с обычной проточной цитометрией, и качеством изображения микроскопии 40X-60X. 6 , 7 Шесть изображений каждой клетки включают: изображение в боковом рассеянии (темное поле), изображение в проходящем свете (светлое поле) и четыре изображения флуоресценции, примерно соответствующие FL1, FL2, FL3 и FL4. спектральные полосы обычного проточного цитометра. Объектив изображения имеет числовую апертуру 0,75, а качество изображения сравнимо с микроскопией с увеличением от 40X до 60X, если судить на глаз. При производительности до 300 ячеек в секунду эта система может производить 60 000 изображений 10 000 ячеек примерно за 30 секунд и 600 000 изображений 100 000 ячеек чуть более чем за 5 минут.
Система сочетает в себе точный метод электронного отслеживания движущихся клеток с системой мультиспектральной визуализации высокого разрешения для получения нескольких изображений каждой клетки в различных режимах визуализации. Текущий коммерческий вариант одновременно получает шесть изображений каждой клетки с чувствительностью флуоресценции, сравнимой с обычной проточной цитометрией, и качеством изображения микроскопии 40X-60X. 6 , 7 Шесть изображений каждой клетки включают: изображение в боковом рассеянии (темное поле), изображение в проходящем свете (светлое поле) и четыре изображения флуоресценции, примерно соответствующие FL1, FL2, FL3 и FL4. спектральные полосы обычного проточного цитометра. Объектив изображения имеет числовую апертуру 0,75, а качество изображения сравнимо с микроскопией с увеличением от 40X до 60X, если судить на глаз. При производительности до 300 ячеек в секунду эта система может производить 60 000 изображений 10 000 ячеек примерно за 30 секунд и 600 000 изображений 100 000 ячеек чуть более чем за 5 минут.
Разработка надежного оборудования для получения десятков тысяч изображений требует гибкого и мощного аналитического программного обеспечения для выделения наиболее подходящих клеточных характеристик из данных, включая количественную морфологию, силу флуоресцентного сигнала, местоположение сигнала и другие характеристики изображения для любого конкретного показания. . В системе ImageStream используется пакет программного обеспечения для анализа данных IDEAS ® , который в настоящее время вычисляет более 40 количественных признаков на изображение, что дает около 250 признаков на ячейку. Эти функции могут использоваться клиницистом или исследователем для создания гистограмм и диаграмм рассеяния, как в стандартных программах анализа данных проточной цитометрии, хотя различные функции на основе изображений позволяют графически идентифицировать популяции на основе не только интенсивности флуоресценции, но и размера клеток. , форма, текстура, неоднородность распределения зондов, совместная локализация нескольких зондов и т. д. После того, как интересующие популяции были идентифицированы, их можно визуально осмотреть и охарактеризовать с помощью связанных с ними значений признаков с использованием статистики популяции, включая средние значения, медианы, стандартные отклонения. и стандартные статистические тесты. Достаточно большая популяция приведет к относительно узкому стандартному отклонению и позволит обнаруживать тонкие различия между выборками на основе изменений средних значений признаков популяции.
д. После того, как интересующие популяции были идентифицированы, их можно визуально осмотреть и охарактеризовать с помощью связанных с ними значений признаков с использованием статистики популяции, включая средние значения, медианы, стандартные отклонения. и стандартные статистические тесты. Достаточно большая популяция приведет к относительно узкому стандартному отклонению и позволит обнаруживать тонкие различия между выборками на основе изменений средних значений признаков популяции.
Карциномы являются наиболее распространенной формой рака и являются причиной большинства смертей от рака во всем мире. 8 Раннее выявление рака значительно улучшает прогноз, о чем свидетельствует снижение смертности от рака шейки матки на 70% после того, как мазок Папаниколау стал стандартным ежегодным обследованием в США. 9 Аналогичным образом, смертность от рака молочной железы снижается на 30% благодаря более раннему выявлению с помощью ручного обследования или маммографии.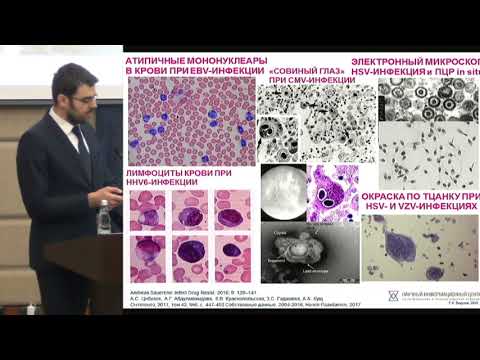 10 К сожалению, недоступность большинства тканей организма в настоящее время ограничивает возможности скрининга рака. Даже когда опухоли обнаруживаются существующими методами и удаляются хирургическим путем, существует сильная обратная корреляция между размером опухоли и исходом, поскольку предшествовавшая диссеминация метастатических клеток часто приводит к летальному исходу. 11 , 12
10 К сожалению, недоступность большинства тканей организма в настоящее время ограничивает возможности скрининга рака. Даже когда опухоли обнаруживаются существующими методами и удаляются хирургическим путем, существует сильная обратная корреляция между размером опухоли и исходом, поскольку предшествовавшая диссеминация метастатических клеток часто приводит к летальному исходу. 11 , 12
Анализ доступных биологических жидкостей для обнаружения опухолевых клеток значительно облегчит раннее выявление рака, а обнаружение микрометастаз в биологических жидкостях пациентов с ранней стадией рака может оказать существенное влияние на оптимизация терапевтических режимов и, следовательно, долгосрочный прогноз. Проточная цитометрия с визуализацией может увеличить раннее выявление некоторых видов рака посредством анализа клеток в биологических жидкостях, таких как обнаружение рака мочевого пузыря по моче и рака легких по мокроте.
Обнаружение опухолевых эпителиальных клеток в жидкостях организма, особенно при низкой частоте, долгое время было проблемой в клинической медицине. Классический анализ на основе микроскопии, хотя и является золотым стандартом в диагностике, не обладает достаточной пропускной способностью для надежной идентификации популяций редких клеток. Первоначально проточная цитометрия давала большие надежды, поскольку частота сбора данных была достаточно высокой, чтобы обеспечить значительное количество событий, но этот подход в значительной степени зависит от наличия флуоресцентно-меченых маркеров для различения нормальных клеток от неопластических, а «опухолеспецифические» маркеры, как правило, не идентифицируются. . Таким образом, использование этого подхода на основе антител зависит от эктопической экспрессии нормального антигенного эпитопа, образования нового эпитопа в результате генетической мутации или рекомбинации или последовательной модуляции экспрессии маркера, экспрессируемого как в трансформированных, так и в нетрансформированных клетках. Этот подход еще больше осложняется разнообразием неопластических трансформаций и генетической неоднородностью человеческой популяции.
Классический анализ на основе микроскопии, хотя и является золотым стандартом в диагностике, не обладает достаточной пропускной способностью для надежной идентификации популяций редких клеток. Первоначально проточная цитометрия давала большие надежды, поскольку частота сбора данных была достаточно высокой, чтобы обеспечить значительное количество событий, но этот подход в значительной степени зависит от наличия флуоресцентно-меченых маркеров для различения нормальных клеток от неопластических, а «опухолеспецифические» маркеры, как правило, не идентифицируются. . Таким образом, использование этого подхода на основе антител зависит от эктопической экспрессии нормального антигенного эпитопа, образования нового эпитопа в результате генетической мутации или рекомбинации или последовательной модуляции экспрессии маркера, экспрессируемого как в трансформированных, так и в нетрансформированных клетках. Этот подход еще больше осложняется разнообразием неопластических трансформаций и генетической неоднородностью человеческой популяции. 13 – 15
13 – 15
В отличие от одно- или многопараметрических методов на основе антител анализ клеточной морфологии является эффективным средством скрининга рака. Например, диспластические и неопластические клетки были обнаружены в легочной мокроте на основе морфологии. 16 Аналогичным образом было показано, что эксфолиированные клетки, собранные из смывов мочевого пузыря пациентов с раком мочевого пузыря, имеют отчетливые морфологические и генетические изменения. 17 Диспластическая морфология также является основным диагностическим критерием в мазках Папаниколау, где автоматизированный морфологический анализ на основе микроскопа показал свою эффективность и одобрен FDA для первичного скрининга. 18 , 19
В некоторых случаях, таких как обнаружение клеток карциномы в крови с помощью теста, выпускаемого Immunicon Corporation (Huntingdon Valley, PA), уникальные биохимические и морфологические характеристики клеток-мишеней обеспечивают огромное преимущество. В этом случае было показано, что комбинация обогащения с использованием маркера, специфичного для эпителиальных клеток (например, молекулы адгезии эпителиальных клеток), с последующим морфологическим анализом эффективна для обнаружения редких клеток у некоторых пациентов с метастатическим раком. 20 Однако примерно у двух третей пациентов с метастатическими карциномами либо не было обнаружено ни одной клетки карциномы, либо была обнаружена только одна определяемая клетка карциномы на 7,5 мл крови, что ниже текущего порога в пять циркулирующих опухолевых клеток, необходимого для постановки статистически надежного диагноза. 21 , 22 Помимо особого случая обнаружения опухолевых клеток в крови, основная проблема обнаружения рака заключается в том, что патологические клетки могут присутствовать в контексте большого количества нормальных клеток того же типа. , что приводит к увеличению времени анализа из-за относительно низкой скорости визуализации и анализа современных инструментов и программного обеспечения для визуализации.
В этом случае было показано, что комбинация обогащения с использованием маркера, специфичного для эпителиальных клеток (например, молекулы адгезии эпителиальных клеток), с последующим морфологическим анализом эффективна для обнаружения редких клеток у некоторых пациентов с метастатическим раком. 20 Однако примерно у двух третей пациентов с метастатическими карциномами либо не было обнаружено ни одной клетки карциномы, либо была обнаружена только одна определяемая клетка карциномы на 7,5 мл крови, что ниже текущего порога в пять циркулирующих опухолевых клеток, необходимого для постановки статистически надежного диагноза. 21 , 22 Помимо особого случая обнаружения опухолевых клеток в крови, основная проблема обнаружения рака заключается в том, что патологические клетки могут присутствовать в контексте большого количества нормальных клеток того же типа. , что приводит к увеличению времени анализа из-за относительно низкой скорости визуализации и анализа современных инструментов и программного обеспечения для визуализации.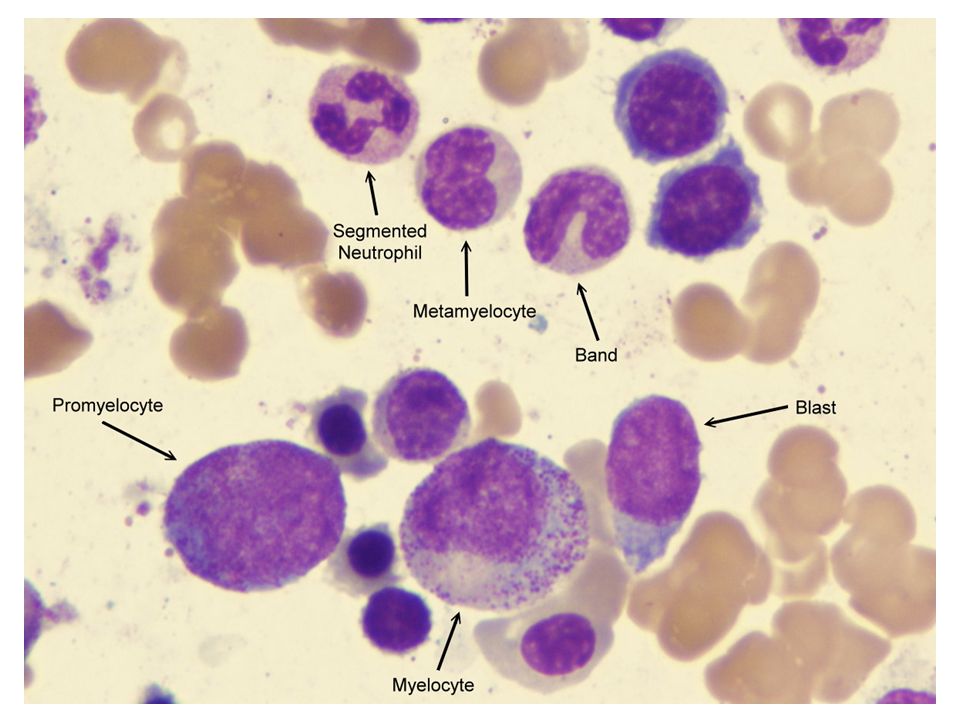
Система ImageStream обладает значительным потенциалом для расширения диагностических возможностей за счет объединения оценки экспрессированных маркеров, ассоциированных с опухолью, на основе антител с морфологическим анализом на единой технологической платформе. Чтобы получить доказательство принципиальных данных для различения опухолевых и нормальных эпителиальных клеток с использованием потоковых изображений, была визуализирована и проанализирована смесь как нормальных эпителиальных клеток молочной железы, так и клеток карциномы молочной железы. Клетки эпителиальной карциномы молочной железы получали в виде замороженных запасов из Американской коллекции типовых культур тканей (ATCC, Манассас, Вирджиния). Чтобы лучше контролировать изменчивость опухоли к опухоли, три разные клеточные линии эпителиальной карциномы молочной железы, полученные от разных пациентов (HCC-1500, HCC-1569, и HCC-1428) были объединены в равных концентрациях для исследования. Линии клеток прикреплялись к пластику и размножались обычными методами культивирования тканей.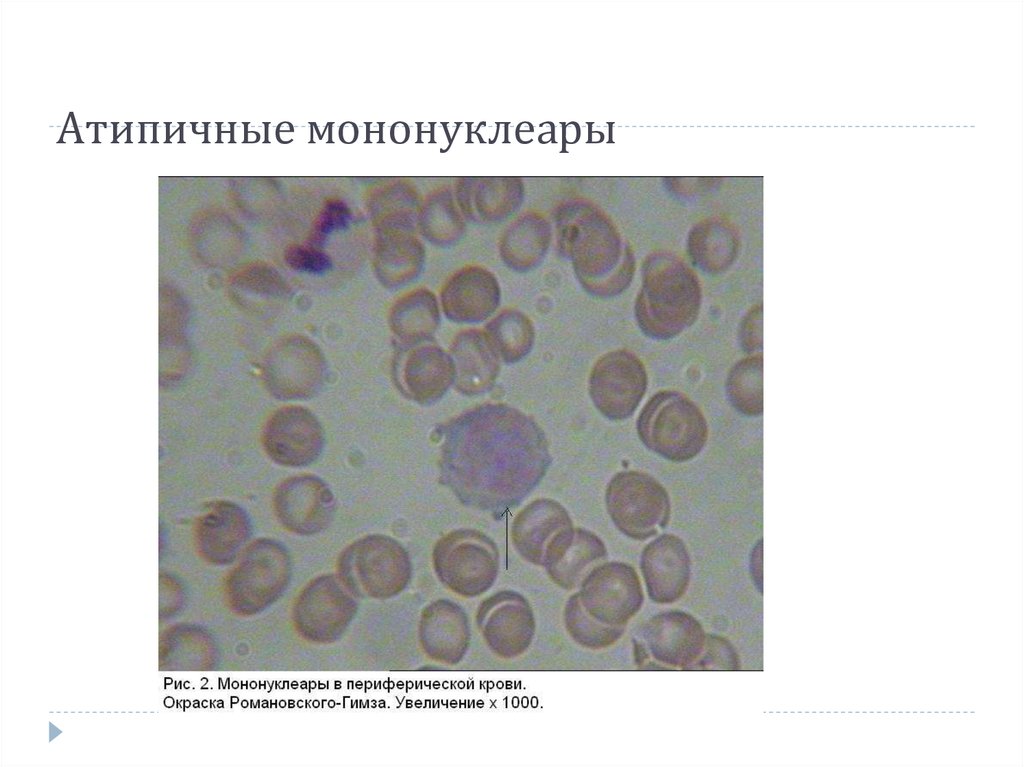 Нормальные эпителиальные клетки молочной железы были получены от Cambrex Biosciences (Walkersville, MD) и размножены в соответствии с рекомендациями.
Нормальные эпителиальные клетки молочной железы были получены от Cambrex Biosciences (Walkersville, MD) и размножены в соответствии с рекомендациями.
Нормальные и опухолевые эпителиальные клетки молочной железы собирали отдельно путем кратковременной инкубации с трипсином/ЭДТА при 37°C. Клетки однократно промывали холодным PBS, содержащим 1% FCS, подсчитывали и использовали в эксперименте. Нормальные эпителиальные клетки молочной железы окрашивали моноклональными антителами, конъюгированными с флуоресцеином, к HLA класса I путем инкубации клеток с соответствующим предварительно определенным разведением mAb в течение 30 минут при 4°C. Мечение нормальных эпителиальных клеток молочной железы анти- МНС класса I позволило идентифицировать нормальные клетки в смесях нормальных клеток и клеток карциномы, тем самым обеспечивая объективную «истину», облегчающую идентификацию признаков изображения, которые отличают нормальные эпителиальные клетки от клеток карциномы. Известно, что карциномы молочной железы подавляют экспрессию MHC класса I, но в качестве меры предосторожности против пассивного переноса антител в клетки карциномы как нормальные, так и объединенные клетки карциномы перед смешиванием фиксировали по отдельности в 1% параформальдегиде.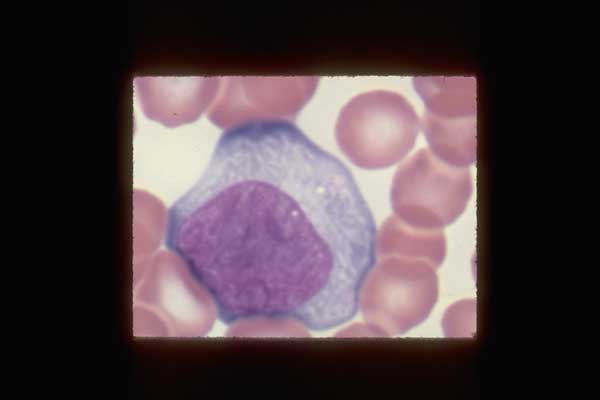 DRAQ5, ДНК-связывающий краситель, который можно возбуждать лазером с длиной волны 488 нм и излучать в красном цвете (BioStatus, Ltd, Лестершир, Великобритания), добавляли к образцу перед запуском в ImageStream, предоставляя данные о содержании ДНК и характеристиках ядерной морфологии для анализа. Анализ.
DRAQ5, ДНК-связывающий краситель, который можно возбуждать лазером с длиной волны 488 нм и излучать в красном цвете (BioStatus, Ltd, Лестершир, Великобритания), добавляли к образцу перед запуском в ImageStream, предоставляя данные о содержании ДНК и характеристиках ядерной морфологии для анализа. Анализ.
После выполнения спектральной компенсации файла данных был проведен первоначальный визуальный осмотр для сравнения нормальных эпителиальных клеток молочной железы (положительных на HLA класса I) с неокрашенными клетками карциномы. Репрезентативные изображения нормальных клеток показаны на , а репрезентативные клетки карциномы показаны на . На обоих рисунках каждая клетка представлена в виде ряда псевдоцветных изображений в 6 каналах (слева направо): канал 1 — синее боковое рассеяние лазера (темное поле), канал 2 — пустой, канал 3 — зеленая флуоресценция HLA-FITC, канал 4 — пустой, Канал 5 – светлопольные изображения, а канал 6 – красная флуоресценция ядер.
Открыть в отдельном окне
Нормальные эпителиальные клетки молочной железы. Каждая клетка представлена рядом из четырех изображений, полученных одновременно в потоке слева направо: темное поле (синий), флуоресценция FITC от маркера HLA, примененная только к нормальным клеткам (зеленый), светлое поле (серый) и флуоресценция ДНК. связывающий краситель DRAQ5 (красный).
Каждая клетка представлена рядом из четырех изображений, полученных одновременно в потоке слева направо: темное поле (синий), флуоресценция FITC от маркера HLA, примененная только к нормальным клеткам (зеленый), светлое поле (серый) и флуоресценция ДНК. связывающий краситель DRAQ5 (красный).
Открыть в отдельном окне
Клетки карциномы молочной железы. Каждая клетка представлена рядом из четырех изображений, полученных одновременно в потоке слева направо: темное поле (синий), флуоресценция FITC (зеленый), светлое поле (серый) и флуоресценция от ДНК-связывающего красителя DRAQ5 (красный).
Качественные наблюдения послужили отправной точкой для выявления количественных признаков, отличающих две популяции. Было отмечено, что нормальные клетки имеют более высокую интенсивность рассеяния и гетерогенность, обычно они крупнее и имеют более низкую интенсивность ядер. Последующий анализ был направлен на количественную оценку этих различий, а также на обнаружение дополнительных параметров, которые могли бы иметь дискриминационную силу.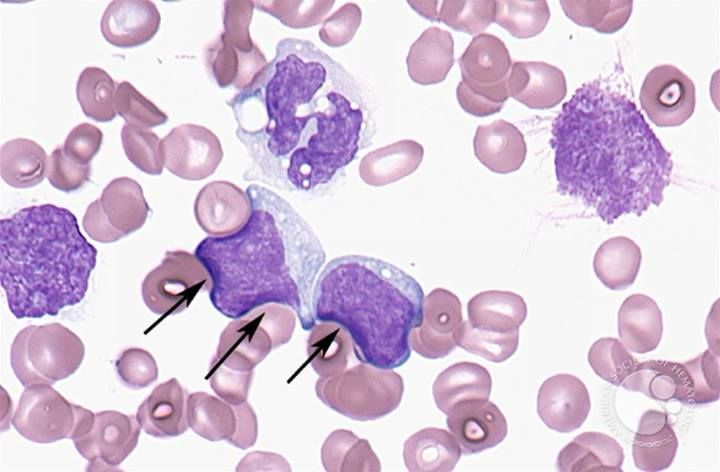 Скриншот анализа нескольких различающих параметров с помощью IDEAS показан на рис.
Скриншот анализа нескольких различающих параметров с помощью IDEAS показан на рис.
Открыть в отдельном окне
Снимок экрана пакета статистического анализа изображений IDEAS. Каждая из 10 дифференциальных гистограмм представляет собой отдельный количественный параметр, который различает нормальные клетки молочной железы (зеленые распределения) и клетки карциномы молочной железы (красные распределения), смешанные в одном и том же образце.
Анализ, показанный на рис., основан на точечном графике в левом верхнем углу рисунка. Одиночные клетки были впервые идентифицированы на основе точечной диаграммы площади светлого поля в зависимости от соотношения сторон. Ворота были нарисованы вокруг популяции, содержащей предполагаемые одиночные клетки, на основе критериев достаточной площади, чтобы исключить мусор, и отношения сторон, превышающего ~0,5, что исключает дублеты и кластеры. Достоверность стробирования была проверена путем изучения случайных ячеек как внутри, так и за пределами ворот с использованием функции «виртуальной сортировки ячеек» программного обеспечения, которая позволяет визуально проверять отдельные ячейки, щелкая отдельные точки на графике, и представлять галереи изображений клеток. соответствующие только тем ячейкам, которые попадают в конкретную закрытую область.
соответствующие только тем ячейкам, которые попадают в конкретную закрытую область.
Затем нормальные клетки молочной железы отличали от клеток карциномы молочной железы с использованием mAb против HLA класса I, которое наносили только на нормальные клетки. Была создана сплошная желтая гистограмма интенсивности FITC, которая показана справа от точечного графика. Затем FITC-положительные (нормальные эпителиальные клетки молочной железы) и FITC-отрицательные (клетки эпителиальной карциномы молочной железы) гейтировали, как показано на графике, в результате чего были получены популяции из 2031 нормальных клеток и 611 клеток карциномы. Эти популяции затем использовались для идентификации признаков, которые количественно отличали нормальные и раковые клетки на основе дифференциальных гистограмм.
Остальные 10 графиков представляют собой дифференциальные гистограммы нормальных клеток (зеленые популяции) и клеток карциномы (красные популяции), причем каждый график представляет разные количественные характеристики.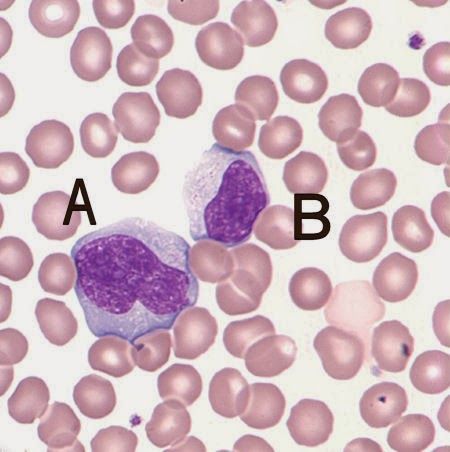 10 отличительных признаков были разделены на пять различных классов: интенсивность рассеяния, текстура рассеяния, морфология, интенсивность ядер и текстура ядер.
10 отличительных признаков были разделены на пять различных классов: интенсивность рассеяния, текстура рассеяния, морфология, интенсивность ядер и текстура ядер.
Дифференциальные гистограммы 1–3 показали разницу между двумя популяциями с использованием трех различных, но коррелирующих характеристик интенсивности рассеяния: «средняя интенсивность рассеяния» (общая интенсивность, деленная на площадь клетки), «интенсивность рассеяния» (общая интенсивность минус фон), и «малое суммарное пятно рассеяния» (суммарная интенсивность максимумов локального рассеяния). Хотя все три характеристики интенсивности рассеяния обеспечивали хорошее различение, «средняя интенсивность рассеяния» была наиболее избирательной.
Дифференциальные гистограммы 4-5 количественно определяли текстуру рассеяния с использованием либо показателя градиента профиля интенсивности («среднеквадратичное значение градиента рассеяния»), либо дисперсии интенсивностей пикселей («частота рассеяния»), что оказалось более избирательным.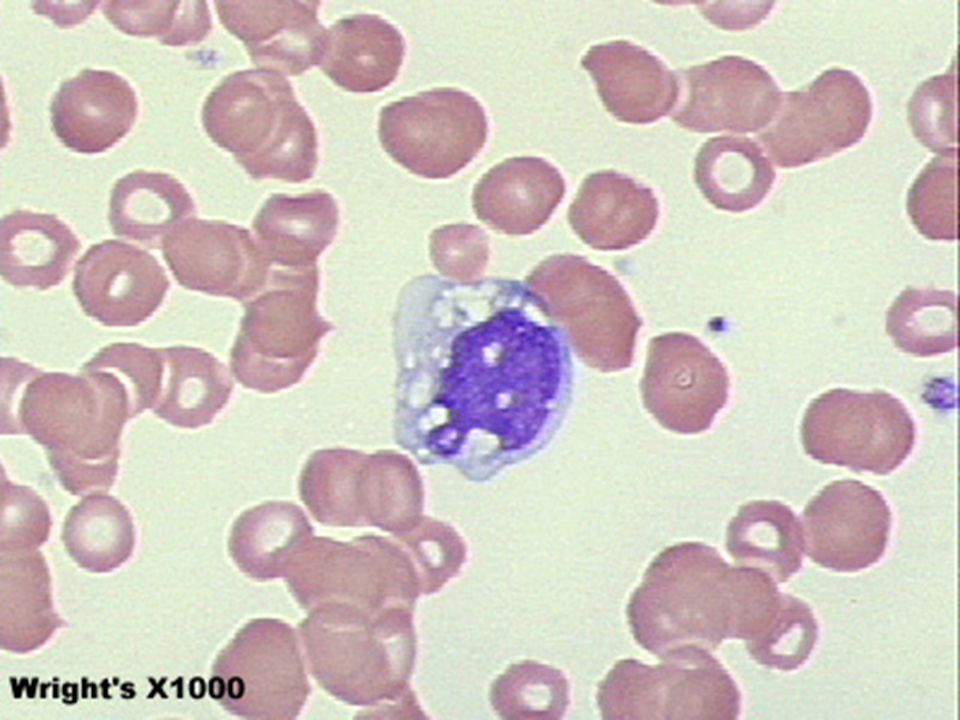
Дифференциальные гистограммы 6-8 изображали клеточную площадь (область светлого поля), ядерную область (по изображениям флуоресценции ДНК) и цитоплазматическую площадь (разность клеточной и ядерной площадей). Клеточные линии карциномы, как правило, были меньше в светлом поле, что подтверждает качественные наблюдения изображений клеток. Площадь ядра клеточных линий карциномы была меньше, чем у нормальных клеток, но в степени, пропорциональной разнице в площади клеток, поэтому соотношение площади ядра/клетки не было дискриминационным. Однако площадь цитоплазмы была значительно меньше в клетках карциномы.
Наконец, дифференциальные гистограммы 9 и 10 изображали среднюю интенсивность ядер и частоту ядер (гетерохроматичность) соответственно. Как и в случае с разбросом, обе эти характеристики давали некоторую дискриминационную силу.
Мультиспектральные/мультимодальные изображения, собранные с помощью ImageStream и проанализированные с помощью программного пакета IDEAS в этом инженерном эксперименте, выявили ряд существенных различий в характеристиках темного поля, клеточной морфологии, содержании ДНК и ядерной морфологии между нормальными эпителиальными и эпителиальными клетками карциномы.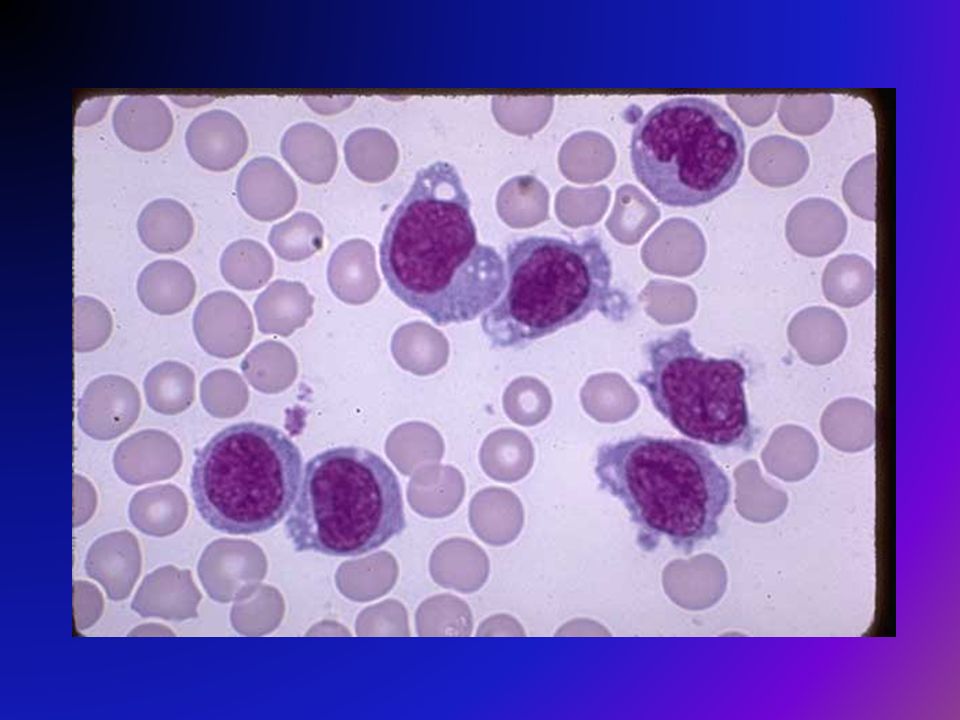 Хотя общеизвестно, что клетки, адаптированные к культуре ткани, подвергались процессу селекции, который мог изменить их клеточные характеристики, эти данные демонстрируют возможность создания автоматизированного классификатора, который использует морфометрические и фотометрические признаки, определенные и описанные выше, для разделения в норме из трансформированных эпителиальных клеток и, возможно, других типов клеток. Использование маркеров на основе антител, ассоциированных с опухолями, может быть синергично с морфологическим анализом, чтобы обеспечить более глубокое понимание диспластических изменений и неопластических трансформаций, а также более точное определение стадии этих патологий.
Хотя общеизвестно, что клетки, адаптированные к культуре ткани, подвергались процессу селекции, который мог изменить их клеточные характеристики, эти данные демонстрируют возможность создания автоматизированного классификатора, который использует морфометрические и фотометрические признаки, определенные и описанные выше, для разделения в норме из трансформированных эпителиальных клеток и, возможно, других типов клеток. Использование маркеров на основе антител, ассоциированных с опухолями, может быть синергично с морфологическим анализом, чтобы обеспечить более глубокое понимание диспластических изменений и неопластических трансформаций, а также более точное определение стадии этих патологий.
Проточная цитометрия с визуализацией совместима с широким спектром протоколов окрашивания клеток, разработанных для обычной проточной цитометрии, а также протоколов, разработанных для визуализации клеток на предметных стеклах, хотя и с модификациями протокола для формата суспензии. Гибридизация Fluorescence in situ (FISH) признана приложением для визуализации на слайдах, которое может значительно выиграть за счет большей пропускной способности и количественного анализа проточной цитометрии; и несколько групп адаптировали методы гибридизации к клеткам в суспензии.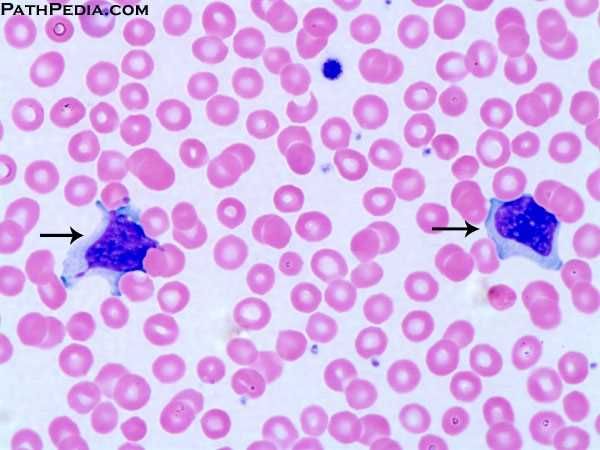 23 – 26 Однако отсутствие пространственного разрешения в стандартной проточной цитометрии требует замены общей интенсивности зонда на точечный подсчет в качестве средства оценки результатов, тем самым предотвращая использование проточной цитометрии для анализа транслокаций, инверсии или другие перестановки. Хотя существуют определенные специфические приложения FISH, которые имеют сильные и устойчивые сигналы, такие как анализ длины теломер или обнаружение присутствия или отсутствия Y-хромосомы, вариация интенсивности зонда FISH может быть высокой, а интенсивность сигнала часто приближается к пределам обнаружения стандартного потока. цитометрия, снижающая достоверность оценки анеуплоидии. 27 – 30
23 – 26 Однако отсутствие пространственного разрешения в стандартной проточной цитометрии требует замены общей интенсивности зонда на точечный подсчет в качестве средства оценки результатов, тем самым предотвращая использование проточной цитометрии для анализа транслокаций, инверсии или другие перестановки. Хотя существуют определенные специфические приложения FISH, которые имеют сильные и устойчивые сигналы, такие как анализ длины теломер или обнаружение присутствия или отсутствия Y-хромосомы, вариация интенсивности зонда FISH может быть высокой, а интенсивность сигнала часто приближается к пределам обнаружения стандартного потока. цитометрия, снижающая достоверность оценки анеуплоидии. 27 – 30
Проточная цитометрия с визуализацией потенциально хорошо подходит для анализа FISH, поскольку предел обнаружения проточной цитометрии с визуализацией улучшается по мере уменьшения размера источника флуоресцентного сигнала. 31 Кроме того, количественный анализ клеток, подвергнутых FISH-зондированию, для таких приложений, как анализ анеуплоидии, выполняется путем точечного подсчета, а не исключительно анализа общей интенсивности, что делает его терпимым к широким колебаниям интенсивности зонда и более соответствует стандарту практики в клиническая оценка FISH.
31 Кроме того, количественный анализ клеток, подвергнутых FISH-зондированию, для таких приложений, как анализ анеуплоидии, выполняется путем точечного подсчета, а не исключительно анализа общей интенсивности, что делает его терпимым к широким колебаниям интенсивности зонда и более соответствует стандарту практики в клиническая оценка FISH.
Чтобы изучить полезность визуализации проточной цитометрии для клинического анализа FISH, мононуклеарные клетки периферической крови человека (PBMC) были получены (AllCells, Сан-Диего, Калифорния) и исследованы с использованием протокола FISH в суспензии (FISHIS ® ), разработанного в Amnis Корпорация. Клетки фиксировали и пермеабилизировали последовательными инкубациями в 30% (30 минут при 4°С), затем 70% (10 минут при 4°С) растворе Карнуа (3:1 метанол:уксусная кислота) в PBS. После центрифугирования клетки промывали один раз в 2X SSC, затем ресуспендировали в буфере для гибридизации, содержащем меченый SpectrumGreen зонд для подсчета хромосомы 12 в соответствии с указаниями производителя (Vysis, Des Plaines, IL).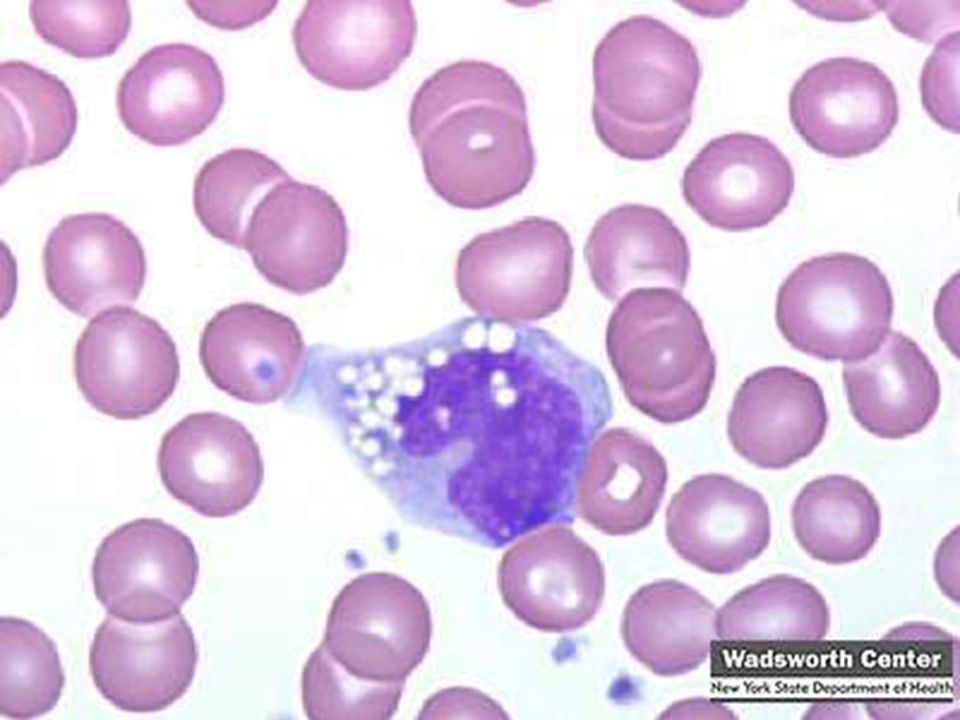 Для гибридизации зонда клетки в пробирках для ПЦР подвергали воздействию температуры 80°С в течение 5 минут и 42°С в течение 2 часов в ДНК-термоциклере. В пробирки добавляли 100 мкл 2X SSC и клетки осаждали центрифугированием. Клетки ресуспендировали в 0,4X SSC, содержащем 0,3% NP40, и выдерживали при 72°C в течение 2 минут. Клетки центрифугировали и затем осадки ресуспендировали в 50 мкл 1% параформальдегида (в PBS). Затем образец был загружен в систему ImageStream, и был собран файл из 3500 ячеек.
Для гибридизации зонда клетки в пробирках для ПЦР подвергали воздействию температуры 80°С в течение 5 минут и 42°С в течение 2 часов в ДНК-термоциклере. В пробирки добавляли 100 мкл 2X SSC и клетки осаждали центрифугированием. Клетки ресуспендировали в 0,4X SSC, содержащем 0,3% NP40, и выдерживали при 72°C в течение 2 минут. Клетки центрифугировали и затем осадки ресуспендировали в 50 мкл 1% параформальдегида (в PBS). Затем образец был загружен в систему ImageStream, и был собран файл из 3500 ячеек.
представляет собой галерею из 15 отдельных ячеек из файла данных РВМС, пронумерованных в порядке их прохождения через прибор. Каждая клетка представлена рядом изображений (LR): темное поле, флуоресценция хромосомы 12, светлое поле и наложение изображений флуоресценции и светлого поля. Дублеты и более крупные кластеры были исключены из анализа путем нанесения площади на соотношение сторон светлопольного изображения каждой клетки на точечной диаграмме и стробирования отдельных клеток, которые представляли примерно 60% данных и были четко дифференцированы как популяция, имеющая аспект (длина к ширине) близко к единице, а площадь меньше, чем у дублетов и скоплений.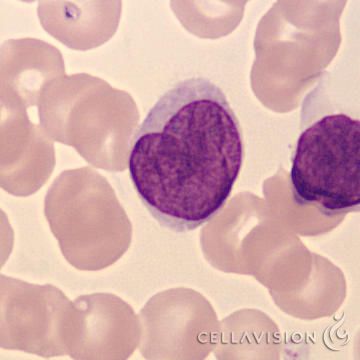 Никакого другого предварительного отбора не проводилось, поэтому галерея представляет объективную выборку данных FISH в популяциях РВМС. Большинство клеток имели два хорошо разрешенных пятна FISH, соответствующие двум копиям хромосомы 12. Однако часть клеток имела одно или оба пятна FISH в некоторой степени не в фокусе и/или только одно видимое пятно, соответствующее клетке. ориентация, которая накладывала пятна FISH с точки зрения системы визуализации. Расфокусировка – это проблема, которая увеличивается с размером клетки, в то время как частота наложения пятен FISH будет иметь тенденцию к уменьшению по мере увеличения размера клетки. Было обнаружено, что клетки в файле данных PBMC имеют средний диаметр 6,4 +/-0,7 микрона, что относительно мало по сравнению с размером ядра многих типов эпителиальных клеток.
Никакого другого предварительного отбора не проводилось, поэтому галерея представляет объективную выборку данных FISH в популяциях РВМС. Большинство клеток имели два хорошо разрешенных пятна FISH, соответствующие двум копиям хромосомы 12. Однако часть клеток имела одно или оба пятна FISH в некоторой степени не в фокусе и/или только одно видимое пятно, соответствующее клетке. ориентация, которая накладывала пятна FISH с точки зрения системы визуализации. Расфокусировка – это проблема, которая увеличивается с размером клетки, в то время как частота наложения пятен FISH будет иметь тенденцию к уменьшению по мере увеличения размера клетки. Было обнаружено, что клетки в файле данных PBMC имеют средний диаметр 6,4 +/-0,7 микрона, что относительно мало по сравнению с размером ядра многих типов эпителиальных клеток.
Открыть в отдельном окне
Мононуклеарные клетки периферической крови человека, гибридизованные в суспензии с зондом хромосомы 12. Каждая ячейка представлена рядом из четырех изображений слева направо: темное поле (синий), флуоресценция от зонда хромосомы 12-SpectrumGreen (зеленый), светлое поле (серый) и наложение флуоресцентного и светлопольного изображений. Беспристрастный выбор клеток иллюстрирует изменение интенсивности зонда, качества фокусировки и ориентации относительно оптической оси.
Беспристрастный выбор клеток иллюстрирует изменение интенсивности зонда, качества фокусировки и ориентации относительно оптической оси.
Чтобы устранить ограничение, которое ограниченная глубина резкости накладывает на анализ FISH в более крупных клетках, оцениваемых с помощью проточной цитометрии, был разработан прототип системы ImageStream с возможностями сбора изображений с увеличенной глубиной резкости (EDF). 32 Версия EDF системы ImageStream включает в себя специализированный оптический элемент в стандартной оптической системе, который обеспечивает одновременное отображение света от самых разных фокусных положений объекта на плоскости детектора в процессе, называемом кодированием волнового фронта™. разработчик, CDM Optics, Inc. (Боулдер, Колорадо). 33 Измененное изображение подвергается постобработке для восстановления резкости изображения с сохранением увеличенной глубины резкости, обусловленной изменением волнового фронта во время сбора данных. Изображения, полученные с помощью версии системы EDF, имеют эффективную глубину резкости примерно 15 микрон, в результате чего получается изображение клетки с высоким разрешением, в котором все функции находятся в фокусе одновременно.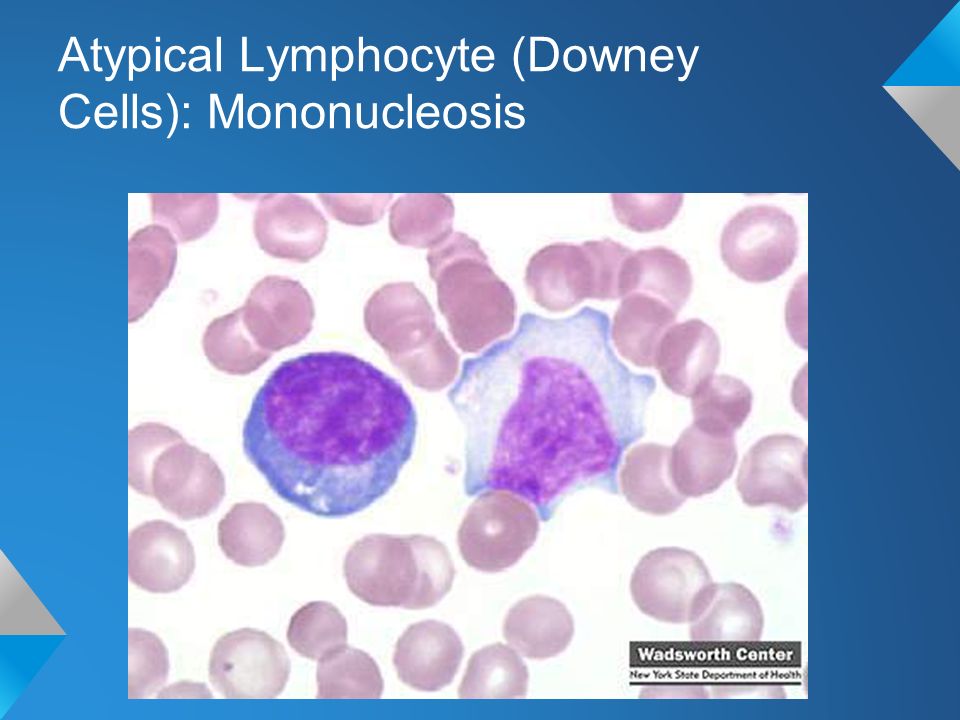 В отличие от методов конфокального наложения изображений методология кодирования волнового фронта позволяет получать изображения со скоростью сотни ячеек в секунду.
В отличие от методов конфокального наложения изображений методология кодирования волнового фронта позволяет получать изображения со скоростью сотни ячеек в секунду.
Чтобы сравнить изображения FISH между стандартной конфигурацией ImageStream и увеличенной глубиной резкости, клетки лимфомы человека Jurkat (ATCC) выращивали в суспензионной культуре, гибридизовали с зондом хромосомы 8 (Vysis) с использованием протокола FISHIS, описанного выше, и визуализировали используя как EDF, так и стандартные конфигурации ImageStream. и состоят из галерей стандартных и EDF-изображений, соответственно, гибридизованных клеток Jurkat, классифицированных как дисомные по хромосоме 8. В обеих галереях каждая клетка представлена и наложена на ее изображение точечной флуоресценции FISH (зеленый) на ее изображение в светлом поле с уменьшенным контрастом. приобрели одновременно. Поскольку известно, что Jukats проявляют цитогенетическую нестабильность, в каждую галерею были включены только отдельные клетки на основании их автоматической классификации как имеющих два пятна FISH хромосомы 8, но при выборе 25 изображений, показанных на каждом рисунке, не использовались критерии субъективного отбора.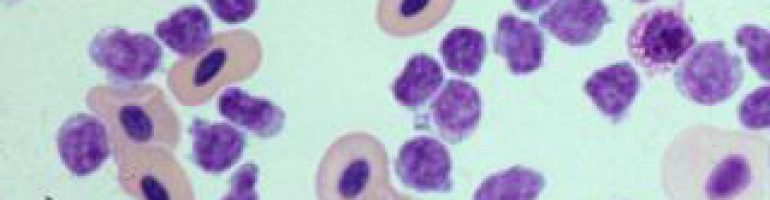 Степень улучшения фокусировки пятна FISH с визуализацией EDF качественно очевидна и повышает точность автоматических характеристик анализа пятна (например, пиковой интенсивности, размера пятна, среднего расстояния разделения и т. д.) в десять раз. 32
Степень улучшения фокусировки пятна FISH с визуализацией EDF качественно очевидна и повышает точность автоматических характеристик анализа пятна (например, пиковой интенсивности, размера пятна, среднего расстояния разделения и т. д.) в десять раз. 32
Открыть в отдельном окне
Клетки Jurkat, гибридизованные в суспензии с зондом хромосомы 8 и визуализированные в потоке с использованием стандартной оптики. Каждая клетка представлена суперпозицией флуоресцентных (зеленый) и светлопольных (серый) изображений ее хромосомы 8. Клетки Jurkat больше, чем клетки PBMC человека, и усугубляют различия в качестве фокусировки изображения.
Открыть в отдельном окне
Клетки Jurkat, гибридизованные в суспензии с зондом хромосомы 8 и визуализированные в потоке с использованием оптики с увеличенной глубиной резкости. Каждая клетка представлена суперпозицией флуоресцентных (зеленый) и светлопольных (серый) изображений ее хромосомы 8. Изображение с увеличенной глубиной резкости значительно улучшает качество фокусировки и точность подсчета точек FISH.
Проточная цитометрия с визуализацией сочетает сильные стороны микроскопии с преимуществами проточной цитометрии, сочетая количественную морфологию высокого разрешения и локализацию флуоресцентных зондов с чувствительными многоцветными фенотипическими данными из статистически значимых популяций клеток в течение нескольких минут. Технология коммерчески доступна для использования в исследованиях и оценивается на предмет ее клинического применения. Как показано в описанных здесь технико-экономических обоснованиях, этот метод может значительно повысить способность клинициста идентифицировать диспластические и неопластические клетки, полученные из биологических жидкостей. С добавлением расширенных возможностей глубины резкости этот метод также может значительно улучшить точность и точность.0003
Раскрытие информации: Авторы этой главы являются акционерами и сотрудниками Amnis Corporation. Эта работа была частично поддержана номерами грантов 9 R44 CA01798-02 и 1 R43 GM58956-01 от Национальных институтов здравоохранения и номером контракта NNA05CR09C от Национального управления по аэронавтике и исследованию космического пространства.
Правовая оговорка издателя: Это PDF-файл неотредактированной рукописи, принятой к публикации. В качестве услуги нашим клиентам мы предоставляем эту раннюю версию рукописи. Рукопись будет подвергнута редактированию, набору текста и рецензированию полученного доказательства, прежде чем она будет опубликована в ее окончательной цитируемой форме. Обратите внимание, что в процессе производства могут быть обнаружены ошибки, которые могут повлиять на содержание, и все правовые оговорки, применимые к журналу, относятся к нему.
1. Франкастель С., Уолтерс М.С., Гроудин М., Мартин Д.И. Функциональный энхансер подавляет молчание трансгена и предотвращает его локализацию вблизи центрометрического гетерохроматина. Клетка. 1999 г., 29 октября; 99 (3): 259–269. [PubMed] [Google Scholar]
2. Hulspas R, Bauman JG. Использование флуоресцентной гибридизации in situ для анализа ядерной архитектуры с помощью конфокальной микроскопии. Cell Biol Int Rep. 1992 Aug; 16 (8): 739–747.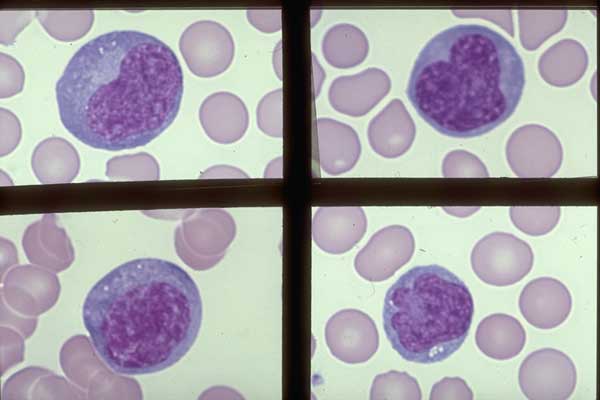 [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
3. Orchard JA, Ibbotson RE, Davis Z, et al. Экспрессия ZAP-70 и прогноз при хроническом лимфоцитарном лейкозе. Ланцет. 2004 10 января; 363 (9)403): 105–111. [PubMed] [Google Scholar]
4. Кей Д.Б., Камбье Дж.Л., Уилесс Л.Л., мл. Визуализация в потоке. J Гистохим Цитохим. 1979 г., январь; 27 (1): 329–334. [PubMed] [Google Scholar]
5. Cambier JL, Kay DB, Wheeless LL., Jr Многомерная система щелевого сканирования потока. J Гистохим Цитохим. 1979 г., январь; 27 (1): 321–324. [PubMed] [Google Scholar]
6. Басиджи Д.А., Ортын В.Е. Отображение и анализ параметров небольших движущихся объектов, таких как клетки. Amnis Corporation, правопреемник. патент США 6211955. 2001. 29 марта 2000 г.
7. Басиджи Д.А., Ортын В.Е. Отображение и анализ параметров небольших движущихся объектов, таких как клетки. Amnis Corporation, правопреемник. Патент США 6249341. 2001. 24.01.2000.
8. Pantel K, von Knebel Doeberitz M. Обнаружение и клиническая значимость микрометастатических раковых клеток. Curr Opin Oncol. 2000 г., январь; 12 (1): 95–101. [PubMed] [Google Scholar]
Curr Opin Oncol. 2000 г., январь; 12 (1): 95–101. [PubMed] [Google Scholar]
9. Факты и цифры о раке. Атланта: Американское онкологическое общество; 2004. [Google Scholar]
10. Ries L, Kosary C, Hankey B, Miller B, Edwards B, редакторы. Обзор статистики рака SEER 1973-1996. Bethesda: Национальный институт рака; 1999. [Google Scholar]
11. Dooley WC. Перспективы на будущее: чистка зубов под контролем дуктоскопии и биопсия. Клин Лаб Мед. 2005 г., декабрь; 25 (4): 845–850. икс. [PubMed] [Google Scholar]
12. Pantel K, Riethmuller G. Выявление микрометастаз и лечение моноклональными антителами. Курр Топ Микробиол Иммунол. 1996; 213 (часть 3): 1–18. [PubMed] [Google Scholar]
13. Herlyn D, Herlyn M, Ross AH, Ernst C, Atkinson B, Koprowski H. Эффективный отбор моноклональных антител, ингибирующих рост опухоли человека. Дж Иммунол Методы. 1984 12 октября; 73 (1): 157–167. [PubMed] [Google Scholar]
14. Leitzel K, Lieu B, Curley E, et al. Выявление раковых клеток в периферической крови больных раком молочной железы с помощью обратной транскрипционно-полимеразной цепной реакции на рецептор эпидермального фактора роста. Clin Cancer Res, декабрь 1998 г .; 4 (12): 3037–3043. [PubMed] [Google Scholar]
Clin Cancer Res, декабрь 1998 г .; 4 (12): 3037–3043. [PubMed] [Google Scholar]
15. Юаса Т., Йошики Т., Танака Т., Исоно Т., Окада Ю. Обнаружение циркулирующих клеток рака яичка в периферической крови. Рак Летт. 1999 г., 23 августа; 143 (1): 57–62. [PubMed] [Академия Google]
16. Мелкая TL. Раннее выявление карциномы легкого с помощью цитологического исследования мокроты. Рак. 2000 1 декабря; 89 11: 2461–2464. [PubMed] [Google Scholar]
17. Halling KC, King W, Sokolova IA, et al. Сравнение цитологии и флуоресцентной гибридизации in situ для выявления уротелиальной карциномы. Дж Урол. 2000 г., ноябрь; 164 (5): 1768–1775. [PubMed] [Google Scholar]
18. Lee JS, Bannister WI, Kuan LC, Bartels PH, Nelson AC. Стратегия обработки для автоматизированного скрининга мазка Папаниколау. Анальный Quant Cytol Histol. 1992 октября; 14 (5): 415–425. [PubMed] [Google Scholar]
19. Паттен С.Ф., мл., Ли Дж.С., Нельсон А.С. NeoPath, Inc. NeoPath AutoPap 300 Автоматическая система для скрининга Папаниколау. Акта Цитол. 1996 г., январь-февраль; 40 (1): 45–52. [PubMed] [Google Scholar]
Акта Цитол. 1996 г., январь-февраль; 40 (1): 45–52. [PubMed] [Google Scholar]
20. Rao CG, Chianese D, Doyle GV, et al. Экспрессия молекулы адгезии эпителиальных клеток в клетках карциномы, присутствующих в крови, а также в первичных и метастатических опухолях. Int J Oncol. 2005 г., июль; 27 (1): 49–57. [PubMed] [Google Scholar]
21. Тиббе А.Г., Миллер М.С., Терстаппен Л.В. Статистические соображения для подсчета циркулирующих опухолевых клеток. Цитометрия А. 2 января 2007 г .; [PubMed] [Академия Google]
22. Allard WJ, Matera J, Miller MC, et al. Опухолевые клетки циркулируют в периферической крови при всех основных карциномах, но не у здоровых людей или пациентов с незлокачественными заболеваниями. Клин Рак Рез. 2004 г., 15 октября; 10 (20): 6897–6904. [PubMed] [Google Scholar]
23. Steinhaeuser U, Starke H, Nietzel A, et al. Подвеска (S)-FISH, новая методика для интерфазных ядер. J Гистохим Цитохим. 2002 г., декабрь; 50 (12): 1697–1698. [PubMed] [Google Scholar]
24.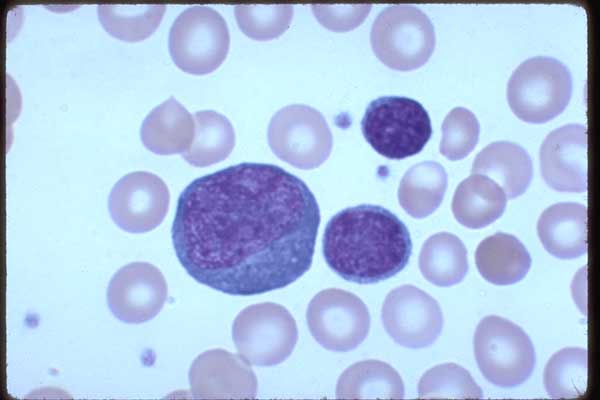 Trask B, van den Engh G, Pinkel D, et al. Флуоресцентная гибридизация in situ с ядрами интерфазных клеток в суспензии позволяет проводить проточный цитометрический анализ содержания хромосом и микроскопический анализ организации ядер. Хам Жене. 1988 марта; 78 (3): 251–259. [PubMed] [Google Scholar]
Trask B, van den Engh G, Pinkel D, et al. Флуоресцентная гибридизация in situ с ядрами интерфазных клеток в суспензии позволяет проводить проточный цитометрический анализ содержания хромосом и микроскопический анализ организации ядер. Хам Жене. 1988 марта; 78 (3): 251–259. [PubMed] [Google Scholar]
25. Trask B, van den Engh G, Landegent J, in de Wal NJ, van der Ploeg M. Обнаружение последовательностей ДНК в ядрах в суспензии с помощью гибридизации in situ и двухлучевой проточной цитометрии. Наука. 1985 г., 20 декабря; 230 (4732): 1401–1403. [PubMed] [Google Scholar]
26. Бауман Дж. Г., ван Деккен Х. Проточная цитометрия флуоресцентной гибридизации in situ для обнаружения специфических последовательностей РНК и ДНК. Приложение Acta Histochem. 1989; 37: 65–69. [PubMed] [Академия Google]
27. Baumgartner A, Schmid TE, Maerz HK, Adler ID, Tarnok A, Nuesse M. Автоматизированная оценка частот анеуплоидных сперматозоидов с помощью лазерной сканирующей цитометрии (LSC) Цитометрия.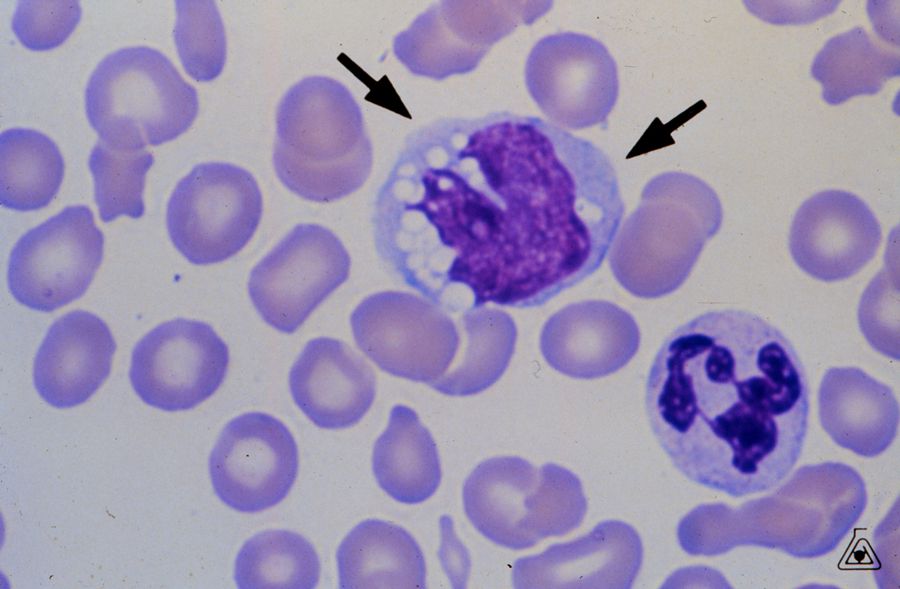 2001 г., 1 июня; 44 (2): 156–160. [PubMed] [Google Scholar]
2001 г., 1 июня; 44 (2): 156–160. [PubMed] [Google Scholar]
28. Baerlocher GM, Mak J, Tien T, Lansdorp PM. Измерение длины теломер с помощью флуоресцентной гибридизации in situ и проточной цитометрии: подсказки и ловушки. Цитометрия. 2002;47(2):89–99. [PubMed] [Google Scholar]
29. Rufer N, Dragowska W, Thornbury G, Roosnek E, Lansdorp PM. Динамика длины теломер в субпопуляциях лимфоцитов человека, измеренная методом проточной цитометрии. Нац биотехнолог. 1998;16(8):743–747. [PubMed] [Google Scholar]
30. Baerlocher GM, Lansdorp PM. Измерение длины теломер в подмножествах лейкоцитов с помощью автоматизированного многоцветного проточного FISH. Цитометрия А. 2003 г., сентябрь 55 (1): 1–6. [PubMed] [Google Scholar]
31. Ortyn WE, Hall BE, George TC, et al. Измерение чувствительности и компенсация в спектральной визуализации. Цитометрия А. 1 августа 2006 г.; 69 (8): 852–862. [PubMed] [Google Scholar]
32. Ortyn WE, Perry DJ, Venkatachalam V, et al. Увеличенная глубина резкости изображения для высокоскоростного анализа клеток.