Рисунки по клеточкам в тетради сложные для 10 лет: Рисунки Сложные По клеточкам в тетради (149 картинок)
Рисунки по клеточкам для детей легкие
Повторить рисунок по клеточкам
Рисование по клеткам
Рисунки по клеточкам
Рисование по клеткам
Рисунки в клеточку
Рисунки по клеточкам лёгкие для детей
Геометрические рисунки по клеточкам легкие
Раскраски для мальчиков 10 лет по клеточкам
Рисунки по клеточкам простые
Рисование по клеточкам для детей
Рисование по клеточкам в тетради для начинающих
Рисование по клеточкам для детей
Рисунок по клеточкам для детей
Рисование. Потклетоскам для детей
Рисунок по клеткам легкий
Домик по клеточкам
Рисование. Потклетоскам для детей
Рисунки по клеточкам для дошкольников легкие
Рисунки по клеточкам
Рисунки по клеткам
Рисунки по клеточкам
Фигурки по клеточкам для детей
Рисунок по клеточкам для детей
Рисование фигур по клеткам
Графический диктант для начинающих дошкольников простой
Рисунки по клеточкам маленькие
Рисование по клеточкам узоры
Рисунки по клеточкам
Рисование по клеточкам для детей
Рисунки по клеточкам
Рисунки по клеточкам в тетради
Фламинго по клеточкам
Рисунки по клеточкам маленькие
Схемы графического диктанта для дошкольников
Графический диктант по стрелочкам для дошкольников
Рисование по клеточкам в тетради маленькие
Графический диктант под диктовку для дошкольников
Рисование ИПО клеточка
Рисование по клеточкаv
Графический диктант белка для дошкольников
Раскраски по клеткам
Рисунки по клеткам хаски
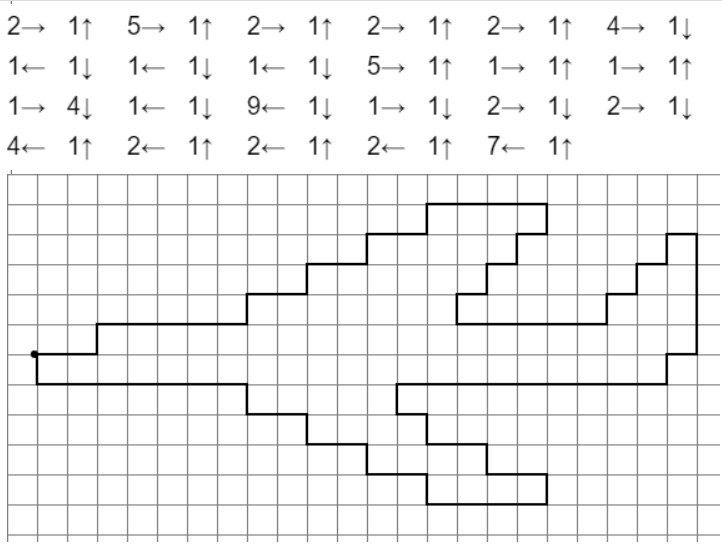
Математический диктант по клеточкам для детей 6-7 лет
Рисунки по клеточкам ъ
Рисунки по клеткам маленькие
Рисование по клеткам
Рисунки по клеточкам в тетради лёгкие
Рисование по клеткам
Рисование по клеточкам в тетради Единорог
Рисунки по клеточкам маленькие
Рисунки по клеточкам в тетради
Узоры по клеточкам в тетради
Рисование по клеткам
Котики по клеточкам маленькие
Рисуем по клеточкам для дошкольников
Рисунки по клеточкам для детей легкие
Графический диктант вертолет
Графические диктанты
Рисунки в клеточку в тетради
Рисование по клеточкам в тетради
Рисунок по клеточкам в тетради для 1 класса
Рисование по клеткам зайчик
Зонт по клеточкам для дошкольников
Рисование по клеточкам для дошкольников
Графические узоры по клеточкам
Рисунки по клеточкам маленькие
Рисунки по клеточкам в тетради
Рисование по клеточкам в тетради
Упражнение графический диктант для дошкольников
Рисунки по клеточкам собаки маленькие
Рисунки по клеточкам маленькие
Человек паук по клеточкам
Дорисуй по клеточкам
Рисунки по клеточкам
Рисунки по клеточкам смайлы
Рисунки по клеточкам красивые очень
Очень маленькие рисунки по клеточкам
Лёгкие пиксель арты
Pixel Art 32×32 Пикачу
Пиксельные картиночки
Крутые рисунки по клеточкам
Нутелла по клеткам
Рисунки по клеточкам маленькие
Рисование по пикселям
Очень маленькие рисунки по клеточкам
Маленький рисуночек по клеточкам Планета
Рисование по клеткам
Рисунки для срисовки в клетку
Рисунки по клеточкам в тетради
Рисунки по клеточкам Стикеры
Рисунки по клеточкам прикольные
Рисование по клеткам Куроми
Геометрические рисунки по клеточкам легкие
Рисунки по клеточкам маленькие
Рисунки по клеточкам приложение
Рисунки по клеточкам милые и няшные мордочки
Рисунки по клеточкам Панда
Winnie the Pooh Pixel Art
Вышивка крестом аниме Тоторо
Рисунки по клеточкам слож
Рисование по клеточкам логотипы
Огонь с клеточками
Рисование по клеткам
Рисование по клеткам пони
Радужная лапка по клеточкам
Рисунки по клеточкам в тетради маленькие черно белые
Рисунки по клеточкам сложные
Волк по клеточкам в тетради
Рисунки по клеточкам в тетради
Рисунки по клеткам
Рисунки в клеточку маленькие
Рисунки по клеточкам маленькие
Рисунки по клеточкам
Рисование по пикселям
Рисование по клеточкам Рейнбоу Дэш
Пиксельная Панда
Хедвиг Гарри Поттера пиксель
Рисунки по клеточкам
Рисунки по клеточкам лёгкие приложения
Рисунки по клеточкам череп
Рисунки по клеточкам сердце
Рисунки по клеточкам в тетради лёгкие
Рисунок по клеткам легкий
Рисование по клеточкам для мальчиков
Рисунки по клеточкапм лёгкие
Рисунки по клеточкам
Рисунки по клеткам
Рисунки по клеткам лёгкие
Сердце квадратиками
Рисунки по клеточкам Раду
Рисунки по клеточкам маленькие
Панда вышивка крестом
Схема вышивания крестиком BT 21
Джиглипафф пиксельарт
Рисунки по клеточкам логотипы
Рисование по клеткам 10 лет
Вышивка сердечко на вязаном изделии
Рисунки по клеточкам
Рисунки по клеточкам Лисичка
Рисунки по клеточкам сло
Рисунки по клеточкам девочки маленькие
Кот Пушин вышивка крестиком
Рисунки по клеточкам девушки
Рисунки по клеткам без черного
Милые пиксельные рисунки
Пинки Пай вышивка крестом
Собака по клеточкам в тетради
Цыпленок по клеткам
Рисунки в клеточку крутые
Рисунки по клеточкам
Рисунки по клеточкам маленькие
Контурные рисунки для вышивки
Фенечка кот Саймон схема
Рисование по клеткам легкие
Пиксельное рисование по клеточкам
Рисование по клеточкам пончик
Рисование ИПО клеточка
Jupyter Notebook — рак машинного обучения | Ор Хилтч | Skyline AI
В последние годы, после демократизации науки о данных, во главе с развитием сообщества открытого исходного кода машинного обучения с такими библиотеками, как SciKit-Learn, TensorFlow, PyTorch и Pandas, Jupyter Notebooks стали стандартом де-факто для исследования и разработки в области науки о данных. На самом деле, Jupyter Notebooks сами по себе сыграли важную роль в демократизации науки о данных, сделав ее более доступной за счет устранения входных барьеров, как мы скоро увидим.
На самом деле, Jupyter Notebooks сами по себе сыграли важную роль в демократизации науки о данных, сделав ее более доступной за счет устранения входных барьеров, как мы скоро увидим.
Как и сам язык Python, наиболее распространенный язык Jupyter Kernel , который во многих аспектах является очень свободным языком, ноутбуки Jupyter являются идеальной средой для хакинга в науке о данных.
Объединяя все преимущества Jupyter Notebooks, главная ценность, которая возникает, заключается в том, что использование Notebooks — это простой способ создания истории данных. По этой причине легко относиться к коду блокнота, используя подход «это только для исследования», поведение, поощряемое отсутствием инструментов и стандартов в области машинного обучения и Jupyter Notebooks (например, крайне редко можно увидеть специалиста по обработке данных). запуск ноутбука внутри док-контейнера только для того, чтобы убедиться, что используемые внешние библиотеки докеризованы и не поступают с их собственной машины).
Проблемы начинаются, когда эта история должна взаимодействовать с производственным приложением. Веселая и простая платформа, используемая специалистом по данным, должна быть интегрирована в конвейер данных производственного уровня. Именно здесь почти все преимущества Jupyter становятся недостатками, превращая жизнь инженера машинного обучения в сущий ад. Если в компании нет инженера по машинному обучению, почти каждая строка кода, написанного на Jupyter, может стать серьезным случаем технического долга, замедляя время выхода компании на рынок и доводя ее до сложностей с отладкой как в исследованиях, так и в процессе разработки. этап производства.
К тому времени, как вы это заметите, возможно, вся ваша команда по обработке и анализу данных будет активно использовать записные книжки и что сотни таких вещей в настоящее время время от времени используются для создания некоторых данных, которые вы используете для принятия решений в процессе производства, игнорируя почти каждый важный урок, полученный в мире производственной инженерии и DevOps за последние 20 лет.
Успех Jupyter объясняется многими причинами, большинство из которых связано с устранением барьеров — или, скорее, с упрощением таких вещей, как документация, визуализация данных и кэширование, — особенно для людей, не имеющих серьезного опыта разработки программного обеспечения.
Давайте рассмотрим некоторые из них.
Блокноты позволяют исследователю данных просматривать результаты своего кода в режиме реального времени, иногда , без какой-либо зависимости от других частей их кода. В отличие от работы со стандартной IDE, такой как VSCode или PyCharm, в Jupyter каждая ячейка, исполняемая единица кода, может быть вызвана потенциально в любое время для вывода вывода прямо под кодом.
Это чрезвычайно полезно для исследовательского анализа данных 9Фаза 0004 в любом исследовательском процессе по науке о данных, когда специалисту по данным необходимо играть с данными, извлекать их, изменять их структуру, нарезать и разбивать на части, создавать агрегаты и в целом изучать корреляции и распределения вероятностей, чтобы развить интуицию.![]() о характере данных, которые необходимо смоделировать.
о характере данных, которые необходимо смоделировать.
Например, именно так можно легко представить результаты в режиме реального времени в Jupyter. Первая ячейка (называемая In [12]) выводит выходные данные JSON (output[12]), а вторая печатает тепловую карту на основе цветных кругов, чтобы помочь исследователю данных понять географическое распределение средних платежей Medicare в США:
Хотите разбить данные на бины и построить гистограмму (гистограмма представляет распределение данных путем формирования бинов по диапазону данных, а затем рисования столбцов, показывающих количество наблюдений, попадающих в каждый бин)? Одна строка кода дает вам вывод прямо под вашим кодом и некоторый текст, описывающий, что вы делаете:
Еще одно огромное преимущество (позже мы поймем, почему это может стать большой ловушкой) использования Jupyter заключается в том, что Jupyter автоматически, за кулисами. , поддерживает состояние выполнения каждой отдельной ячейки.
Кэшировать сложно, особенно если ваши навыки разработки программного обеспечения не на высшем уровне. Если вы математик, пытающийся получить какие-то данные для моделирования вещей, последнее, что вам нужно, — это реализовать свои собственные схемы кэширования.
Если вы математик, пытающийся получить какие-то данные для моделирования вещей, последнее, что вам нужно, — это реализовать свои собственные схемы кэширования.
Jupyter волшебным образом решает эту проблему, кэшируя результаты каждой запущенной ячейки. Например, если у вас есть огромная записная книжка, содержащая сотни ячеек кода, и где-то в начале записной книжки (находится ранее в «потоке выполнения» записной книжки) у вас есть, скажем, некоторый код, который выполняет какую-то тяжелую операцию. — например, обучение модели машинного обучения или загрузка гигабайт данных с удаленного сервера, с Jupyter у вас есть ноль касается кэширования результатов этих операций.
Обычно, если вы пишете код Python, вы реализуете простую схему кэширования или используете какую-либо библиотеку (например, записывая результаты обученной модели в корзину хранения или сохраняя результаты запроса к БД в локальный файл).
В Jupyter, после того как вы запустили ячейку один раз, пока вы не решите очистить кэш, вы можете просто избежать повторного запуска ее , чтобы насладиться глобальным кэшированием ее последнего выполнения.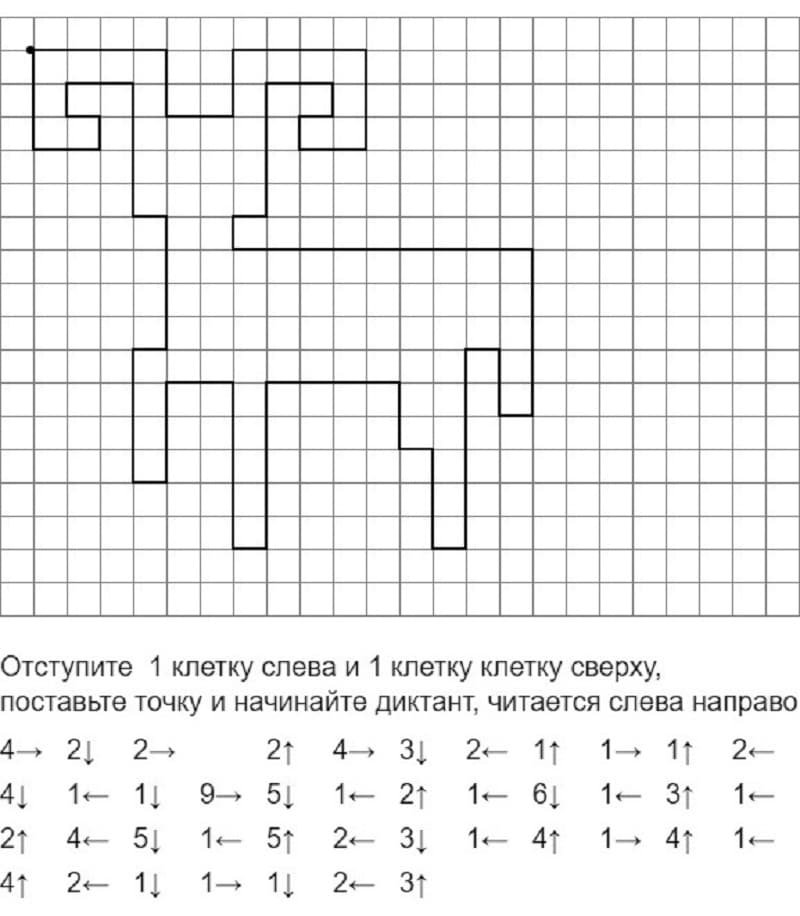 То есть, если бы в ячейке была строка кода, которая делает что-то вроде этого:
То есть, если бы в ячейке была строка кода, которая делает что-то вроде этого:
df = client.query(merge(‘SELECT * FROM MyTable’)).to_dataframe()
Переменная `df` будет хранить назначенные ей данные до тех пор, пока кэш не будет явно очищен или ячейка не будет перезапущена. Потенциально, сотни ячеек ниже, вы можете вызвать df , чтобы получить значение, даже если в последний раз вы запускали ячейку, которая ее заполняет, несколько месяцев назад.
Мы убедились, что блокноты Jupyer отлично подходят для рассказывания историй из данных. Но, если мы не проводим чистое исследование, наше исследование является средством для достижения цели, а именно получения ценной информации из наших историй данных и моделей машинного обучения.
Конвейер машинного обучения производственного уровня должен состоять из поддающихся отладке, воспроизводимых, простых в развертывании и высокопроизводительных компонентов кода, которые можно организовать и запланировать.![]() В версии по умолчанию есть все, чего нет в исследовательском коде Jupyter.
В версии по умолчанию есть все, чего нет в исследовательском коде Jupyter.
Даже если вы проигнорируете тот факт, что кэширование ячеек способствует загрязнению глобальной области кэшированными переменными (см. назначение df выше), поведение кэширования Jupyter по умолчанию заставляет разработчика помнить всю конечную машину блокнота в своих головы.
Какая ячейка с чем кэшируется? Из 400 ячеек могла ли работать ячейка № 273, даже если ячейка № 50 не работала? Что, если бы он запустился, но с другими данными, читая другие данные? Являются ли результаты ячейки № 200 неизменными? т.е. можем ли мы повторно запустить его и получить те же результаты, или повторный запуск завершится ошибкой/вернет другие результаты?
Нет простого способа ответить на любой из этих вопросов при разработке на Jupyter Notebook.
Вы должны полагаться на свою человеческую память, которая не предназначена для запоминания конечных автоматов наизусть, чтобы знать, какая ячейка может работать с другими ячейками или без них, какая ячейка может быть запущена повторно и т. д. Это просто не работает. .
д. Это просто не работает. .
По сути, то, что делает большинство специалистов по данным, когда они не уверены в конечном автомате, просто запускает полный повторный запуск всей записной книжки, что является пустой тратой времени и ресурсов.
Машины состояний не предназначены для того, чтобы люди запоминали их наизустьНо что еще хуже — что происходит, когда вы хотите перенести код исследования в производство ? Либо сами разработчики блокнотов, либо инженеры машинного обучения должны организовать исследовательский код в компоненты кода производственного уровня (помните — отлаживаемые, воспроизводимые и т. д.). Различные части исследовательского кода — части, которые извлекают данные, части, которые обучают модель, части, которые проверяют результаты и т. д., должны быть 9.0003 организовал , и нам нужно запустить их в какой-то форме DAG (см. Apache Airflow).
Но когда у вас есть «история данных», состоящая из сотен ячеек, и единственное, на что вы можете в значительной степени положиться (и это тоже решает разработчик, написавший блокнот), это то, что конечный автомат продвигается по прямой линии «вперед», «в хронологическом порядке», когда вы прокручиваете блокнот вниз… у вас большие проблемы.![]()
Удобный интерфейс командной строки ноутбука Jupyter поддерживает локальное выполнение. Почти уверен, что 99% специалистов по данным используют Jupyter локально, хотя некоторые облачные провайдеры предпринимают преждевременные попытки перенести блокноты в облако (Google Cloud DataLab и AWS SageMaker). Но эти решения преждевременны и имеют множество собственных проблем.
Существует множество проблем с локальным запуском блокнотов, которые усложняют работу инженера по машинному обучению, который будет запускать код блокнота в производство. Прежде всего, зависимости. Блокнот может импортировать библиотеки, которые установлены только на компьютере специалиста по анализу данных.
Если по какой-то причине специалист по данным использует другую версию одной и той же библиотеки, например, NumPy для TensorFlow, фактические математические расчеты в производстве могут отличаться от результатов исследований. Это один из самых больших кошмаров каждой инженерной операции и одна из главных причин успеха контейнерных технологий, таких как Docker, которые обычно не используются при работе с ноутбуками, потому что они предназначены «только для исследований».
Кроме того, результаты записной книжки, полученные при локальном выполнении, невозможно воспроизвести. Ноутбук не проходит процесс сборки и не должен соответствовать стандартам CI, применяемым сервером сборки. Вполне может быть, что результаты будут другими при работе на машине другого члена команды только из-за некоторых различий в кэшировании между машинами.
Конечно, производительность локальной машины тоже не идеальна, но есть способы обойти это (например, можно подключиться к внешним кластерам, чтобы разгрузить там выполнение тяжелых вычислений).
Существует множество практик, связанных с исследованиями, которые используют отличные библиотеки от серьезных компаний, таких как Google, чтобы устранить трения за счет написания хорошего кода.
Отличным примером этого является магия ячеек Google Cloud Big Query . Магия ячеек в Jupyter — это библиотеки кода, которые могут расширять функциональность ячеек Jupyter Notebook, например, автоматически сохранять результаты в структуру данных.
Рассмотрим следующий пример из официальной документации Google Cloud, Визуализация данных BigQuery в блокноте Jupyter:
%%bigquery total_births
SELECT
source_year AS year,
COUNT(is_male) ASbirth_count
FROM `bigquery-public-data. Samples.natality`
ГРУППИРОВАТЬ ПО году
ORDER BY year DESC
LIMIT 15
Выглядит красиво, правда? Просто жестко закодируйте SQL-запрос в ячейке и разделите набор результатов на кадр данных pandas с именем total_births. Хотя понятно, почему с ним легко работать, на самом деле это очень плохая практика кодирования для всего, кроме чисто научных исследований.
Если ваш ноутбук использует эту магию ячеек повсюду, вы не сможете динамически создавать запросы, используя универсальные функции. Таким образом, если у вас есть два сложных запроса, которые должны быть идентичными, за исключением небольшой части, вы обнаружите, что эти запросы дублируются.
Без магии ячеек средний программист написал бы универсальную функцию для возврата запроса с небольшим изменением:
def get_births_by(period):
return """SELECT
source_period AS {период},
COUNT(is_male) ASbirth_count
FROM `bigquery-public-data.samples.natality`
ГРУППИРОВАТЬ ПО {период}
ПОРЯДОК BY {период} DESC
LIMIT 15""".replace('{период}', период)by_month = get_births_by('месяц')
by_year = get_births_by('год')
Чтобы иметь возможность наслаждаться этой магией клетки, большинство специалистов по данным создали бы повторяющиеся ячейки, одну для года :
%%bigquery total_births
SELECT
source_year AS year,
COUNT(is_male) AS Birthday_count
FROM `bigquery-public-data.samples.natality`
GROUP BY year
ORDER BY year DESC
LIMIT 15
7 906 месяц: 062 %%bigquery total_births
SELECT
source_month КАК месяц,
COUNT(is_male) ASbirth_count
FROM `bigquery-public-data.samples.natality`
GROUP BY month
ORDER BY month DESC
LIMIT 15 3 900 Тип кода очевидно, что это очень плохо, и, скорее всего, инженеру машинного обучения, интегрирующему такого рода исследовательский код в приложение производственного уровня, придется реорганизовать весь код блокнота, чтобы использовать общие функции, которые избегают дублирования кода, не используя какой-либо из этого кода.
Благодаря встроенному кэшированию Jupyter и тому факту, что результаты сохраняются после выполнения записной книжки, легко обмануть чувство стабильности.
Конечно, если я вижу результаты перед глазами под одной из ячеек, то повторный запуск той же ячейки без изменения кода должен дать те же результаты. Верно? Неправильный.
Если ячейка выдает результат на основе данных в БД, и эти данные изменились, и в коде нет ничего, чтобы убедиться, что код работает с конкретным снимком данных, который не изменяется, точно такая же ячейка может вернуть другой результат. И, после повторного запуска ячейки очень трудно узнать, каким был предыдущий результат, потому что Jupyter Notebook ничего не делает для сохранения истории результатов, а решения для управления исходным кодом, такие как git, обычно также не хранят кэши.
Как и многие примеры в этой статье, это не проблема Jupyter, но это хороший пример того, как воспроизводимость предыдущих результатов невозможна без надлежащего инструментария для их создания, и поскольку Jupyter не Если вы не предоставите этот инструментарий, специалист по обработке и анализу данных, не обладающий большими навыками разработки программного обеспечения, скорее всего, пострадает от этого.
Итак, можем ли мы как-то наслаждаться обоими мирами? Имея гибкость и кэширование в стиле Jupyter, с одной стороны, и современные методы кодирования, с другой?
Похоже, что да, или скоро будет так: две самые популярные на сегодняшний день IDE для всего, что связано с наукой о данных, PyCharm и VSCode, обе теперь изначально поддерживают Jupyter (хотя поддержка все еще далека от совершенства).
Интеграция с VSCode JupyerИспользуя встроенную поддержку PyCharm и VSCode для Jupyter, вы можете легко интегрировать решения для управления исходным кодом и использовать такие функции повышения производительности, как IntelliSense, обработка ошибок в реальном времени (в случае возникновения синтаксических ошибок или нарушения соглашений Pylint), интеграция с Git , управление несколькими файлами и многое другое, предлагая специалистам по данным правильный способ экспериментировать и эффективно работать с данными.
В-клетки и антитела – молекулярная биология клетки
Позвоночные неизбежно погибают от инфекции, если они не способны вырабатывать антитела. Антитела защищают нас от инфекции, связываясь с вирусами и микробными токсинами, тем самым инактивируя их (см. Ресурсы). Связывание антител с вторгшимися патогенами также задействует различные типы лейкоцитов и систему белков крови, которые в совокупности называются комплементом (обсуждается в главе 25). Лейкоциты и активированные компоненты комплемента работают вместе, чтобы атаковать захватчиков.
Антитела защищают нас от инфекции, связываясь с вирусами и микробными токсинами, тем самым инактивируя их (см. Ресурсы). Связывание антител с вторгшимися патогенами также задействует различные типы лейкоцитов и систему белков крови, которые в совокупности называются комплементом (обсуждается в главе 25). Лейкоциты и активированные компоненты комплемента работают вместе, чтобы атаковать захватчиков.
Синтезируемые исключительно В-клетками, антитела вырабатываются в миллиардах форм, каждая из которых имеет разную аминокислотную последовательность и свой антигенсвязывающий сайт. В совокупности называемые иммуноглобулинами (сокращенно Ig ), они являются одними из наиболее распространенных белковых компонентов в крови, составляя около 20% общего белка в плазме по весу. Млекопитающие вырабатывают пять классов антител, каждый из которых опосредует характерный биологический ответ после связывания антигена. В этом разделе мы обсудим структуру и функцию антител и то, как они взаимодействуют с антигеном.
В-клетки вырабатывают антитела как в виде рецепторов клеточной поверхности, так и секретируемых молекул
Согласно теории клональной селекции, все молекулы антител, вырабатываемые отдельной В-клеткой, имеют один и тот же антигенсвязывающий сайт. Первые антитела, вырабатываемые вновь образованной В-клеткой, не секретируются. Вместо этого они встраиваются в плазматическую мембрану, где служат рецепторами антигена. Каждая В-клетка имеет приблизительно 10 90 200 5 90 201 таких рецепторов на своей плазматической мембране. Как мы обсудим позже, каждый из этих рецепторов стабильно связан с комплексом трансмембранных белков, которые активируют внутриклеточные сигнальные пути, когда антиген связывается с рецептором.
Каждая В-клетка продуцирует один вид антител, каждое из которых имеет уникальный сайт связывания антигена. Когда наивная В-клетка или В-клетка памяти активируется антигеном (с помощью Т-хелперной клетки), она пролиферирует и дифференцируется в эффекторную клетку, секретирующую антитела.
Рисунок 24-17
Активация В-клеток. Когда наивные В-клетки или В-клетки памяти активируются антигеном (и хелперные Т-клетки — не показаны), они пролиферируют и дифференцируются в эффекторные клетки. Эффекторные клетки продуцируют и секретируют антитела с уникальным антигенсвязывающим действием (подробнее...)
Эффекторные клетки продуцируют и секретируют антитела с уникальным антигенсвязывающим действием (подробнее...)
Типичное антитело имеет два идентичных сайта связывания антигена
Простейшие антитела представляют собой Y-образные молекулы с двумя идентичными сайтами связывания антигена, по одному на конце каждого плеча Y (). Из-за их двух антигенсвязывающих сайтов они описаны как двухвалентные . Пока антиген имеет три или более антигенных детерминант, молекулы двухвалентного антитела могут сшивать его в крупную решетку. Эта решетка может быть быстро фагоцитирована и расщеплена макрофагами. Эффективность связывания антигена и перекрестного связывания значительно повышается за счет гибкого0190 шарнирной области в большинстве антител, что позволяет варьировать расстояние между двумя антигенсвязывающими сайтами ().
Рисунок 24-18
Простое изображение молекулы антитела. Обратите внимание, что два его сайта связывания антигена идентичны.
Рисунок 24-19
Взаимодействия антитело-антиген. Поскольку антитела имеют два идентичных сайта связывания антигена, они могут сшивать антигены. Типы образующихся комплексов антитело-антиген зависят от количества антигенных детерминант на антигене. Здесь единичный вид (далее...)
Поскольку антитела имеют два идентичных сайта связывания антигена, они могут сшивать антигены. Типы образующихся комплексов антитело-антиген зависят от количества антигенных детерминант на антигене. Здесь единичный вид (далее...)
Рисунок 24-20
Шарнирная область молекулы антитела. Благодаря своей гибкости шарнирная область повышает эффективность связывания антигена и перекрестного связывания.
Защитный эффект антител обусловлен не только их способностью связывать антиген. Они участвуют в различных действиях, опосредованных хвостом Y-образной молекулы. Как мы обсудим позже, антитела с одними и теми же сайтами связывания антигена могут иметь любую из нескольких различных хвостовых областей. Каждый тип хвостовой области придает антителу различные функциональные свойства, такие как способность активировать систему комплемента, связываться с фагоцитирующими клетками или проникать через плаценту от матери к плоду.
Молекула антитела состоит из тяжелой и легкой цепей
Основная структурная единица молекулы антитела состоит из четырех полипептидных цепей, двух идентичных легких (L) цепей (каждая содержит около 220 аминокислот) и двух идентичных тяжелых (Н) цепи 90–195 (каждая обычно содержит около 440 аминокислот).
Рисунок 24-21
Схематический рисунок типичной молекулы антитела. Он состоит из четырех полипептидных цепей — двух идентичных тяжелых цепей и двух идентичных легких цепей. Два идентичных сайта связывания антигена, каждый из которых образован N-концевым участком легкой цепи (подробнее...)
Существует пять классов тяжелых цепей, каждый из которых имеет разные биологические свойства
У млекопитающих их пять классы антител, IgA, IgD, IgE, IgG и IgM, каждый со своим классом тяжелой цепи — α, δ, ε, γ и μ соответственно. Молекулы IgA имеют α-цепи, молекулы IgG имеют γ-цепи и так далее. Кроме того, существует ряд подклассов иммуноглобулинов IgG и IgA; например, существует четыре подкласса IgG человека (IgG1, IgG2, IgG3 и IgG4), имеющие γ 1 , γ 2 , γ 3 и γ 4 тяжелых цепей соответственно. Различные тяжелые цепи придают особую конформацию шарнирной и хвостовой областям антител, так что каждый класс (и подкласс) имеет свои собственные характерные свойства.
Различные тяжелые цепи придают особую конформацию шарнирной и хвостовой областям антител, так что каждый класс (и подкласс) имеет свои собственные характерные свойства.
IgM , который имеет тяжелые цепи μ, всегда является первым классом антител, вырабатываемых развивающейся В-клеткой, хотя многие В-клетки в конечном итоге переключаются на выработку других классов антител (обсуждается ниже). Непосредственный предшественник В-клетки, называемый пре-В-клеткой, первоначально образует μ-цепи, которые связываются с так называемыми суррогатные легкие цепи (заменяющие настоящие легкие цепи) и вставляют в плазматическую мембрану. Комплексы μ-цепей и суррогатных легких цепей необходимы клетке для перехода к следующей стадии развития, где она производит настоящие легкие цепи. Легкие цепи объединяются с μ-цепями, заменяя суррогатные легкие цепи, с образованием четырехцепочечных молекул IgM (каждая с двумя μ-цепями и двумя легкими цепями). Затем эти молекулы внедряются в плазматическую мембрану, где они функционируют как рецепторы антигена.
Рисунок 24-22
Основные этапы развития В-клеток. Все показанные стадии происходят независимо от антигена. Когда они активируются своим специфическим чужеродным антигеном и Т-хелперами в периферических лимфоидных органах, зрелые наивные В-клетки пролиферируют и дифференцируются (подробнее...)
IgM — это не только первый класс антител, появляющийся на поверхности развивающейся В-клетки. Это также основной класс, секретируемый в кровь на ранних стадиях первичного ответа антител при первом контакте с антигеном. (В отличие от IgM, молекулы IgD секретируются только в небольших количествах и, по-видимому, функционируют в основном как рецепторы антигена на клеточной поверхности. ) -участок связывания. Каждый пентамер содержит одну копию другой полипептидной цепи, называемой J (соединительная) цепь. J-цепь продуцируется IgM-секретирующими клетками и ковалентно встраивается между двумя соседними хвостовыми областями (1).
) -участок связывания. Каждый пентамер содержит одну копию другой полипептидной цепи, называемой J (соединительная) цепь. J-цепь продуцируется IgM-секретирующими клетками и ковалентно встраивается между двумя соседними хвостовыми областями (1).
Рисунок 24-23
Пентамерная молекула IgM. Пять субъединиц удерживаются вместе дисульфидными связями (красный). Одиночная J-цепь, имеющая структуру, подобную структуре одиночного домена Ig (обсуждается позже), связана дисульфидной связью между хвостами двух тяжелых μ-цепей. (подробнее...)
Связывание антигена с одной секретируемой пентамерной молекулой IgM может активировать систему комплемента. Как обсуждалось в главе 25, когда антиген находится на поверхности вторгшегося патогена, эта активация комплемента может либо пометить патоген для фагоцитоза, либо непосредственно убить его.
Основным классом иммуноглобулина в крови является IgG , представляющий собой четырехцепочечный мономер, продуцируемый в больших количествах во время вторичных иммунных реакций.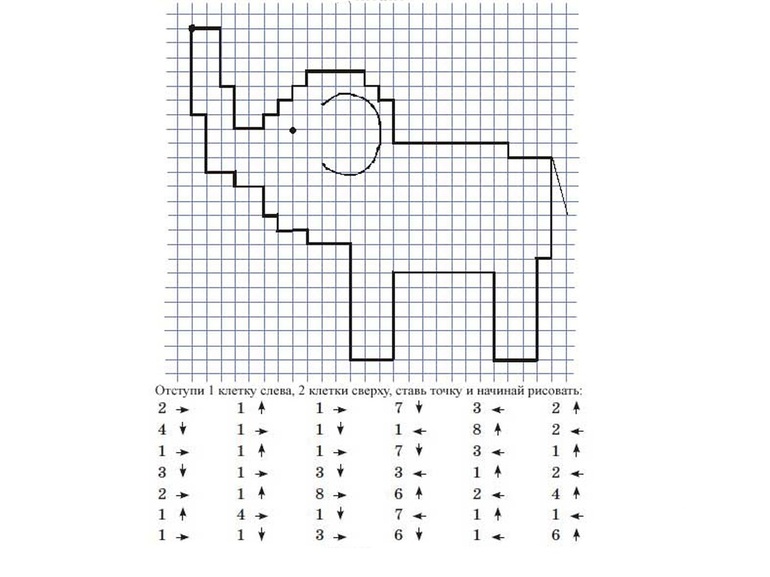 Помимо активации комплемента, хвостовая часть молекулы IgG связывается со специфическими рецепторами на макрофагах и нейтрофилах. В значительной степени с помощью таких Fc-рецепторов (названных так потому, что хвосты антител называются областями Fc ) эти фагоцитирующие клетки связывают, поглощают и уничтожают инфекционные микроорганизмы, которые покрываются антителами IgG, вырабатываемыми в ответ на инфекцию (4).
Помимо активации комплемента, хвостовая часть молекулы IgG связывается со специфическими рецепторами на макрофагах и нейтрофилах. В значительной степени с помощью таких Fc-рецепторов (названных так потому, что хвосты антител называются областями Fc ) эти фагоцитирующие клетки связывают, поглощают и уничтожают инфекционные микроорганизмы, которые покрываются антителами IgG, вырабатываемыми в ответ на инфекцию (4).
Рисунок 24-24
Фагоцитоз, активируемый антителами. (A) Бактерия, покрытая IgG-антителом, эффективно фагоцитируется макрофагом или нейтрофилом, который имеет рецепторы на клеточной поверхности, которые связывают хвостовую (Fc) область молекул IgG. Связывание бактерий, покрытых антителами (подробнее...)
Молекулы IgG являются единственными антителами, которые могут передаваться от матери к плоду через плаценту. Клетки плаценты, находящиеся в контакте с материнской кровью, имеют Fc-рецепторы, которые связывают находящиеся в крови молекулы IgG и направляют их переход к плоду.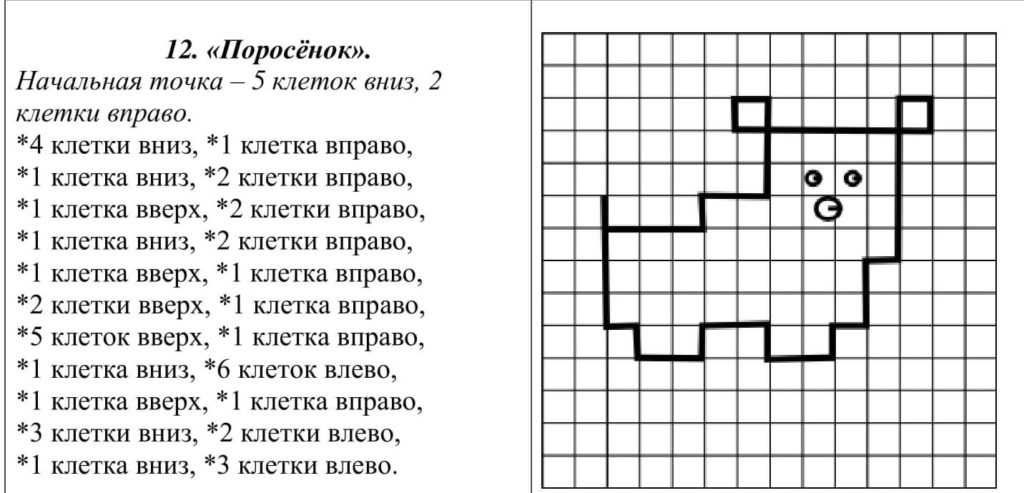 Молекулы антител, связанные с рецепторами, сначала попадают в клетки плаценты посредством рецептор-опосредованного эндоцитоза. Затем они транспортируются через клетку в везикулах и высвобождаются путем экзоцитоза в кровь плода (процесс, называемый трансцитоз, обсуждается в главе 13). Поскольку другие классы антител не связываются с этими конкретными рецепторами Fc, они не могут проходить через плаценту. IgG также секретируются в материнское молоко и попадают из кишечника новорожденного в кровь, обеспечивая защиту ребенка от инфекции.
Молекулы антител, связанные с рецепторами, сначала попадают в клетки плаценты посредством рецептор-опосредованного эндоцитоза. Затем они транспортируются через клетку в везикулах и высвобождаются путем экзоцитоза в кровь плода (процесс, называемый трансцитоз, обсуждается в главе 13). Поскольку другие классы антител не связываются с этими конкретными рецепторами Fc, они не могут проходить через плаценту. IgG также секретируются в материнское молоко и попадают из кишечника новорожденного в кровь, обеспечивая защиту ребенка от инфекции.
IgA представляет собой основной класс антител в выделениях, включая слюну, слезы, молоко, дыхательные и кишечные выделения. В то время как IgA представляет собой четырехцепочечный мономер в крови, в секрете он представляет собой восьмицепочечный димер (11). Он транспортируется через секреторные эпителиальные клетки из внеклеточной жидкости в секреторную жидкость другим типом рецептора Fc, который уникален для секреторного эпителия.![]() Этот рецептор Fc также может транспортировать IgM в секрецию (но менее эффективно), что, вероятно, является причиной того, что люди с селективным дефицитом IgA, наиболее распространенной формой дефицита антител, лишь слегка страдают от этого дефекта.
Этот рецептор Fc также может транспортировать IgM в секрецию (но менее эффективно), что, вероятно, является причиной того, что люди с селективным дефицитом IgA, наиболее распространенной формой дефицита антител, лишь слегка страдают от этого дефекта.
Рисунок 24-25
Сильно схематизированная диаграмма димерной молекулы IgA, обнаруженной в секрете. В дополнение к двум мономерам IgA имеется одна J-цепь и дополнительная полипептидная цепь, называемая секреторным компонентом , , который, как считается, защищает молекулы IgA (подробнее...)
Рисунок 24-26
Механизм транспорта димерной молекулы IgA через эпителиальную клетку. Молекула IgA в виде димера, содержащего J-цепь, связывается с трансмембранным рецепторным белком на непросветной поверхности секреторной эпителиальной клетки. Комплексы рецептор-IgA (подробнее...)
Хвостовая область молекул IgE , представляющих собой четырехцепочечные мономеры, связывается с необычно высокой аффинностью ( K a ~ 10 10 л/моль) еще с одним классом рецепторов Fc. Эти рецепторы расположены на поверхности тучных клеток в тканях и базофилов в крови. Молекулы IgE, связанные с ними, функционируют как пассивно приобретенные рецепторы антигена. Связывание антигена заставляет тучные клетки или базофилы секретировать различные цитокины и биологически активные амины, особенно 9.0190 гистамин
Эти рецепторы расположены на поверхности тучных клеток в тканях и базофилов в крови. Молекулы IgE, связанные с ними, функционируют как пассивно приобретенные рецепторы антигена. Связывание антигена заставляет тучные клетки или базофилы секретировать различные цитокины и биологически активные амины, особенно 9.0190 гистамин
Рисунок 24-27
Роль IgE в секреции гистамина тучными клетками. Тучная клетка (или базофил) связывает молекулы IgE после того, как они секретируются активированными В-клетками. Растворимые антитела IgE связываются с белками рецептора Fc на поверхности тучных клеток, которые специфически распознают (подробнее...)
Тучная клетка (или базофил) связывает молекулы IgE после того, как они секретируются активированными В-клетками. Растворимые антитела IgE связываются с белками рецептора Fc на поверхности тучных клеток, которые специфически распознают (подробнее...)
Помимо пяти классов тяжелых цепей, обнаруженных в молекулах антител, высшие позвоночные имеют два типа легких цепей, κ и λ, которые кажутся функционально неразличимыми. Любой тип легкой цепи может быть связан с любой из тяжелых цепей. Однако отдельная молекула антитела всегда содержит идентичные легкие цепи и идентичные тяжелые цепи: например, молекула IgG может иметь легкие цепи либо κ, либо λ, но не по одной каждой из них. В результате этой симметрии антигенсвязывающие сайты антител всегда идентичны. Такая симметрия имеет решающее значение для перекрестно-связывающей функции секретируемых антител (see).
Свойства различных классов антител человека обобщены в .
Таблица 24-1
Свойства основных классов антител у человека.
Сила взаимодействия антитело-антиген зависит как от количества, так и от аффинности сайтов связывания антигена
Связывание антигена с антителом, как и связывание субстрата с ферментом, является обратимым. Это опосредовано суммой многих относительно слабых нековалентных сил, включая водородные связи и гидрофобные силы Ван-дер-Ваальса, а также ионные взаимодействия. Эти слабые взаимодействия эффективны только тогда, когда молекула антигена расположена достаточно близко, чтобы некоторые из ее атомов могли попасть в комплементарные углубления на поверхности антитела. Комплементарными областями единицы четырехцепочечного антитела являются два идентичных сайта связывания антигена; соответствующая область на антигене представляет собой антигенная детерминанта (). Большинство антигенных макромолекул имеют множество различных антигенных детерминант и считаются мультивалентными; , если два или более из них идентичны (как в полимере с повторяющейся структурой), говорят, что антиген является поливалентным ().
Рисунок 24-28
Связывание антигена с антителом. На этой весьма схематизированной диаграмме показано, как антигенная детерминанта на макромолекуле взаимодействует с антигенсвязывающим участком двух разных молекул антител, одной с высокой аффинностью, а другой с низкой аффинностью. Антигенный (далее...)
Рисунок 24-29
Молекулы с множественными антигенными детерминантами. (A) Показан глобулярный белок с рядом различных антигенных детерминант. Различные участки полипептидной цепи обычно объединяются в складчатую структуру, образуя каждую антигенную детерминанту (подробнее...)
Обратимая реакция связывания между антигеном с одной антигенной детерминантой (обозначается Ag) и одним сайтом связывания антигена ( обозначается Ab) можно выразить как
Точка равновесия зависит как от концентраций Ab и Ag, так и от силы их взаимодействия. Ясно, что большая часть Ab будет ассоциироваться с Ag по мере увеличения концентрации Ag. Сила взаимодействия обычно выражается как константа сродства ( K a ) (см. ), где
), где
(в квадратных скобках указана концентрация каждого компонента при равновесии).
Константу аффинности, иногда называемую константой ассоциации, можно определить путем измерения концентрации свободного Ag, необходимой для заполнения половины антигенсвязывающих участков на антителе. Когда заполнена половина сайтов, [AgAb] = [Ab] и K a = 1/[Ag]. Таким образом, величина, обратная концентрации антигена, обеспечивающая половину максимального связывания, равна константе аффинности антитела к антигену. Общие значения варьируются от 5 × 10 4 до 10 11 л/моль.
Аффинность антитела к антигенной детерминанте описывает силу связывания одной копии антигенной детерминанты с одним сайтом связывания антигена и не зависит от количества сайтов. Однако, когда поливалентный антиген, несущий множество копий одной и той же антигенной детерминанты, объединяется с поливалентным антителом, сила связывания значительно возрастает, поскольку все связи антиген-антитело должны быть разорваны одновременно, прежде чем антиген и антитело смогут диссоциировать. В результате типичная молекула IgG может связываться с поливалентным антигеном по крайней мере в 100 раз сильнее, если задействованы оба сайта связывания антигена, чем если задействован только один сайт. Общая сила связывания поливалентного антитела с поливалентным антигеном называется авидностью взаимодействия.
В результате типичная молекула IgG может связываться с поливалентным антигеном по крайней мере в 100 раз сильнее, если задействованы оба сайта связывания антигена, чем если задействован только один сайт. Общая сила связывания поливалентного антитела с поливалентным антигеном называется авидностью взаимодействия.
Если аффинность антигенсвязывающих сайтов в молекулах IgG и IgM одинакова, молекула IgM (с 10 сайтами связывания) будет иметь гораздо большую авидность к поливалентному антигену, чем молекула IgG (имеющая два связывающих сайта). места). Эта разница в авидности, часто в 10 90 200 4 90 201 раз и более, важна, поскольку антитела, образующиеся в начале иммунного ответа, обычно имеют гораздо более низкую аффинность, чем антитела, образующиеся позже. Из-за высокой общей авидности IgM — основной класс Ig, продуцируемый на ранних стадиях иммунного ответа, — может эффективно функционировать, даже если каждый из его сайтов связывания имеет лишь низкую аффинность.
До сих пор мы рассматривали общую структуру и функцию антител. Далее мы рассмотрим детали их структуры, выявленные в результате изучения их аминокислотной последовательности и трехмерной структуры.
Далее мы рассмотрим детали их структуры, выявленные в результате изучения их аминокислотной последовательности и трехмерной структуры.
Легкие и тяжелые цепи состоят из константных и вариабельных участков
Сравнение аминокислотных последовательностей различных молекул антител выявило поразительную особенность, имеющую важное генетическое значение. Как легкие, так и тяжелые цепи имеют вариабельную последовательность на своих N-концах, но постоянную последовательность на своих С-концах. Следовательно, когда сравниваются аминокислотные последовательности многих различных κ-цепей, С-концевые половины одинаковы или демонстрируют лишь незначительные различия, тогда как все N-концевые половины очень разные. Легкие цепи имеют константная область длиной около 110 аминокислот и вариабельная область того же размера. Вариабельная область тяжелых цепей (на их N-конце) также имеет длину около 110 аминокислот, но константная область тяжелой цепи примерно в три или четыре раза длиннее (330 или 440 аминокислот), в зависимости от класса () .
Рисунок 24-30
Постоянные и вариабельные области цепей иммуноглобулинов. Как легкие, так и тяжелые цепи молекулы антитела имеют разные константные и вариабельные области.
Именно N-концы легкой и тяжелой цепей объединяются, образуя сайт связывания антигена (см. ), а вариабельность их аминокислотных последовательностей обеспечивает структурную основу для разнообразия сайтов связывания антигена. Разнообразие вариабельных областей как легкой, так и тяжелой цепей по большей части ограничено тремя небольшими гипервариабельными областями в каждой цепи; остальные части вариабельной области, известные как каркасные области , , являются относительно постоянными. Только 5–10 аминокислот в каждой гипервариабельной области образуют антигенсвязывающий сайт (2). В результате размер антигенной детерминанты, которую распознает антитело, обычно сравнительно мал. Например, он может состоять из менее чем 25 аминокислот на поверхности глобулярного белка.
Рисунок 24-31
Гипервариабельные области антител. Очень схематичное изображение того, как три гипервариабельные области в каждой легкой и тяжелой цепи вместе образуют антигенсвязывающий сайт молекулы антитела.
Очень схематичное изображение того, как три гипервариабельные области в каждой легкой и тяжелой цепи вместе образуют антигенсвязывающий сайт молекулы антитела.
Легкая и тяжелая цепи состоят из повторяющихся доменов Ig
Как легкая, так и тяжелая цепи состоят из повторяющихся сегментов, каждый из которых имеет длину около 110 аминокислот и каждый содержит одну внутрицепочечную дисульфидную связь. Эти повторяющиеся сегменты складываются независимо друг от друга, образуя компактные функциональные единицы, называемые 9.0194 домены иммуноглобулина (Ig) . Как показано на , легкая цепь состоит из одного вариабельного (V L ) и одного константного (C L ) доменов (эквивалентных вариабельной и константной областям, показанным в верхней половине ). Эти домены соединяются с вариабельным (V H ) и первым константным (C H 1) доменами тяжелой цепи, образуя антигенсвязывающую область. Остальные константные домены тяжелых цепей образуют область Fc, которая определяет другие биологические свойства антитела. Большинство тяжелых цепей имеют три константных домена (C H 1, C H 2 и C H 3), но антитела IgM и IgE имеют четыре.
Большинство тяжелых цепей имеют три константных домена (C H 1, C H 2 и C H 3), но антитела IgM и IgE имеют четыре.
Рисунок 24-32
Иммуноглобулиновые домены. Каждая из легких и тяжелых цепей в молекуле антитела свернута в повторяющиеся домены, сходные друг с другом. Вариабельные домены (заштрихованы синим цветом ) легкой и тяжелой цепей (V L и V H ) образуют антигенсвязывающие (далее...)
Сходство их доменов предполагает, что цепи антител возник в ходе эволюции в результате серии дупликаций генов, начиная с первичного гена, кодирующего один домен из 110 аминокислот с неизвестной функцией. Эта гипотеза подтверждается тем фактом, что каждый домен константной области тяжелой цепи кодируется отдельной кодирующей последовательностью (экзоном) (4).
Рисунок 24-33
Организация последовательностей ДНК, кодирующих константную область тяжелой цепи антитела. Кодирующие последовательности (экзоны) для каждого домена и шарнирной области разделены некодирующими последовательностями (интронами). Интронные последовательности удалены с помощью (подробнее...)
Интронные последовательности удалены с помощью (подробнее...)
Антигенсвязывающий сайт построен из гипервариабельных петель
Ряд фрагментов антител, а также интактные молекулы антител были изучены с помощью рентгеновской кристаллографии. Из этих примеров мы можем понять, каким образом миллиарды различных антигенсвязывающих сайтов построены на общей структурной основе.
Как показано на , каждый домен Ig имеет очень похожую трехмерную структуру, основанную на так называемой складке иммуноглобулина, которая состоит из сэндвича из двух слоев β, удерживаемых вместе дисульфидной связью. Позже мы увидим, что многие другие белки на поверхности лимфоцитов и других клеток, многие из которых функционируют как молекулы межклеточной адгезии (обсуждается в главе 19), содержат аналогичные домены и, следовательно, являются членами очень большого иммуноглобулина 90–190 (Ig). надсемейство белков.
Рисунок 24-34
Свернутая структура молекулы антитела IgG, основанная на исследованиях с помощью рентгеновской кристаллографии. Структура всего белка показана в середине, тогда как структура константного домена показана слева, а структура вариабельного домена - справа. Оба (подробнее...)
Структура всего белка показана в середине, тогда как структура константного домена показана слева, а структура вариабельного домена - справа. Оба (подробнее...)
Вариабельные домены молекул антител уникальны тем, что каждый из них имеет свой особый набор из трех гипервариабельных областей, которые расположены в виде трех гипервариабельных петель (см. ). Гипервариабельные петли как легкого, так и тяжелого вариабельных доменов группируются вместе, образуя антигенсвязывающий сайт. Поскольку вариабельная область молекулы антитела состоит из высококонсервативного жесткого каркаса с гипервариабельными петлями, прикрепленными к одному концу, огромное разнообразие антигенсвязывающих сайтов может быть получено путем изменения только длины и аминокислотной последовательности гипервариабельных петель. Общая трехмерная структура, необходимая для функционирования антител, остается постоянной.
Рентгеновский анализ кристаллов фрагментов антител, связанных с антигенной детерминантой, точно показывает, как гипервариабельные петли легких и тяжелых вариабельных доменов взаимодействуют, образуя антигенсвязывающую поверхность в конкретных случаях. Размеры и форма каждого отдельного сайта варьируются в зависимости от конформаций полипептидной цепи в гипервариабельных петлях, которые, в свою очередь, определяются последовательностями боковых цепей аминокислот в петлях. Форма мест связывания сильно различается — от карманов до канавок, волнистых плоских поверхностей и даже выступов — в зависимости от антитела (4). Лиганды меньшего размера имеют тенденцию связываться с более глубокими карманами, тогда как лиганды большего размера имеют тенденцию связываться с более плоскими поверхностями. Кроме того, сайт связывания может изменить свою форму после связывания антигена, чтобы лучше соответствовать лиганду.
Размеры и форма каждого отдельного сайта варьируются в зависимости от конформаций полипептидной цепи в гипервариабельных петлях, которые, в свою очередь, определяются последовательностями боковых цепей аминокислот в петлях. Форма мест связывания сильно различается — от карманов до канавок, волнистых плоских поверхностей и даже выступов — в зависимости от антитела (4). Лиганды меньшего размера имеют тенденцию связываться с более глубокими карманами, тогда как лиганды большего размера имеют тенденцию связываться с более плоскими поверхностями. Кроме того, сайт связывания может изменить свою форму после связывания антигена, чтобы лучше соответствовать лиганду.
Рисунок 24-35
Антигенсвязывающие участки антител. Гипервариабельные петли различных доменов V L и V H могут комбинироваться, образуя большое разнообразие связывающих поверхностей. Антигенные детерминанты и сайт связывания антигена антител показаны красным цветом 90–190. Только одно антигенсвязывающее (далее. ..)
..)
Теперь, когда мы обсудили структуру и функции антител, мы готовы рассмотреть ключевой вопрос, который долгие годы озадачивал иммунологов: каковы генетические механизмы, обеспечивающие каждое из нам сделать многие миллиарды различных молекул антител?
Резюме
Антитела защищают позвоночных от инфекции, инактивируя вирусы и микробные токсины и привлекая систему комплемента и различные типы лейкоцитов для уничтожения вторгшихся патогенов. Типичная молекула антитела имеет Y-образную форму с двумя идентичными антигенсвязывающими сайтами на концах Y и сайтами связывания компонентов комплемента и/или различных рецепторов клеточной поверхности на хвосте Y.
Каждый клон В-клеток образует молекулы антител с уникальным сайтом связывания антигена. Первоначально во время развития В-клеток в костном мозге молекулы антител встраиваются в плазматическую мембрану, где они служат рецепторами для антигена. В периферических лимфоидных органах связывание антигена с этими рецепторами вместе с костимулирующими сигналами, обеспечиваемыми Т-хелперами, активирует пролиферацию В-клеток и их дифференцировку либо в клетки памяти, либо в эффекторные клетки, секретирующие антитела. Эффекторные клетки секретируют антитела с тем же уникальным сайтом связывания антигена, что и мембраносвязанные антитела.
Эффекторные клетки секретируют антитела с тем же уникальным сайтом связывания антигена, что и мембраносвязанные антитела.
Типичная молекула антитела состоит из четырех полипептидных цепей, двух идентичных тяжелых цепей и двух идентичных легких цепей. Части как тяжелой, так и легкой цепей обычно объединяются, образуя сайты связывания антигена. Существует пять классов антител (IgA, IgD, IgE, IgG и IgM), каждый из которых имеет характерную тяжелую цепь (α, δ, ε, γ и μ соответственно). Тяжелые цепи также образуют хвост (область Fc) антитела, который определяет, какие другие белки будут связываться с антителом и, следовательно, какими биологическими свойствами обладает класс антител. Любой тип легкой цепи (κ или λ) может быть связан с любым классом тяжелой цепи, но тип легкой цепи, по-видимому, не влияет на свойства антитела, кроме его специфичности в отношении антигена.
Каждая легкая и тяжелая цепь состоит из ряда доменов Ig — структур β-слоев, содержащих около 110 аминокислот.